
4 курс / Общая токсикология (доп.) / Врожденные пороки сердца
.pdf1002 |
Часть 12. КОМПЛЕКСНЫЕ ВРОЖДЕННЫЕ ПОРОКИ СЕРДЦА |
|
|
|
|
риоде был меньше чем 2 см2/м2, в последующем всегда развивалось субаортальное сужение, кото рое требовало его устранения. Эти данные были получены у больных с ЕЖС по левожелудочково му типу с выпускной камерой для аорты и, таким образом, неприменимы при других вариантах функционально единственного желудочка. Тем не менее этот принцип может быть использован у больных, у которых основная аномалия сочетается с коарктацией аорты или гипоплазий восходящей аорты. В таких случаях наблюдается также некото рое сужение выводного отдела с последующим об разованием субаортального стеноза в постнеона тальном периоде, поэтому считается целесообраз ным произвести устранение этих сужений.
Выбор методики устранения сужений на пути выхода крови в системный круг кровообращения зависит не только от его локализации, но и от рас положения магистральных артерий, а также нап равленности дуги аорты.
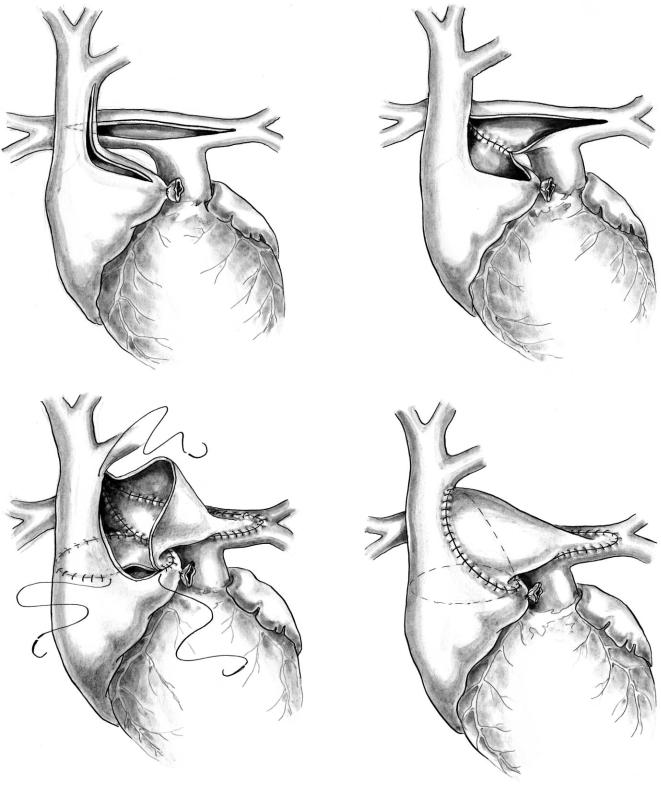
У большинства новорожденных субаортальное сужение устраняют путем выполнения процедуры Damus–Kaye–Stansel или ее модификаций (38– 40). У детей с нормальным расположением маги стральных артерий такую операцию выполняют по методике, которая применяется при синдроме гипоплазии левых отделов сердца.
Операцию осуществляют в условиях глубокой гипотермии и полной остановки кровообращения. Канюлируют восходящую аорту и правое предсер дие. Если имеется резкое сужение дуги аорты, ис пользуют две артериальные канюли. Отдельно ка нюлируют восходящую аорту и легочный ствол. Из легочного ствола через ОАП перфузируется бассейн нисходящей аорты, а из восходящей аор ты — брахиоцефальные сосуды. При канюляции только восходящей аорты выделяют и перевязыва ют ОАП сразу после начала искусственного крово обращения, чтобы кровь из аорты не поступала в легкие. При использовании двух артериальных ка нюль под легочные артерии подводят лигатурные петли, которые затягивают в начале перфузии.
Для предотвращения попадания воздуха в сосу ды головного мозга во время полной остановки кровообращения лигатурными петлями также пе режимают плечеголовные артерии.
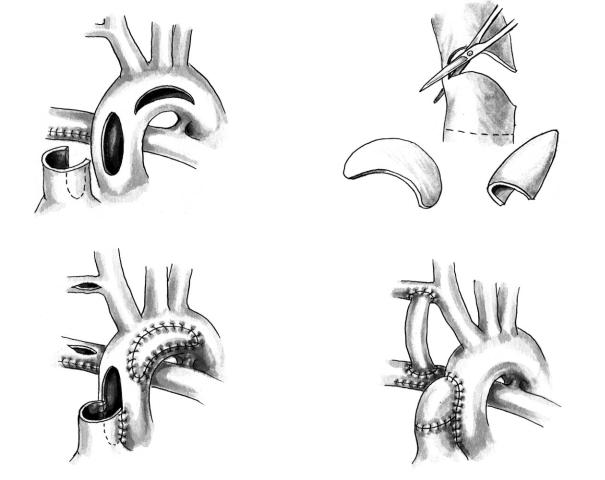
После введения кардиоплегического раствора и остановки кровообращения рассекают легочный ствол у самой бифуркации. Отверстие в дисталь ном конце ствола ушивают непрерывным швом или закрывают аутоперикардиальной заплатой (рис. 6). Использование заплаты позволяет избе жать образования деформаций легочных артерий. В случаях, когда канюлируют только восходящую
аорту, рассекают легочный ствол и закрывают от верстие в дистальном конце до остановки сердеч ной деятельности и кровообращения.
Продольным разрезом справа рассекают восхо дящую аорту в задней ее части. Начинают разрез ниже уровня рассечения легочного ствола. Его нап равляют вверх и заканчивают в месте отхождения безымянной артерии. Так же продольно рассекают проксимальный конец легочного ствола. Оба раз реза анастомозируют между собой непрерывным швом. Оставшиеся свободными часть окружности легочного ствола и разреза аорты соединяют между собой с помощью гомографта. Заплата должна иметь форму полуконуса, длина основания которо го должна соответствовать длине оставшейся сво бодной окружности проксимального конца легоч ного ствола, а стороны — длине разреза аорты.
При наличии сужения на уровне дуги аорты его расширяют путем вшивания отдельной заплаты. Для этого на боковой стенке восходящей аорты де лают второй продольный разрез. Из восходящей аорты его направляют на дугу и дальше на нисхо дящую часть, ниже расположения ОАП. Очень важно, чтобы обе вшитые заплаты перекрывали друг друга. Это делают в целях предотвращения образования сужения сегмента аорты, располо женного между заплатами. В случаях, когда имеет ся стеноз или атрезия одного из AV клапанов, проверяют величину межпредсердного дефекта. Если он небольшой, его расширяют. Операцию завершают наложением модифицированного анастомоза по Blelock–Taussig. Его накладывают после возобновления искусственного кровообра щения и удаления воздуха из полостей сердца.
У больных с обструкцией выхода в большой круг кровообращения только на субаортальном уровне можно применить модификации, предус матривающие прямой анастомоз между легочным стволом и восходящей аортой.
Второй способ устранения субаортального су жения заключается в расширении межжелудочко вого сообщения с одновременным суживанием легочного ствола. Данный метод более физиоло гичен. Различия между двумя способами заключа ются в том, что после суживания легочного ствола кровь в легкие поступает только во время систолы желудочков, поэтому диастолическое давление ос тается высоким и коронарный кровоток не умень шается. У больных с наличием системно легочно го шунтирования после процедуры Damus– Kay–Stansel кровь в легочные артерии поступает как в систолу, так и в диастолу. В результате из за сниженного диастолического давления страдает коронарный кровоток.
Глава 63. ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ ПОРОКОВ СЕРДЦА С ФУНКЦИОНАЛЬНО ЕДИНСТВЕННЫМ ЖЕЛУДОЧКОМ |
1003 |
|
|
|
|
а
б
в г
Рис. 6. Операция Damus–Kaye–Stansel: а — разрезы на восходящей аорте, дуге и легочном стволе; б — формирование заплаты; в — анастомозирование легочного ствола и аорты; г — окончательный вид операции
Техника расширения бульбовентрикулярного |
Особенности послеоперационного ведения |
отверстия описана Cheung и соавторами (41). Опе |
Ведение больных с функционально единствен |
рацию выполняют в условиях искусственного кро |
ным желудочком сердца, перенесших паллиатив |
вообращения с применением глубокой гипотер |
ное вмешательство, заключается в создании ба |
мии и кардиоплегии. Иногда бульбовентрикуляр |
ланса между системным и легочным кровообра |
ное отверстие можно расширить доступом через |
щением. Если послеоперационное течение ослож |
разрез аорты, но в грудном возрасте чаще всего |
няется чрезмерным цианозом или неадекватным |
приходится применять разрез инфундибулярной |
сердечным выбросом, требуется срочное проведе |
выпускной камеры. Очень важно во время расши |
ние эхокардиографического или ангиографичес |
рения бульбовентрикулярного отверстия не пов |
кого исследования для выявления остаточных |
редить проводящие пути. Отверстие расширяют за |
анатомических дефектов. |
счет иссечения перегородки в нижнелевом нап |
|
равлении (т.е. по направлению к тупому краю |
Хирургическая тактика |
сердца). Разрез инфундибулярной части закрыва |
в постнеонатальном периоде |
ют заплатой, которая также способствует расши |
|
рению подаортального выводного тракта. Сужива |
Ведение больных с одножелудочковым сердцем |
ние легочного ствола выполняют во время согре |
в постнеонатальном периоде направлено на лече |
вания больного. Окончательное суживание и из |
ние застойной сердечной недостаточности и созда |
мерение давления в легочной артерии осущес |
ние благоприятных условий для последующей кор |
твляют после окончания искусственного кровооб |
рекции гемодинамики по Fontan. При застойной |
ращения и стабилизации сердечной деятельности. |
сердечной недостаточности в дооперационном и |
|
послеоперационном периодах назначают дигок |
|
син, диуретики и АПФ (каптоприл, капотен). |
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
1004 |
Часть 12. КОМПЛЕКСНЫЕ ВРОЖДЕННЫЕ ПОРОКИ СЕРДЦА |
|
|
|
|
Наиболее частыми проблемами в постнеона тальном периоде являются рестеноз дуги аорты, прогрессирование или развитие субаортальных сужений, ухудшение функции желудочка или АV клапанов, а также повышение ЛСС. Устойчивость к медикаментозному лечению застойной сердеч ной недостаточности является одним из первых клинических сигналов развития сужения на уров не дуги аорты или субаортального стеноза. Нес мотря на то что с помощью эхоКГ большинство из этих сопутствующих пороков могут быть диагнос тированы, необходимо произвести катетеризацию полостей сердца на протяжении первых 6 мес жиз ни ребенка. Это необходимо выполнить в целях измерения давления в легочной артерии и объем ной перегрузки легких, вычисления ЛСС, выявле ния крупных коллатеральных артерий, которые являются причиной перегрузки легочного сосу дистого русла. Во время зондирования полостей сердца необходимо попытаться перекрыть систем но легочные коллатеральные артерии с помощью катетерных технологий.
Хирургическая тактика постнеонатального пе риода предусматривает хирургические вмеша тельства, направленные на ограничение систоли ческой и объемной нагрузки на единственный же лудочек. Для устранения перегрузки желудочка давлением используют ранее описанные вмеша тельства. Объемную перегрузку желудочка устра няют путем закрытия системно легочных шунтов и создания прямого сообщения между системны ми венами и легочными артериями. Это достига ется путем создания двунаправленного кавопуль монального анастомоза (ДКПА) или операции Fontan. Важно осознавать, что в результате гемо динамической коррекции по Fontan образуется физиологическое состояние, при котором вся энергия, потребляемая сердечно сосудистой сис темой, обеспечивается единственным желудоч ком. Поэтому последовательное соединение сис темного и легочного кровообращения предпочти тельнее параллельного.
Таким образом, главной задачей хирургичес кой стратегии при аномалиях сердца с функцио нально единственным желудочком является соз дание анатомо физиологических условий для вы полнения полной коррекции по Fontan в опти мальном возрасте. Ведение больных должно быть направлено на решение двух задач: смягчение клинического синдрома и устранение анатоми ческих и функциональных факторов, препятству ющих выполнению операции Fontan.
Роль кавопульмонального анастомоза в хирургическом лечении одножелудочкового сердца
Анастомоз между ВПВ и правой легочной арте рией является частичной коррекцией гемодина мики в обход правого желудочка. На данном этапе развития кардиохирургии очень редко использует ся классический вариант этого вмешательства. Преимущество отдается более совершенной моди фикации в виде ДКПА. Кавопульмональный анас томоз может применяться в целях этапного лече ния перед операцией Fontan и как окончательный вариант лечения у больных с одножелудочковым сердцем, сочетающимся с аномальным впадением НПВ в виде непарного или полунепарного ее про должения в ВПВ. Этот метод играет важную роль в хирургическом лечении пациентов с наличием факторов риска для выполнения полной гемоди намической коррекции. К таким факторам отно сятся (42, 43):
•наличие деформаций легочных артерий;
•повышенное давление в легочной артерии (> 15 мм рт. ст.);
•повышенное ЛСС (индекс Wood > 2 ед);
•наличие атрезии левого AV клапана или общего AV клапана;
•наличие субаортального стеноза;
•наличие недостаточности АV клапанов;
•сочетание ЕЖС с ТАДЛВ (42, 43).
Особую роль играет ДКПА в лечении синдрома гипоплазии правого желудочка. При этой патоло гии его применяют как окончательный вариант хирургического лечения в сочетании с корригиру ющими операциями, выполняемыми на внутри сердечном уровне (закрытие сообщений на уровне предсердий и желудочков, устранение стеноза или атрезии легочной артерии). В данной ситуации ги поплазированный правый желудочек вовлекается в легочное кровообращение, создавая пульсирую щий кровоток. Для предотвращения перегрузки недоразвитого желудочка венозный возврат из верхней половины туловища отводят через ДКПА непосредственно в легочную артерию.
Двунаправленный кавопульмональный анас томоз имеет несколько преимуществ перед сис темно легочными анастомозами. Он не увеличива ет объемную нагрузку на желудочек, который, по определению, несет избыточную нагрузку по обес печению системного и легочного кровотока, не способствует повышению ЛСС, несет в легочную артерию венозную кровь, а не артериально веноз ную смесь, уменьшает объем крови, попадающей в правое предсердие. В отличие от классической
Глава 63. ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ ПОРОКОВ СЕРДЦА С ФУНКЦИОНАЛЬНО ЕДИНСТВЕННЫМ ЖЕЛУДОЧКОМ |
1005 |
|
|
|
|
операции, при ДКПА правая легочная артерия и легочный ствол не разобщены и кровь из ВПВ пос тупает в оба легких, сохраняется возможность по падания крови из бассейна НПВ в оба легких.
Степень повышения оксигенации артериаль ной крови после выполнения ДКПА зависит от возраста больного, дополнительных источников кровоснабжения легких и наличия непарного или полунепарного продолжения НПВ в ВПВ. В про цессе роста ребенка количество крови, притекаю щей из системы ВПВ, меняется (44). Так, у ново рожденных оно составляет 49% объема циркули рующей крови, у детей в возрасте 2,5 года достига ет 55%, а затем с развитием ребенка постепенно уменьшается и после 6 лет составляет 35%. Поэто му клинический эффект ДКПА значительно луч ше у детей младшего возраста. У больных с нали чием дополнительных источников кровоснабже ния легких в виде системно легочных коллате ральных артерий или сохраненного кровотока че рез стенозированное устье легочного ствола отме чается более высокий уровень насыщения артери альной крови кислородом. В случаях с непарным или полунепарным продолжением НПВ в ВПВ после выполнения ДКПА наблюдается значитель ное повышение артериальной сатурации кислоро дом. Это обусловлено тем, что в процессе оксиге нации не участвует только кровь из коронарного синуса и печеночной вены.
В некоторых клиниках ДКПА формируют всем больным с функционально единственным желу дочком, рассматривая его как подготовительную стадию лечения (34). ДКПА выполняют детям в возрасте 6–12 мес, а операцию Fontan — в возрасте 2 года. Применение такой схемы позволяет значи тельно раньше исключить источники объемной пе регрузки желудочка и, таким образом, добиться лучшего окончательного результата. Этапное фор мирование кровообращения по Fontan способству ет меньшему изменению геометрии желудочка по сравнению с одностадийным выполнением полной гемодинамической коррекции. Выраженные изме нения геометрии желудочка после операции Fontan способствуют снижению сердечного выброса в раннем послеоперационном периоде (45).
Forbes и соавторы (46) установили разницу вли яния ДКПА на изменение массы желудочка у па циентов, которым кавопульмональный анастомоз был сформирован в раннем детстве и в старшем возрасте. Если у маленьких детей после выполне ния ДКПА наблюдалась явная регрессия массы желудочка, то у подростков эти изменения были малоубедительными.
Одним из самых дискуссионных вопросов яв ляется выбор альтернативных решений: оставлять ли выход из правого желудочка через стенозиро ванный клапан легочной артерии или полностью закрыть его? Некоторые авторы отмечают, что у больных с оставленным выходом в легочный ствол течение послеоперационного периода было более тяжелое, чем у тех, которым выход закрывали (34). При сохранении антеградного кровотока чаще от мечали транссудацию в плевральные полости и развитие хилоторакса в позднем послеоперацион ном периоде (47). Другие констатировали, что больных с дополнительным источником кровена полнения легких через легочный ствол удавалось быстрее отлучить от механической вентиляции легких и укоротить сроки лечения в отделении ин тенсивной терапии (48). Эти авторы считают, что сохранение пульсирующего кровотока в легочных артериях предотвращает развитие артериовеноз ных фистул в легких и системно легочных колла тералей. Также одной из положительных сторон этого подхода они считают сохранение возмож ности роста легочных артерий.
У пациентов с сохраненным кровотоком через легочный ствол наблюдается более высокое насы щение артериальной крови кислородом, однако это достигается ценой объемной перегрузки желу дочка. Поэтому объем легочного кровотока в каж дом случае следует подбирать таким образом, что бы предотвратить объемную перегрузку желудочка и повышение давления в ВПВ.
Из собственного опыта мы можем отметить, что результаты выполнения ДКПА лучше в группе больных без дополнительного источника кровос набжения легких через легочный ствол. У таких больных легче протекал ранний послеоперацион ный период и в большинстве случаев отмечалось хорошее клиническое состояние на протяжении 1 года — 6 лет (49).
Aeba и соавторы (50) считают необходимым ос тавлять частичный кровоток через легочный ствол у пациентов с низким давлением в ВПВ и недоста точным насыщением артериальной крови кисло родом. Miyaji и соавторы (51) установили, что пос ле формирования ДКПА значительно уменьшает ся количество факторов риска для выполнения операции Fontan (с 1,8 +1,1 до 0,7+0,8). У пациен тов с пульсирующим кровотоком необходимость полной гемодинамической коррекции возникает значительно реже.
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
1006 |
Часть 12. КОМПЛЕКСНЫЕ ВРОЖДЕННЫЕ ПОРОКИ СЕРДЦА |
|
|
|
|
Техника выполнения классического анастомоза между ВПВ и правой легочной артерией
Эта операция заключается в анастомозирова нии ВПВ с дистальным концом правой легочной артерии по типу «конец в бок». Ее выполняют че рез боковую торакотомию справа. Контроль давле ния в ВПВ осуществляют через катетер, поставлен ный в одну из центральных вен. Боковую торако томию выполняют по IV межреберному промежут ку справа. Правую легочную артерию и ее ветви, а также ВПВ тщательно освобождают от окружаю щих тканей, стараясь не повредить диафрагмаль ный нерв, проходящий рядом с этими сосудами. Под ветви правой легочной артерии подводят лига турные петли, которые затягивают во время фор мирования анастомоза. Сосудистым зажимом пе режимают проксимальный конец правой легочной артерии в месте, где она отходит от ствола, и пере секают ее поперечным разрезом. Проксимальный конец правой легочной артерии ушивают непре рывным швом. На некотором расстоянии от места впадения в полую вену перевязывают непарную вену. Заднебоковую поверхность ВПВ отжимают сосудистым зажимом. Непарную вену вскрывают поперек, вблизи от впадения ее в полую вену. Ко нец непарной вены, который остается со стороны полой вены, вскрывают продольным разрезом с переходом на полую вену. Затем разрез удлиняют на ВПВ в нижнем направлении. Проленовой нитью 6/0 дистальный конец правой легочной ар терии анастомозируют с боковой стенкой ВПВ. Для предотвращения сужения соустья переднюю губу лучше сшивать отдельными швами. После окончательного формирования анастомоза ВПВ перевязывают толстой лавсановой нитью в месте соединения ее с правым предсердием.
При выполнении классического кавопульмо нального анастомоза важно знать, есть ли допол нительная левая верхняя полая вена (ЛВПВ). Если она имеется и отсутствует связь ЛВПВ с правой верхней полой веной (ПВПВ) посредством плече головной вены, выполнение классической моди фикации кавопульмонального анастомоза чревато возникновением осложнений со стороны голов ного мозга (52). Если же обе ВПВ соединены меж ду собой крупной плечеголовной веной, можно выполнить анастомоз и перевязать ЛВПВ. Иногда перевязка ЛВПВ может привести к возникнове нию инфаркта миокарда. Это бывает в тех случаях, когда атрезировано устье коронарного синуса и кровь из вен сердца дренируется в ЛВПВ (53–58).
Техника выполнения ДКПА
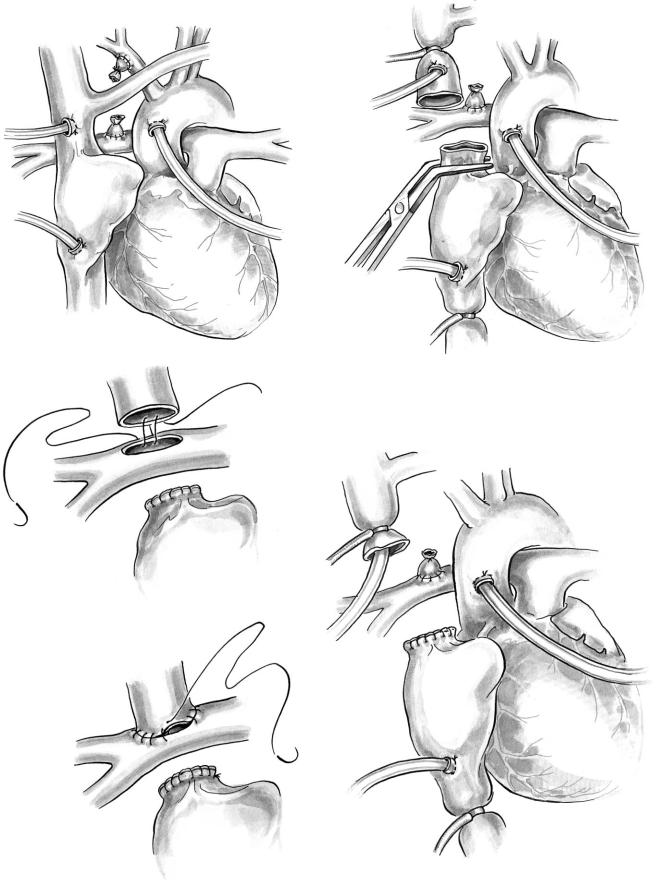
Эта операция может быть выполнена с исполь зованием искусственного кровообращения или без него. Мы предпочитаем выполнять ее через срединный доступ в условиях искусственного кро вообращения. Мобилизуют легочную артерию и ее долевые ветви с той стороны, где предполагают наложить соустье. Верхнюю полую вену освобож дают от перикарда до места впадения в нее левой плечеголовной вены. Канюлируют аорту, ВПВ (высоко) или плечеголовную вену, НПВ. Анасто моз формируют сразу же после начала искусствен ного кровообращения, на сокращающемся серд це. При наличии ранее выполненного системно легочного анастомоза его пережимают и отсекают от легочной артерии (рис. 7, а). Перевязывают так же непарную вену. ВПВ рассекают на 4–5 мм вы ше кавоатриального соединения (рис. 7, б). Голов ной конец вены анастомозируют с продольным разрезом верхнего края правой легочной артерии, а сердечный — ушивают непрерывным швом (рис. 7, в) или закрывают заплатой из аутоперикарда. При наличии системно легочного анастомоза ВПВ соединяют с легочной артерией в месте отсе ченного системно легочного анастомоза. Мы обычно не канюлируем ВПВ через ее стенку, так как это ограничивает ее подвижность. Перфузию начинаем с одним венозным катетером в правом предсердии. По латеральным сторонам ВПВ нак ладываем два шва держалки, которые позволяют избежать перекручивания вены при анастомози ровании с легочной артерией. После пересечения ВПВ в ее зияющий просвет вводим венозный ка тетер и обжимаем вокруг него полую вену турни кетом (рис. 7, г). Швы держалки позволяют приб лизить вену к разрезу правой легочной артерии. Катетер не мешает выполнению анастомоза. Пос ле наложения основной части линии шва удаляем катетер и оставшуюся часть разрезов закрываем отдельными узловыми швами для исключения эф фекта кисета и обеспечения возможности роста соустья.
У больных с функционально единственным же лудочком сердца, особенно сочетающимся с гетеро таксией и предсердным изомеризмом, часто имеют место аномалии системного и легочного венозного возврата. В этих случаях нередко бывают билате ральные ВПВ и обязательным условием является анастомозирование обеих вен с правой и левой вет вями легочной артерии во избежание перетока ве нозной крови из правой вены в левую. При наличии АЛА в неонатальном периоде необходимо наложить
Глава 63. ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ ПОРОКОВ СЕРДЦА С ФУНКЦИОНАЛЬНО ЕДИНСТВЕННЫМ ЖЕЛУДОЧКОМ |
1007 |
|
|
|
|
а
б
в |
г |
|
Рис. 7. Схема выполнения ДКПА
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
1008 |
Часть 12. КОМПЛЕКСНЫЕ ВРОЖДЕННЫЕ ПОРОКИ СЕРДЦА |
|
|
|
|
а |
|
б |
|
|
|
|
|
|
|
|
г |
|
в |
|||
|
|
||
|
|
|
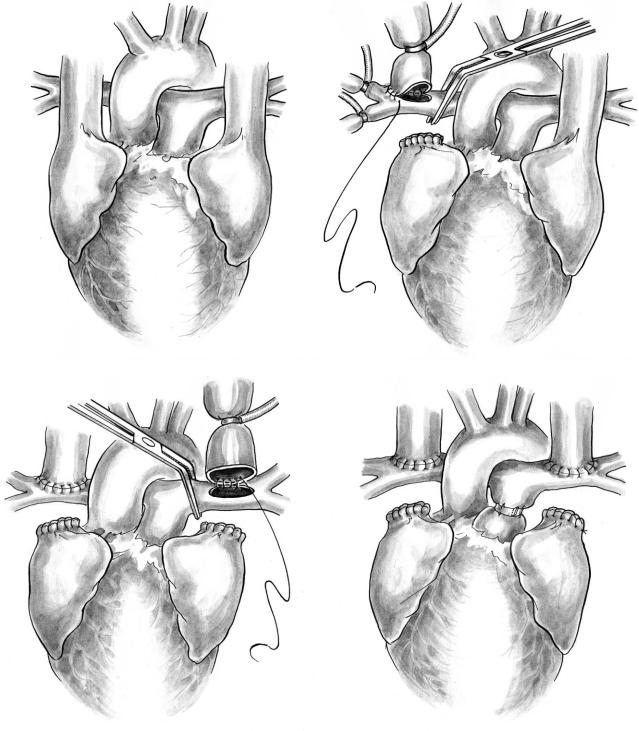
Рис. 8. Двусторонний ДКПА: а — билатеральные полые вены при правом предсердном изомеризме; б — правая легочная артерия изолирована турникетами и сосудистым зажимом для выполнения правого анастомоза; в — выполнение левого анастомоза (тесемки на ветвях легочной артерии не показаны); г — главный ствол легочной артерии сужен тесьмой для уменьшения антеградного кровотока под контролем давления в ветвях легочной артерии. Сердечный конец пересеченных полых вен ушит горизонтальным матрацным и (после снятия зажима) обвивным 5/0 проленовым швом
системно легочный анастомоз. Если имеются СЛА |
с расширением ДМПП или другими внутрисер |
и адекватный легочный кровоток, двусторонний ка |
дечными вмешательствами, операцию выполняют |
вопульмональный анастомоз может быть первым |
в условиях умеренной гипотермии и кардиопле |
вмешательством, которое выполняют в условиях |
гии. Первый этап выполняют при сокращающем |
искусственного кровообращения (рис. 8). |
ся сердце, а внутрисердечный — в условиях кар |
В ситуациях, когда ДКПА необходимо сочетать |
диоплегии. |
Глава 63. ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ ПОРОКОВ СЕРДЦА С ФУНКЦИОНАЛЬНО ЕДИНСТВЕННЫМ ЖЕЛУДОЧКОМ |
1009 |
|
|
|
|
а |
|
|
|
б |
|
|
|
|
г
в
д
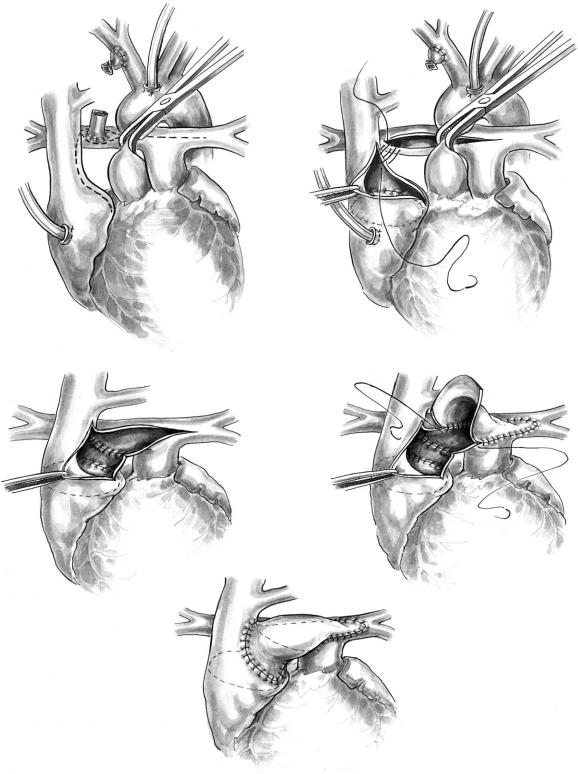
Рис. 9. Схема операции hemi Fontan I
Альтернативным методом создания кавопуль монального соединения является операция, полу чившая название hemi Fontan (рис. 9). При этой модификации ВПВ не пересекают и отделяют от правого предсердия заплатой из листового тетраф люороэтилена. У младенцев применяют два вари анта этой операции: hemi Fontan I и hemi Fontan II.
Операция hemi Fontan I
Бифуркацию легочной артерии максимально выделяют из окружающих тканей и завершают мо билизацию после начала искусственного кровооб ращения. Системно легочный анастомоз перевя зывают и пересекают. Пациента охлаждают до
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
1010 |
Часть 12. КОМПЛЕКСНЫЕ ВРОЖДЕННЫЕ ПОРОКИ СЕРДЦА |
|
|
|
|
18°С, пережимают аорту, вводят кардиоплегичес кий раствор и останавливают кровообращение. Венозную канюлю удаляют из правого предсер дия. Верхнюю полую вену открывают в месте ее соединения с правым предсердием (см. рис. 9, а). Разрез спиралевидно продолжают кверху вдоль медиального края ВПВ и заканчивают в задней стенке, прилежащей к легочной артерии. Книзу разрез проводят по направлению к артерии сину сового узла. Иногда удается избежать ее пересече ния. Легочную артерию открывают по передней поверхности от задней стенки ВПВ до места разве твления левой ветви легочной артерии (см. рис. 9, а). Через разрез ВПВ и ушка в правое предсердие вшивают соответствующего размера заплату из Gore Tex 5/0 проленом (см. рис. 9, б). Заплата от деляет правое предсердие от кавопульмонального анастомоза. Ее удаляют во время последующей операции Fontan. Задний край разреза кавопред сердного соединения сшивают с нижним краем разреза легочной артерии непрерывным 6/0 про леновым швом (см. рис. 9, б). Образовавшееся от верстие (см. рис. 9, в) закрывают треугольным лос кутом легочного гомотрансплантата или телячьего перикарда, обработанного с помощью декальци нирующей технологии. С крайней левой точки разреза начинают 6/0 проленовый шов и заверша ют его в области кавопредсердного соединения (см. рис. 9, г, д). Далее реканюлируют правое пред сердие и после удаления воздуха из сердца возоб новляют искусственное кровообращение и начи нают согревание.
Операция hemi Fontan II
В отличие от описанной выше техники, легоч ную артерию открывают от корня до корня, а рез рез ВПВ по медиальному краю выполняют от ос нования безымянной вены через кавоатриальное соединение на ушко правого предсердия (рис. 10, а). Задний край разреза ВПВ—правое предсердие сшивают с нижним краем легочной артериотомии 6/0 проленовым непрерывным швом (рис. 10, б). Этот маневр обеспечивает широкое сообщение между ВПВ и легочной артерией. Выкраивают большую треугольную заплату из стенки гомоле гочной артерии или телячьего перикарда для рас ширения бифуркации. Начиная с левого угла раз реза заплату пришивают к краям артериотомии, передней стенке ВПВ и ушка правого предсердия (рис. 10, в, г). Передний край анастомоза выпол няют 5/0 проленовым швом. Данная методика создает наиболее широкое соустье ВПВ с легочной артерией.
При достаточно широкой легочной артерии у детей старшего возраста применяют старый вари ант операции hemi Fontan. Она предусматривает анастомозирование с правой легочной артерией не только головного, но и сердечного конца ВПВ. Последний подшивают к нижнему краю правой легочной артерии. Устье ВПВ со стороны предсер дия закрывают заплатой из Gore Тex (рис. 11, а). После операции hemi Fontan упрощается выпол нение полной коррекции гемодинамики. Исчезает вероятность повреждения синусового узла во вре мя наложения анастомоза между культей ВПВ и легочной артерией в условиях спаечного процесса, а также укорачивается продолжительность пов торного вмешательства. Во время завершающей операции тотального кавопульмонального соеди нения остается удалить заплату и сформировать туннель внутри предсердия.
При наличии локального сужения правой ле гочной артерии в месте ранее наложенного сис темно легочного анастомоза некоторые хирурги применяют модификацию операции hemi Fontan, предусматривающую разделение правой легочной артерии, и анастомозирование ее дистального конца с латеральной стенкой ВПВ, а проксималь ного — с медиальной (рис. 11, б).
Двунаправленный кавопульмональный анасто моз можно выполнять без применения искус ственного кровообращения. В этих случаях ис пользуют временное шунтирование крови из ВПВ в правое предсердие с помощью двух венозных ка нюль, соединенных между собой Y образным коннектором. Операцию осуществляют в услови ях гепаринизации больного.
Непосредственные и отдаленные результаты ДКПА
Результаты операций по формированию раз личных модификаций кавопульмонального анас томоза зависят от многих факторов, в частности, от возраста, в котором было предпринято вмеша тельство, анатомической формы порока, опера тивной техники и т.д. Кавопульмональный анас томоз должен быть выполнен идеально, без воз никновения «эффекта кисета» и градиента давле ния (рис. 12).
В клиниках, где применяли операцию по фор мированию классического анастомоза между ВПВ и правой легочной артерией (60–62), госпиталь ная летальность составляла 1–6%. По данным ав торов из детского госпиталя в г. Торонто, 5 летняя выживаемость больных с классическим кавопуль мональным анастомозом составила 84,9%, а
Глава 63. ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ ПОРОКОВ СЕРДЦА С ФУНКЦИОНАЛЬНО ЕДИНСТВЕННЫМ ЖЕЛУДОЧКОМ |
1011 |
|
|
|
|
а |
|
|
|
б |
|
|
|
|
|
в |
|
|
г |
|
Рис. 10. Техника выполнения операции hemi Fontan II |
|
|
|
||
15 летняя — 61,7%. Адекватное функционирова |
отдаленном периоде после этого вмешательства |
||||
ние анастомоза со времени его формирования до |
является снижение легочного кровотока, что при |
||||
следующей паллиативной операции на протяже |
водит к усилению гипоксемии и полицитемии |
||||
нии 5 лет наблюдали у 61,1% больных, а на протя |
(63, 64). К важным факторам, ухудшающим легоч |
||||
жении 10 лет — у 31,8%. |
ный кровоток, следует отнести: |
||||
Основной причиной ухудшения состояния в |
• уменьшение соотношения притока венозной |
||||
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
