
4 курс / Общая токсикология (доп.) / Врожденные пороки сердца
.pdf
992 |
Часть 12. КОМПЛЕКСНЫЕ ВРОЖДЕННЫЕ ПОРОКИ СЕРДЦА |
|
|
|
|
Ао
ЛА
Ао ЛА
ПЖ
ПЖ
ЛЖ
ЛЖ
а |
б |
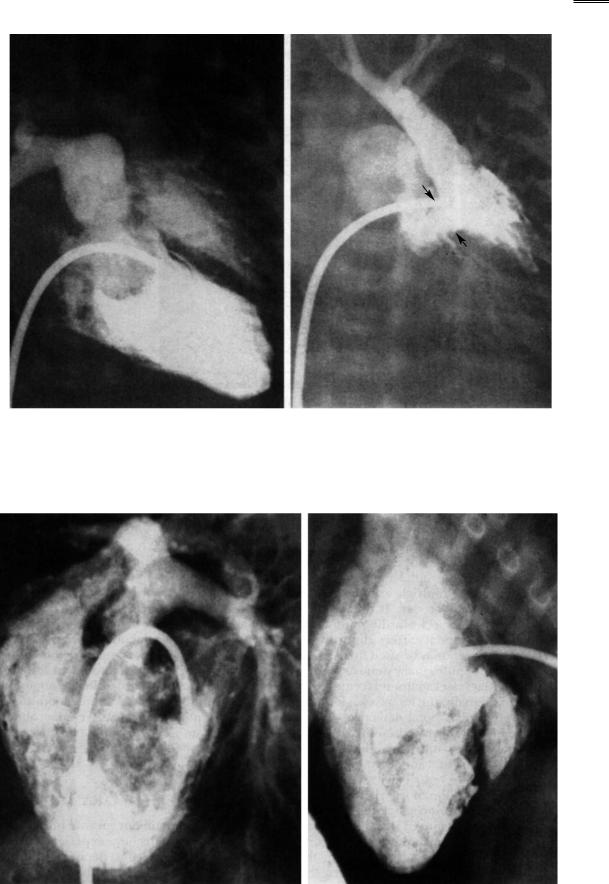
Рис. 13. Ангиокардиограмма больного с двуприточным левым желудочком, архитектурой «правой руки», ТМА и СЛА (прямая проекция) (а); желудочковая архитектура неотличима от классической АТК (б); (Ао — аорта; ПЖ — рудиментарный правый желудочек; ЛЖ — доминирующий левый желудочек, ЛА — легочная артерия)
гипоксемии определяет выраженность СЛА. В редких наблюдениях артериальная гипоксемия от сутствует.
Ангиокардиографическое исследование позво ляет определить:
•анатомическую структуру желудочка;
•наличие и положение выпускной камеры;
•расположение магистральных сосудов и харак тер желудочко артериального соединения;
•состояние и место открытия АV клапанов;
•наличие сопутствующих аномалий.
В связи с этим необходимо произвести:
•вентрикулографию;
•правую и левую атриографию;
•легочную артериографию в аксиальной проек ции легочного ствола.
Наибольшую ценность представляет селектив
ная ангиография желудочковой массы в двух про екциях.
Важное диагностическое значение имеет конт растирование рудиментарной камеры из полости ЕЖС (рис. 13, 14, 15). В прямой проекции у боль ных с нормальным расположением аорты и легоч ного ствола или корригированной ТМА рудимен тарная камера располагается на передней левой по верхности сердца бок о бок с желудочком (в первом случае от него отходит легочный ствол, во втором —
аорта). У больных с полной ТМА рудиментарная камера контрастируется на передней правой пове рхности сердца, тень его накладывается на полость желудочка, от которого отходит аорта.
Таким образом, ЕЖС характеризуется боль шим разнообразием анатомических форм, кото рые определяют варианты клинического течения. Естественное течение неблагоприятное у боль шинства пациентов, родившихся с этим пороком. Наиболее сложной категорией пациентов являют ся те, у которых ЕЖС сочетается с висцеральной гетеротаксией, аномальным дренированием сис темных и легочных вен, а также обструкцией вы хода в системный круг кровообращения.
Глава 62. ОДНОЖЕЛУДОЧКОВОЕ АТРИОВЕНТРИКУЛЯРНОЕ СОЕДИНЕНИЕ (ЕДИНСТВЕННЫЙ ЖЕЛУДОЧЕК СЕРДЦА) 993
Ао
ЛА
ПЖ
ПЖ
ДМЖП
ДМЖП
ЛЖ
а |
б |
Рис. 14. Ангиокардиограмма больного с двуприточным доминантным левым желудочком, архитектурой «левой руки», вентрикулоартериальной дискордантностью (прямая проекция). Контрастное вещество введено в желудочек. Выход в ле! гочную артерию свободный, маленький ДМЖП (а); контрастное вещество введено в рудиментарный правый желудочек (выпускную камеру) через ДМЖП. Видна типичная трабекулярность правого желудочка (б)
Ао
ЛА
ЛЖ
ПЖ
ПЖ
а |
б |
Рис. 15. Ангиокардиограмма больного с доминантным правым желудочком и архитектурой «правой руки». В переднезадней проекции анатомия желудочка выглядит неопределенной (а); в боковой проекции обнаруживается камера рудиментарного левого желудочка (б)
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
994 |
Часть 12. КОМПЛЕКСНЫЕ ВРОЖДЕННЫЕ ПОРОКИ СЕРДЦА |
|
|
|
|
Литература
1.Anderson R.H., Tynan M., Freedom R.M., et al. Ventricular morphology in univentricular heart // Herz. – 1979. – Vol. 4. – P. 184 – 197 .
2.Girod D.A., Lima R.C., Anderson R.H., et al. Double–inlet ventricle: Morphologic analysis and surdical implications in 32 cases // J. Thorac. Cardiovasc. Surg. – 1984. – Vol.88. – P. 590–600.
3.M.Lev, R.R.Liberthson, J.R.Kirpatrick et al. Single(primitive) ventricle // Circulation. – 1969. – Vol.29. – P. 577 – 591.
4.Shinebourne E.A., Macartny F.J., Anderson R.H. Sequential chamber lo–calization. Logical approach to diagnosis in congenital heart disease // Br. Heart. J. – 1976. – Vol.38. – P.327–340.
5.Tynan M.J., Becker A.E., Macartney F.J., et al. Nomenclature and classi fication of congenital heart disease // Br. Heart J. – 1979. – Vol. 41. – P. 544–553.
6.Van Praagh R., Plett J.A., Van Praagh S.. Pathology, embryology, termi nology, and classification // Herz. – 1979. – Vol.4. – P. 1131–1150.
7.Kirklin J.K., Barrat–Boyes B.G. Tricuspid atresia and the Fontan opera tion // In. Cardiac Surgery. – Churchil Livingston.– New York, Edinburgh, London, Melbourne, Tokyo. – 1993. – P. 1055–1104.
8.Бураковский В.И., Бухарин В.А., Подзолков В.П. и др. Врожденные пороки сердца // Сердечно сосудистая хирургия. /Под ред. В.И.Бу раковского, Л.А.Бокерия. – М.: Медицина, 1989. – С.45–380.
9.Anderson R.H., Becker A.E.,Tynan M. and Wilkinson J.L. Definitions and terminology – The significance of sequential segmental analysis // Double Inlet Ventricle. Edited by R.H.Anderson, G.Grupi and L.Parenzan. – Tunbridge Wells, Kent: Castle House Publications, 1987.
– P. 624–632.
10.Castaneda A.R., Jonas R.A., Mayer J.E., Hanley. Single–Ventricle Tricuspid Atresia // In: – Cardiac surgery of the neonate and infant . – W.B. Saunders Company. – Philadelphia. – 1994. – P. 249–272.
11.Anderson R.H., Becker A.E. Cardiac anatomy. – London: Gower Medicar Publishing, 1980. – 424 p.
12.Esmailian F., Permut L.C., Gates R.N., Laks H. Single ventricle with double–inlet atrioventricular connection // In Cardiac surgery. Edited by Mavroudis C., Backer C.L. – Mosby Year Book, Inc. – London, Philadelphia, Sydney, Toronto. 1994. – P. 401–412.
13.Franklinn R.C.G., Spiegelhalter D.J., Anderson R. H. et al. Double–inlet ventricle presenting in infancy // J.Thorac. Cardiovasc .Surg. – 1991. – Vol.101. – P .767–776
14.Kidd B.S.L. Single ventricle. In Heart Disease in Infancy and Childhood.
– New York, Macmillan Publishing Co. – 1978. – P. 405–417.
15.Kirklin J.K., Barrat Boyes B.G. Double inlet Ventricle and Atretic Atrioventricular Valve // In. Cardiac Surgery. – Churchil Livingston.– New York, Edinburgh, London, Melbourne, Tokyo. – 1993. – P. 1549–1581.
16.Van Praagh R., Ongley P.A., Swan H.J.C. Anatomic Types of single or common ventricle in man // Am. J. Cardiol. – 1964. – Vol.13. – P. 367–385.
17.R.Van Praagh, I.David, S.Van Praagh. What is a ventricle? The single ventricle trap // Pediatr.Cardiol. – 1982. – Vol.2. – P. 79–87.
18.Anderson R.H., Macartney F.J.,Tynan M., et al. Univentricular Atrioventricular Connection: Single ventricle trap unsprung // Pediatr. Cardiol. – 1983. – Vol.4. – P. 273–282.
19.Anderson R.H., Penkoske P.A. Variable morphology of ventricular sep tal defect in double inlet left ventricle // Am. J.Cardiol. – 1985. – Vol.55. – P.1560–1569.
20.Matitiau A., Geva T., Colan S.D., et al. Bulboventricular foramen size in infants with double inlet left ventricle or tricuspid atresia with trans posed great arteries: Influence on initial palliative operation and rate of growth // J. Amer. Coll. Cardiol. – 1992. – Vol.19. – P.142 –148.
21.Odim J.N.K., Laks H., Drinkwater et al. Staged surgical approach to neonates with aortic obstruction and single ventricle physiology // Ann
.Thorac. Surg. – 1999. – Vol.68. – P.962–967.
22.Serrat A., Conte S., Lacour Gayet F. et al. Systemic obstruction in uni ventricular hearts: surgical options for neonates // Ann. Thorac. Surg.
–1995. – Vol.60. – P.970 – 977.
23.Webber S.A., LeBlanc., Keeton B.R. Pulmonary artery banding is not contraindicated in double inlet ventricle with transposition and aortic arch obstruction // Eur. J. Cardiothorac. Surg. – 1995 – Vol.9. – P.515
–520.
24.Becker A.E., Wilkinson J.L., Anderson R.H. Atrioventricular conduction tissues: A guide in understanding the morphogenesis of the univentric ular heart // Van Praagh R., Takao A (eds): Etiology and Morphogenesis of Congenital Heart Disease. – New York: Futura Publishing, 1980. – P.489–514.
25.Keeton B.R., Lie J.T., McGoon D.C., et al. Anatomy of coronary arter ies un univentricular hearts and its surgical implications // Am. J. Cardiol. – 1979. – Vol.43. – P.569–580.
26.Gibson D.G., Traill T.A., Brown D.J. Abnormal ventricular function in patients with univentricular heart // Herz. – 1979. – Vol.4. – P. 226–233.
Публикации авторов
1.Зиньковский М.Ф., Довгань А.М., Перепека О.М. и др. Специфичес кие задачи диагностики единственного желудочка сердца // Укр. кардіолог. журн. – 1998.– N5.– C. 42.
26. Довгань А.М. Основные анатомические варианты единственного желудочка сердца и особенности их клинического течения // Лікарська справа. – 1997. – N 4. – С. 49–53.
Глава 63
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
ПОРОКОВ СЕРДЦА С ФУНКЦИОНАЛЬНО
ЕДИНСТВЕННЫМ ЖЕЛУДОЧКОМ
Хирургическое лечение аномалий сердца с функционально единственным желудочком нача лось со времени появления паллиативных вмеша тельств. При пороках с сопутствующим СЛА при менялись различные типы системно легочных анастомозов (1, 2), а у больных с избыточным ле гочным кровотоком — операция суживания легоч ного ствола (3).
В связи с особенностями анатомического стро ения этих аномалий в редких случаях возможно воссоздать нормальную структуру с полноценной функцией обоих желудочков, поэтому поиски ме тодов лечения были направлены по пути коррек ции гемодинамических нарушений.
Первые экспериментальные исследования по созданию такой модели кровообращения были проведены итальянскими хирургами во главе с Carlon (4). Они выполняли собакам прямой анас томоз «конец в конец» между проксимальным кон цом пересеченной непарной вены и дистальным концом правой легочной артерии с перевязкой ВПВ в месте впадения ее в правое предсердие. В последующем проводились независимые подоб ные эксперименты венгерскими, российскими и американскими учеными (5, 6).
Ранние эксперименты по отведению венозной крови из обеих полых вен прямо в легочные арте рии, проводимые Warden и соавторами (7), сопро вождались неудачами. Собаки, которым выполня ли прямой анастомоз между ушком правого пред сердия и легочным стволом, погибали от послед ствий венозной гипертонии и застоя крови в селе зенке. Для того чтобы кровь не поступала в правый желудочек, также зашивали трехстворчатый кла пан. Животные стали выживать после того, как эксперимент начали выполнять в два этапа. На первом этапе им производили искусственное су жение правого AV отверстия, а через некоторое время осуществляли полное отведение венозной крови в легкие, минуя правый желудочек.
Позже Haller и соавторы (8) в эксперименте накладывали на первом этапе анастомоз между
ВПВ и правой легочной артерией по типу «конец в бок», а во время второго вмешательства выполня ли значительное сужение или полное закрытие правого AV отверстия. Все животные, перенесшие этот эксперимент, выжили. В последующем у них отсутствовала отечность и они находились в хоро шем состоянии.
Первые попытки клинического применения полного отведения венозной крови в легочную ар терию в обход правого желудочка были неудачны ми (9, 10).
В1956–58 гг. Мешалкину (11) и независимо от него Glenn (12) удалось успешно выполнить опера цию по созданию прямого анастомоза между ВПВ и правой легочной артерией. Эта методика заключа лась в создании соустья между боковой стенкой ВПВ и дистальным концом рассеченной правой ле гочной артерии. Полую вену перевязывали у места соединения ее с правым предсердием, а прокси мальный конец правой легочной артерии ушивали непрерывным швом (рис. 1). В результате этого вме шательства венозная кровь из верхней половины ту ловища попадала прямо в правое легкое, а из бас сейна НПВ и коронарного синуса (приблизительно 70% всего минутного объема крови) поступала есте ственным путем в левую легочную артерию.
Впоследующем появилась новая модификация кавопульмонального анастомоза, характеризую щаяся двунаправленным распределением крови из ВПВ (13–15).
Первая успешная операция полной коррекции гемодинамики в обход правого желудочка была выполнена у больной с АТК в 1968 г. французским хирургом Fontan (16). Она включала в себя анасто моз между ВПВ и дистальным отрезком правой ле гочной артерии по типу «конец в конец», а также анастомоз между ушком правого предсердия и проксимальным концом одноименной легочной артерии. В предсердно легочном соустье и в устье НПВ размещали клапаны из аортального гомотра нсплантата, закрывали ДМПП и перевязывали ле гочный ствол (рис. 2).
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

996 |
Часть 12. КОМПЛЕКСНЫЕ ВРОЖДЕННЫЕ ПОРОКИ СЕРДЦА |
|
|
|
|
ВПВ
ВПВ
ПЛА
ПЛА
ПП |
|
ПП |
а б
Рис. 1. Схемы выполнения операций классического анастомоза Glenn (а) и его модификации в виде двунаправленного каво пульмонального анастомоза (б) (ВПВ — верхняя полая вена; ПЛА — правая легочная артерия; ПП — правое предсердие)
|
|
|
ЭВОЛЮЦИЯ ОПЕРАЦИЙ, |
|
|
|
|
ОСНОВАННЫХ НА ПРИНЦИПЕ FONTAN |
|
|
|
|
Операции Fontan применяются при многих |
|
|
|
|
сложных ВПС, когда анатомическая коррекция |
|
|
|
|
невозможна. Для определенных групп больных |
|
|
|
|
она является операцией выбора. Создание особой |
|
|
|
|
схемы кровообращения, прототипа которой нет |
|
ПЛА |
||||
|
|
|
ни в норме, ни в патологии, является одним из вы |
|
|
|
|
дающихся достижений современно педиатричес |
|
ПЛС |
|
кой кардиохирургии. Оригинальная операция |
||
|
|
|
Fontan предусматривала использование сократи |
|
|
|
|
тельного потенциала гипертрофированного при |
|
|
|
|
АТК правого предсердия в качестве насосной ка |
|
|
|
|
меры. В то время считалось, что пульсирующий |
|
|
|
|
ток крови, создаваемый систолой правого пред |
|
|
|
|
сердия, обеспечивает легочный кровоток. Позднее |
|
|
|
|
стало очевидно, что впускной и выпускной клапа |
|
|
|
|
ны приносили больше вреда, чем пользы. |
|
|
|
|
В 1973 г. Kreutzer и соавторы (17) сообщили о |
|
|
|
|
модификации операции Fontan, которая заключа |
|
|
|
|
лась в прямом анастомозировании отсеченного |
|
Клапан в устье НПВ |
легочного ствола, содержащего клапан, с ушком |
|||
Рис. 2. Схема первоначальной операции Fontan (ПЛА — |
правого предсердия. Верхнюю полую вену остав |
|||
ляли интактной и не имплантировали клапан в |
||||
правая легочная артерия; ПЛС — предсердно легочное со |
||||
единение с клапаном) |
устье НПВ (рис. 3). Если прямой анастомоз не уда |
|||

Глава 63. ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ ПОРОКОВ СЕРДЦА С ФУНКЦИОНАЛЬНО ЕДИНСТВЕННЫМ ЖЕЛУДОЧКОМ |
997 |
|
|
|
|
а |
б |
Рис. 3. Схема выполнения прямого анастомоза между правым предсердием и легочным стволом по Kreutzer: а — закрыт ДМПП и отсечен легочный ствол с клапаном; б — окончательный вид операции
вался, применяли гомографт. Межпредсердный дефект закрывали.
Основное преимущество модификации Kreutzer по сравнению с первоначальной опера цией Fontan состоит в том, что легочное артери альное дерево остается неразобщенным и таким образом поток крови распределяется нормально. После оригинальной операции Fontan в правое легкое (сосудистое ложе которого составляет 60% общего количества сосудов, кровоснабжающих оба легких) поступало только 40% венозной кро ви, а в левое — наоборот.
В 1978 г. Bowman и соавторами (18) была пред ложена идея вовлечения в цикл легочного крово обращения рудиментарного правого желудочка. Для сообщения правого предсердия и правого же лудочка они использовали клапанный кондуит (рис. 4). Авторы отметили, что в результате этого вмешательства в дальнейшем наблюдалось значи тельное увеличение полости правого желудочка.
Для исключения обструкции кондуита в отда ленном периоде Bjork и соавторы (19) внедрили свою модификацию гемодинамической коррек ции АТК. Она предусматривает создание прямого анастомоза между правым предсердием и правым желудочком.
Последующей модификацией операции Fontan стало соединение правого предсердия с легочным стволом или правой легочной артерией путем пря мого анастомозирования или с использованием заплат или кондуитов с клапаном или без него. Прямое соединение правого предсердия с правой легочной артерией без клапана (рис. 5) дало срав нимый гемодинамический эффект. Включение в кровоток правого желудочка дополнительных преимуществ не давало.
Коррекцию гемодинамики по Fontan разраба тывали для лечения АТК. Со временем возникла идея применения этого метода у больных с ЕЖС и при других врожденных аномалиях сердца, когда невозможно создать нормальное двухжелудочко вое кровообращение (20, 21).
Для лечения ЕЖС, сочетающегося с атрезией или стенозом левого АV клапана, а также с ано мальным дренажем легочных вен, были внедрены новые модификации операции Fontan с внутри предсердным разделением (22–24). Наибольшей эффективностью обладала методика полного ка вопульмонального соединения (25). Для больных с нормальным дренажем НПВ было предложено формирование туннеля внутри правого предсер дия между устьями нижней и верхней полых вен и
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

998 |
Часть 12. КОМПЛЕКСНЫЕ ВРОЖДЕННЫЕ ПОРОКИ СЕРДЦА |
|
|
|
|
а |
б |
|
Рис. 4. Схема выполнения соединения между правым предсердием и правым желудочком с использованием клапанного кондуита: а — закрыт заплатой ДМЖП; б — имплантирован клапанный кондуит
а
б
в
Рис. 5. Схема выполнения прямого соединения правого предсердия и легочной артерии: а — линии разрезов; б — исполь зование стенки правого предсердия для создания канала между предсердием и правой легочной артерией; в — лоскут ау топерикарда образует переднюю стенку канала
Глава 63. ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ ПОРОКОВ СЕРДЦА С ФУНКЦИОНАЛЬНО ЕДИНСТВЕННЫМ ЖЕЛУДОЧКОМ |
999 |
||
|
|
|
|
|
|
|
|
соединение этого канала с правой легочной арте |
Отведение части венозной крови в системный |
||
рией через проксимальный конец пересеченной |
кровоток способствует снижению ранней леталь |
||
ВПВ. Этот метод обладает рядом преимуществ: |
ности, интенсивности и длительности плевраль |
||
меньшим риском повреждения AV узла, сниже |
ной экссудации, сокращению пребывания боль |
||
нием вероятности тромбоза предсердия, гемоди |
ных в стационаре. Недостатками фенестрации яв |
||
намическими преимуществами. Как показали de |
ляются: возможность развития парадоксальной |
||
Leval и соавторы (25), наличие растяжимого пра |
эмболии и инсульта, снижение насыщения арте |
||
вого предсердия между системной веной и легоч |
риальной крови кислородом и необходимость зак |
||
ной артерией приводит к турбулентности, демп |
рытия отверстия, если не произошла его спонтан |
||
фированию потока крови и вследствие этого — к |
ная облитерация. |
|
|
потере энергии. В противоположность этому, от |
В последние годы стала популярной операция |
||
носительно нерастяжимый туннель, примерно |
внесердечного обхода правых отделов сердца с по |
||
равный диаметру НПВ, не имеет этого недостатка. |
мощью сосудистого протеза между НПВ и правой |
||
Поскольку внутрипредсердный туннель на две |
легочной артерией в совокупности с анастомозом |
||
трети его окружности сформирован из синтети |
по Glenn. Ожидается, что эта операция снизит час |
||
ческого материала или перикарда, высокое веноз |
тоту поздних предсердных аритмий. |
|
|
ное давление воздействует лишь на узкую полоску |
У пациентов с ЕЖС очень заманчивым являет |
||
стенки правого предсердия. Это способствует |
ся создание кровообращения с участием двух же |
||
уменьшению частоты возникновения ранних и |
лудочков. С этой целью была внедрена операция |
||
поздних предсердных аритмий. |
по формированию межжелудочковой перегород |
||
Совершенствование вмешательств, основанных |
ки. Первая успешная септация была выполнена в |
||
на принципе Fontan, в течение 30 лет было направ |
1956 г. Kirklin (26). До операции больному устано |
||
лено на решение двух основных задач — улучше |
вили диагноз ДМЖП, а во время операции было |
||
ние гемодинамической эффективности и сниже |
обнаружено отсутствие перегородки. В 1977 г. |
||
ние риска. В частности, для больных высокого рис |
McGoon и соавторы (27) широко применяли этот |
||
ка было предложено двухэтапное лечение. В каче |
метод лечения. Однако опыт показал, что резуль |
||
стве первого вмешательства выполнялся двунап |
таты операций по формированию межжелудочко |
||
равленный кавопульмональный анастомоз Glenn |
вой перегородки очень плохие. Это связано с вы |
||
(«конец в бок» ВПВ с правой легочной артерией). |
сокой послеоперационной летальностью и боль |
||
В последующем полная коррекция завершалась |
шим количеством осложнений, включающих в се |
||
путем соединения НПВ с той же легочной артери |
бя полную АV блокаду, решунтирование ДМЖП, |
||
ей с помошью внутрипредсердного туннеля. Уже |
недостаточность АV клапанов. В отдаленном пос |
||
после первого вмешательства существенное улуч |
леоперационном периоде появляется большая ве |
||
шение состояния больных во многих случаях ста |
роятность внезапной смерти, поэтому в настоящее |
||
вило вопрос о целесообразности второго этапа. |
время для лечения пациентов с ЕЖС предпочте |
||
Аргументами скептически настроенных карди |
ние отдается модификациям операции Fontan. |
|
|
ологов являются приведенные ниже осложнения |
В нашей стране классический анастомоз между |
||
полной коррекции. Несмотря на паллиативный |
ВПВ и правой легочной артерией впервые был вы |
||
характер операции Glenn, она имеет преимущест |
полнен в 1989 г. М.Ф.Зиньковским. Им же в 1991 г., |
||
ва перед другими вмешательствами этого рода |
впервые в Украине, были успешно выполнены дву |
||
(системно легочными анастомозами, например, |
направленный кавопульмональный анастомоз |
||
по Blalock–Taussig), заключающиеся в том, что |
(ДКПА) и полная гемодинамическая коррекция по |
||
ВПВ несет венозную кровь, а межартериальный |
Fontan (28). Первая операция полной коррекции ге |
||
анастомоз — смешанную, что приводит к объем |
модинамики в Национальном институте сердечно |
||
ной перегрузке желудочка и вторичной кардио |
сосудистой хирургии им. Н.М. Амосова АМН Укра |
||
миопатии. |
ины была выполнена 24 летней больной с двупри |
||
Улучшить послеоперационное течение полной |
точным левым желудочком, ТМА и СЛА. Ей создали |
||
коррекции гемодинамики позволяет фенестрация |
прямое соединение между правым предсердием и |
||
внутрипредсердного туннеля даметром около 4 |
легочным стволом, а также ушили правый AV кла |
||
мм. Сброс части венозной крови в левое предсер |
пан, а венозный канал отделили от части правого |
||
дие позволяет поддерживать достаточный сердеч |
предсердия, прилегающей к трехстворчатому клапа |
||
ный выброс в условиях повышенного сопротивле |
ну, заплатой из аутоперикарда. В настоящее время |
||
ния легочных сосудов в раннем послеоперацион |
эта больная находится в хорошем клиническом сос |
||
ном периоде. |
тоянии, трудоспособна, работает инженером. |
|
|
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
1000 |
Часть 12. КОМПЛЕКСНЫЕ ВРОЖДЕННЫЕ ПОРОКИ СЕРДЦА |
|
|
|
|
ХИРУРГИЧЕСКАЯ ТАКТИКА
Основным признаком, объединяющим анома лии сердца с функционально единственным желу дочком, является наличие только одной функцио нально значимой желудочковой камеры. Этот признак лежит в основе единого подхода к хирур гическому лечению данной патологии. Он заклю чается в коррекции гемодинамики по Fontan. Для получения стабильных положительных результа тов операцию Fontan следует выполнять пациен там с благоприятными анатомо физиологически ми показателями (29–35).
При многих формах одножелудочкового сердца уже с самого рождения ребенка возникает необхо димость в предотвращении развития факторов риска к выполнению гемодинамической коррек ции порока. Основной задачей хирургической стратегии при патологии сердца с функционально единственным желудочком является поддержание такого физиологического состояния больного, при котором без осложнений можно выполнить опера цию Fontan в 4–6 летнем возрасте. Для этого необ ходимо ограничить вредное воздействие хроничес кой объемной перегрузки желудочка и гипоксии. Поскольку эти вредно влияющие факторы могут возникать сразу же после рождения ребенка и усу губляться во время его развития, тактика лечения должна соответствовать возрастным периодам.
Хирургическое лечение в неонатальном периоде
Большинству детей, родившихся с этой патоло гией, требуется неотложная помощь уже в периоде новорожденности. Она включает как медикамен тозные, так и хирургические методы лечения. Ос
новная задача в оказании помощи при пороках серд ца с функционально единственным желудочком на дооперационном этапе заключается в создании ба ланса между общелегочным и общепериферическим сосудистыми сопротивлениями. При этом величина минутного объема сердца должна находиться в таких пределах, при которых осуществляется достаточное оксигенирование артериальной крови (PaO2 > 30 мм рт. ст.). У пациентов с признаками уменьшенного легочного кровотока из за резкого стеноза или ат резии легочной артерии необходимым условием поддержания кровообращения является сохране ние функции ОАП. Это же касается новорожден ных с дуктусзависимым системным кровообраще нием, т.е. пациентов с обструкцией выхода в сис темный круг кровообращения. Достигается это путем непрерывного введения ПГЕ1 в дозе 0,01–0,1 мкг/кг/мин.
На протяжении подготовительного периода к оперативному вмешательству медикаментозное лечение должно быть направлено на поддержание кислотно щелочного равновесия и функции жиз ненно важных органов пациента.
В ургентном порядке оперативное вмешатель ство выполняют лишь в случаях, когда имеет мес то обструкция выхода из легочных вен.
Показания к хирургическому лечению
Кроме пациентов с обструкцией легочных вен, когда оперативное лечение является неизбежным сразу после рождения ребенка, показания к хирур гическому лечению в периоде новорожденности определяются вариантом клинического течения порока, т.е. в зависимости от того, каким является легочный кровоток — недостаточным или избы точным, а также наличием или отсутствием пре пятствий выходу крови в большой круг кровообра щения.
Новорожденным с выраженными признаками гипоксемии, которая возникает из за резкого сте ноза или атрезии легочной артерии, показано на ложение системно легочного анастомоза. При из быточном легочном кровотоке показано сужива ние легочного ствола. В случаях, когда наблюдает ся обструкция выхода в системный круг кровооб ращения, необходимо устранить сужение на внут рисердечном уровне или на уровне магистральных артерий. Хирургические вмешательства обычно выполняют в течение первых недель жизни.
Хирургическое лечение больных с недостаточным легочным кровотоком
Для обеспечения адекватного легочного крово тока применяют системно легочный анастомоз. Основной задачей этого вмешательства является создание адекватного, но не избыточного легоч ного кровотока при условии исключения дефор маций легочных артерий. Наиболее подходящим является модифицированный подключично ле гочный анастомоз по Blalock–Taussig с примене нием сосудистого протеза из политетрафлюороэ тилена диаметром 3,5–4 мм. Он может быть вы полнен как через боковую торакотомию, так и че рез срединный доступ.
Техника наложения модифицированного анас томоза по Blalock–Taussig через боковую торако томию относительно проста. При выборе стороны торакотомии используют общее правило. Пред почтение отдают стороне, на которой расположе на ВПВ. Однако если легочный кровоток у ребен
Глава 63. ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ ПОРОКОВ СЕРДЦА С ФУНКЦИОНАЛЬНО ЕДИНСТВЕННЫМ ЖЕЛУДОЧКОМ |
1001 |
|
|
|
|
ка зависит от функции ОАП, то при выборе сторо ны торакотомии следует учитывать расположение ОАП. Проток не может быть закрыт до тех пор, по ка не будет наложен анастомоз. Проток мешает наложить анастомоз более проксимально для удобства его устранения во время последующих хирургических вмешательств, поэтому подклю чично легочное соустье лучше накладывать на стороне, противоположной расположению ОАП.
Некоторые хирурги предпочитают накладывать подключично легочный анастомоз со срединного доступа (36). Формирование шунта через этот дос туп позволяет легко подключить искусственное кровообращение, если возникает такая необходи мость, а также исключает образование коллате рального кровообращения, которое развивается в результате спаечного процесса в плевральной по лости. Образование коллатеральных сосудов ухуд шает кровообращение Fontan. В случаях недораз вития легочныых артериий более эффективен центральный аортолегочный анастомоз. Он обес печивает равномерный двусторонний поток крови в легочные артерии, что способствует увеличению их размеров.
Хирургическое лечение пациентов с избыточным легочным кровотоком без обструкции выхода в системный круг кровообращения
Избыточный легочный кровоток приводит к повышению давления в легочной артерии и объ емной перегрузке системного желудочка. В ре зультате возникает застойная сердечная недоста точность и развивается обструктивная болезнь ле гочных артерий.
В целях уменьшения кровотока по легочным артериям производят суживание легочного ствола. Это вмешательство можно выполнять из левосто ронней торакотомии и со срединного доступа. Из этого доступа удобнее суживать легочный ствол при ТМА.
Самым ответственным моментом операции яв ляется выбор целевого диаметра легочного ствола. Для пациентов с одножелудочковым сердцем дли на суживающей тесьмы (в мм) представляет собой сумму чисел: 24 и числа, соответствующего массе тела ребенка. Например, если масса больного 4 кг, то длина тесьмы должна составлять 28 мм. Эта длина обычно является начальной. Дополнитель ное суживание производят под контролем давле ния в легочной артерии дистальнее тесьмы. После суживания давление в легочной артерии должно составлять 1/3 системного, а артериальное насы
щение кислородом — не ниже 75%. Необходимо учитывать, что эти измерения производят во вре мя наркоза, искусственной вентиляции легких с открытой грудной клеткой.
Хирургическое лечение пациентов с избыточным легочным кровотоком и обструкцией выхода в системный круг кровообращения
Среди больных с избыточным легочным кро вотоком часто встречаются случаи препятствия на пути выхода крови в системный круг кровообра щения, поэтому помимо уменьшения поступле ния крови в легочные артерии необходимо обеспе чить свободный путь крови в системный круг. Причиной обструкции выводного тракта желудоч ка могут быть подклапанное или клапанное суже ние устья аорты, а также гипоплазия восходящей аорты и дуги.
Наиболее частой причиной подклапанного су жения является малый диаметр бульбовентрику лярного отверстия, через которое кровь из желу дочка поступает в выпускную камеру и аорту.
Существуют два способа оперативного лечения этого варианта порока. Первый из них заключает ся в том, что из желудочка формируют дополни тельный выход в системный круг кровообращения через легочный ствол. Для этого последний рассе кают поперек и его проксимальный конец подши вают к восходящей аорте. Отверстие дистального конца легочного ствола ушивают, а легочный кро воток обеспечивают за счет системно легочного анастомоза (операция Damus–Kaye–Stansel).
Второй подход заключается в иссечении суб аортального сужения (обычно расширяют бульбо вентрикулярное отверстие) с одновременным су живанием легочного ствола.
В ряде случаев наблюдаются явные признаки сужения выхода крови в системный круг кровооб ращения, в других случаях четкие физиологичес кие данные, подтверждающие наличие сужения, отсутствуют. При эхокардиографическом иссле довании можно обнаружить сужение субаорталь ного пространства относительно диаметра кла панного кольца.
Matitiau и соавторы (37) изучили динамику из менения размеров бульбовентрикулярного отве рстия в процессе развития ребенка. Они установи ли, что при увеличении поверхности тела ребенка индекс поперечного сечения бульбовентрикуляр ного отверстия прогрессивно уменьшается. В тех случаях, когда индекс поперечного сечения буль бовентрикулярного отверстия в неонатальном пе
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
