
3 курс / Патологическая физиология / Патофизиология_крови,_Фред_Дж_Шиффман
.pdfАутологичная трансплантация |
329 |
лантационной подготовки, полной метаболизации и выведения активных форм химиотерапевтических агентов трансплантаты КМ или КППК размораживают и реинфузируют внутривенно.
Последующий период до приживления аналогичен аллогенной трансплантации(раздел "Аллогеннаятрансплантация"). Как только приживление произошло, самочувствие пациентов быстро улучшается и через 6-12 недель они могут вернуться к активной жизни. В отличие от аллогенной трансплантации у реципиентов аутологичных трансплантатов отсутствуют такие поздние осложнения, как оБТПХ, вирусные или грибковые инфекции. Отсроченные токсические поражения, например катаракта, дисфункция щитовидной железы и бесплодие, могут быть следствием общего облучения тела. Недавние исследования показали, что почти у 10 % пациентов через несколько лет после трансплантации развивается вторичная миелодисплазия.
Применение и эффективность
Цели аутотрансплантации различны в зависимости от характера новообразованияиклинической ситуации. Приострых лейкозах инекоторых лимфомаху большинства пациентов наблюдалось исцеление или, по крайней мере, очень длительная ремиссия. При множественной миеломе после проведения аутотрансплантации не удается добиться излечения, но результаты рандомизированного исследования подтверждают, что эта процедура обеспечивает достоверно более длинные интервалы, свободные от проявлений заболевания, чем стандартная химиотерапия. При раке молочной железы у пациентов с IV стадией метастазирова-ния (широко распространенные висцеральные или костные метастазы) выздоровление после ТКМ маловероятно. Возможно, при раке молочной железы аутотрансплантация перспективна как метод интенсификации консолидирующей терапии у пациентов со II или III стадией болезни (метастазы в лимфатических узлах ± большая первичная опухоль).
Важно осознавать, что практически каждая прикладная программа аутотрансплантации противоречива. Пока выполнено мало рандомизированных контролируемых испытаний, в которых аутотрансплантация сравнивается со стандартной терапией. Сопоставление же с "традиционными" методами контроля чревато неверной трактовкой в связи с усовершенствованиями в поддерживающем лечении, произошедшими за это время, и различием подходов к выбору пациентов. Страховые компании используют очень противоречивые критерии, касающиеся покрытия расходов на эти дорогостоящие процедуры (50 000-150 000 долл. США), что обусловлено политическими или законодательными моментами. В следующие 5 лет, вероятно, удастся выяснить, оправдано ли огромное увеличение частоты аутотрансплантации в различных клинических ситуациях, после чего разработчики стратегии и экономисты оценят их экономическую обоснованность. Для этого по возможности все пациенты, подвергающиеся аутологичной трансплантации, должны быть зарегистрированы в специальных клинических исследованиях с надежным наблюдением и быстрым предоставлением результатов.
Клинический пример
Мужчина в возрасте 35 лет, страдающий хроническим миелолейкозом (ХМЛ),
направлен на аллогенную трансплантацию костного мозга. Его

330 |
, |
Глава 8. Трансплантация стволовых |
|
клеток |
|
|
|
|
|
|
|
младший брат определен как совместимый по всем шести HLA-антиге-нам. Дотрансплантационное тестирование выявило предшествующее ЦМВ-инфицирование и пациента, и донора.
Пациент помещен в отделение трансплантологии. Для профилактики бактериальной и грибковой инфекций назначены норфлоксацин и флукона-зол. Начато также внутривенное введение ацикловира для предупреждения реактивации ВПГ и ЦМВ. Высокие дозы циклофосфамида введены через катетер центральной вены в 8-7-й ДНИ до трансплантации. Затем проведено ООТ в дозе 1200 рад в ДНИ 6-1. В процессе кондиционирования пациент жалуется только на умеренную непостоянную тошноту и сонливость. Для предотвращения развития БТПХ назначены циклоспорин и меторексат.
ВДЕНЬ 0 у донора под общей анестезией заготавливают костный мозг. Днем позже часть донорского костного мозга вводят внутривенно через центральный венозный катетер реципиенту.
ВДЕНЬ4 послетрансплантации пациентжалуетсянадисфагию, диарею
итошноту. При физикальном обследовании выявлены покраснение и некоторая отечность слизистых полости рта; афты или изъязвления не обнаружены. В связи с развитием панцитопении требуется переливание облученных и обедненных лейкоцитами компонентов крови, чтобы поддержать количество тромбоцитов больше 10 000/мкл и уровень гемоглобина выше 80 г/л.
ВДЕНЬ 10 оральная температура 38,8 °С. При физикальном обследовании отмечены только выявленные ранее изменения в полости рта. В ДЕНЬ 14 обнаружен положительный баланс жидкости с увеличением массы тела на 2 кг в течение 2-х предшествующих суток. Данные физикального обследования: иктеричность склер, болезненность в правом верхнем квадранте живота и смещаемое притупление перкуторного звука, свидетельствующие об асците. Концентрация циклоспорина в крови — в терапевтическом диапазоне. Ограничено потребление жидкости, и назначен калийсберегающий диуретик альдактон. Повышенный вес и гипербили-рубинемия на прежних уровнях.
В ДЕНЬ 22 обнаружены значимые изменения в крови: увеличилось количестволейкоцитов(до500/мкл), преимущественнозасчетмоноцитови незрелых нейтрофилов. Следующие 6 дней характеризуются устойчивым увеличением в крови числа лейкоцитов и уменьшением потребности в трансфузиях. Одновременно отмечается значительное улучшение самочувствия пациента. Пики интермиттирующей лихорадки исчезают. Начинает разрешаться дисфагия, соответственно возрастает потребление пищи через рот. Диарея все еще присутствует, уменьшаясь, однако, по частоте и объему. ВДЕНЬ 28 абсолютное количество нейтрофилов в крови достигает 1000/мкл, и прием антибиотиков прекращают. Пациент выписан из больницы. Он продолжает принимать только циклоспорин для предотвращения развития БТПХ и триметоприм/сульфаметоксазол 3 раза в неделю для профилактики пневмоцистной пневмонии. Пациент находится под тщательным амбулаторным наблюдением. В ДЕНЬ 50 по результатам еженедельного скрининга отмечена реактивация ЦМВ (положительный ЦМВ-антиген). Пациент отрицает наличие лихорадки, ча-

Аутологичнаятрансплантация
33
1
стота дыхания не увеличена, нет диареи или дисфагии, количество клеток крови остается устойчивым. Рентгенограмма грудной клетки по-прежнему без патологии. Начаты инфузии ганцикловира по 2 раза в день и продолжав ются еженедельные инфузии ВВИГ для восстановления иммунной системы. Через 1 неделю ЦМВ-антиген в крови не обнаруживается. Доза ганцикловира через 10 дней снижена до поддерживающей (3 введения в неделю). В ДЕНЬ 120 после трансплантации выявлено повышение активности АлАТ, АсАТ и щелочной фосфатазы в крови. Отмечена эритематозная кожная сыпь на спине пациента. Назначен перорально преднизолон для лечения предполагаемой хБТПХ, и ее признаки медленно разрешаются. Постепенно дозу преднизолона снижают, вплоть до отмены. 1 ГОД ПОСЛЕ ТРАНСПЛАНТАЦИИ. Пациент чувствует себя хорошо. Он не принимает лекарственные препараты и возвратился к работе. Количество клеток крови нормальное, при исследовании костного мозга признаки остаточного лейкоза не выявляются.
Вопрос 1. Являются ли диарея, тошнота и десквамация эпителия слизистых оболочек, описанные на 4-й день после трансплантации, характерными для мукозита? Как лучше всего лечить мукозит?
Ответ. Чтобы контролировать боль, используют наркотическую аналге-зию. Для профилактики суперинфекции можно назначить антисептические полоскания рта хлоргексидином. Необходимо начать проведение парентерального питания, поскольку пероральное потребление снижается. Диарея, развитие которой связано с мукозитом, обычно нечувствительна к терапии лекарственными препаратами. Нужен тщательный контроль за балансом жидкости для предотвращения дегидратации и электролитного дисбаланса.
Вопрос 2. У пациента развивается лихорадка на 10-й день. Каковы потенциальные источники инфекции?
Ответ. В этот период после трансплантации костного мозга нередки бактериальные инфекции. Наиболее вероятные их источники — ЖКТ, легкие, синусы, кожа и катетер центральной вены. Часто источник инфекции не выявляется.
Вопрос 3. Как бороться с лихорадкой?
Ответ. Следует очень серьезно относиться к любому эпизоду лихорадки, возникающему у пациента при нейтропении. Необходимо немедленно начать эмпирическое антибактериальное лечение антибиотиками широкого спектра действия, например цефтазидимом. Провести тщательный функциональный анализ всех систем и физикальное обследование с акцентом на выявление наиболее частых источников инфекции, перечисленных выше. Выполняют посев крови на гемокультуру, анализ мочи и рентгенограмму грудной клетки. Если лихорадка сохраняется более 3-4 дней, несмотря на адекватное антибактериальное лечение, эмпирически назначают противогрибковые препараты (амфотерицин).
Вопрос 4. Счемпроводитсядифференциальный диагнозсимптомов, описанных вдень 14?
Ответ. У пациента, вероятно, развилась умеренная форма веноокклюзион-ной болезни печени. Дифференциальный диагноз проводится с токсичес-

332 |
Глава 8. Трансплантация стволовых клеток |
|
|
|
|
ким медикаментозным гепатитом, например вследствие лечения циклоспорином, инфекционным гепатитом либо печеночной формой оБТПХ. ДЕНЬ 14 — еще слишком ранний срок для возникновения БТПХ, к тому же это патологическое состояние обычно не осложняется развитием асцита, болями в правом верхнем квадранте живота и увеличением веса. Вопрос 5. Каковы потенциальные осложнения реактивации ЦМВ? Ответ. Наиболее грозным осложнением реактивации ЦМВ является ЦМВ-ассоциированный интерстициальный пульмонит. Также мишенями ЦМВ-инфекции могут быть печень и ЖКТ. ЦМВ-инфекция, как и ган-цикловир, который обычно используется при ее лечении, часто вызывает подавление костного мозга. В этой ситуации для увеличения в крови количества нейтрофилов можно использовать гранулоцитарный колониестиму-лирующий фактор. В качестве альтернативы ганцикловиру назначаютфос-карнет.
Вопрос 6. Существует ли вероятность рецидива хБТПХ у этого пациента? Ответ. Благоприятные прогностическиефакторы, определяемыеу этого больного, включающие ограниченную степень заболевания, отсутствие значительных проявлений оБТПХ в раннем посттрансплантационном периоде, началохБТПХ после ДНЯ 100 и полную адекватную реакцию на назначенную терапию, позволяют предположить, что у него не возникнет рецидивахБТПХ.
Избранная литература
Almici С, Carlo-Stella С, Wagner J. Е. , Rizzoli V. Umbilical cord blood as a source of hematopoietic stem cells: from research to clinical application. Haematologica, 1995; 80:473-479.
В этом обзоре рассматривается возможность использования стволовых клеток из пуповинной крови (СКПК) как источника донорских клеток при трансплантациях; выделены преимущества и ограничения применения СКПК.
Appelbaum F. R., Clift R., Radich J., Anasetti C, Buckner C. D. Bone marrow transplantation for chronic myelogenous leukemia. Semin. Oncol., 1995; 22: 405-411.
В данном обзоре суммированы результаты трансплантации костного мозга при лечении хронического миелолейкоза (ХМЛ). Сравнивается эффективность трансплантаций от неполностью совместимых родственных доноров и совместимых неродственных доноров у больных ХМЛ.
Appelbaum F. R., Fisher L. D., Thomas E. D. Chemotherapy versus marrow transplantation for adults with acute nonlymphocytic leukemia: a five-year follow-up. Blood, 1988; 72: 179-184.
В настоящей работе приводятся результаты проспективного исследования, предпринятого в одном медицинском учреждении, показывающие преимущества трансплантаций аллогенного костного мозга перед стандартной химиотерапией при лечении острого нелимфоцитарного лейкоза. Подчеркивается важность возраста и прогноза опухоли при выборе лечения.
Barrett J., Treleaven J. Bone Marrow Transplantation in Practice. New York: Churchill Livingstone; 1992.
Иллюстрированный клиническими примерами учебник, в котором рассматриваются и аутологичная, и аллогенная трансплантации костного мозга. В первом разделе
Аутологичная трансплантация ___________________________________________ 333
книги обсуждается роль трансплантации костного мозга в лечении злокачественных и незлокачественных заболеваний. Во втором разделе рассматриваютсяпрактическиеаспектыэтойпроцедуры.
Cheson B.D. Chemotherapy and bone marrow transplantation for myelodysplastic syndromes. Semin. Oncol, 1992; 19: 85-94.
Обзор публикаций по трансплантации костного мозга при миелодиспластическом синдроме. Хотя ТКМ — единственный вид лечения миелодисплазии, дающий надежду на выздоровление, связанная с трансплантацией смертность и вероятностьрецидивавыше, чемприпервичновыявленномлейкозе. Возможно, это обусловлено увеличением возраста и длительным предшествующим лечением пациентовсмиелодисплазией.
Fennelly D., Vahdat L., Schneider J. et al. High-intensity chemotherapy with peripheral blood progenitor cell support. Semin. Oncol, 1994; 21: 21-25.
Инфузия клеток-предшественников периферической крови (КППК) является эффективным средством, облегчающим проведение высокодозной химиотерапии. Сообщаются данные из Мемориального центра рака Sloan-Kettering о значительно более коротком периоде нейтропении при поддержке КППК после курсахимиотерапии, состоящегоизкарбоплатина, этопозидаициклофосфамида. В отдельном исследовании КППК использовались для облегчения переносимости двухбыстрыхциклическихкурсоввысокодозной химиотерапии.
FerraraJ. L. M., Deeg H. J. Graft-versus-host disease. N. Engl.J. Med., 1991; 324: 667-674.
Обзорная статья, в которой подробно рассмотрены острая и хроническая болезни «трансплантат против хозяина». Изложены детали клинической картины, патофизиологии, подходов к профилактике и лечению, а также гипотезы относительноролипродукциицитокиноввэтиологииостройБТПХ.
Lu L,. Shen R. N., Broxmeyer H. E. Stem cells from bone marrow, umbilical cord blood and peripheral blood for clinical application: current status and future application.
Crit. Rev. Oncol. Hematol, 1996; 22: 61-78.
В работе представлена информация о потенциальных возможностях использования пуповинной крови. Рассматриваются также перспективы генной инженерии стволовыхкроветворныхклетокдлялечениягенетическихзаболеваний.
Miller A. M. Hematopoietic growth factors in autologous bone marrow transplantation. Semin. Oncol, 1993; 20: 88-95.
В статье дан обзор опубликованных сведений о применении Г-КСФ, ГМ-КСФ и эрит-ропоэтина при проведении аутологичной трансплантации стволовых клеток.-Использование Г-КСФ или ГМ-КСФ значительно сокращает период нейтропении. Хорошопредставленыполезныеэффектыэритропоэтина.
Momin F., Chandrasekar P. H. Antimicrobial prophylaxis in bone marrow transplantation. Ann. Intern. Med., 1995; 123: 205-215.
Исчерпывающий обзор многочисленных профилактических режимов противомикроб-нойтерапии.
Purdy М. Н., Shpall E. J. The role and methodology for purging tumor from autologous bone marrow and peripheral blood progenitor cells. Med. Oncol, 1994; 11: 47-51.
Вработе обобщены данные об опухолевой контаминации стволовых клеток, взятых
убольных раком. Для очистки стволовых клеток от опухолевых применяли хими-отерапевтический агент 4-НС и позитивную селекцию стволовых клеток с использованием антигена CD34.
334
Sable C. A., Donowitz G. R. Infections in bone marrow transplant recipients. Clin Infect, Dis., 1994; 18: 273-284.
Превосходный обзор инфекционных осложнений, возникающих в ходе трансплантации костного мозга и после нее.
Shulman Н. М., Hinterberger W. Hepatic veno-occlusive disease: liver toxicity syndrome, ] after bone marrow transplantation. Bone Marrow Transplant., 1992; 10:197-214.
Показана необходимость изучения причин В ОБ и обобщены современные подходы, используемые для контроля этого осложнения, часто приводящего к смертельному исходу.
Storb R., Anasetti С, Appelbaum F. et al. Marrow transplantation for severe aplastic anemia and thalassemia major. Semin. Hematol, 1991; 28: 235-239.
Планируя трансплантацию при незлокачественных заболеваниях, необходимо тщательно взвешивать соотношение риск/польза. Это особенно актуально в случае талассемии. В обзоре обсуждаются и другие проблемы.
Wingard J. R. Viral infections in leukemia and bone marrow transplant patients.
Leukemia and Lymphoma, 1993; 11:115-125.
Основное внимание в обзоре уделено герпетической и цитомегаловирусной инфекции. Определены методы их лечения.

Глава 9
Злокачественные опухоли кроветворной ткани
Лоуренс Н. Шульман
Молекулярные основы возникновения злокачественных опухолей кроветворной ткани
Все болезни, описанные в этой главе,— результат злокачественного преобразования гемопоэтических клеток, приводящего к их клональному нерегулируемому росту. Как показано на рис. 9-1, все гемопоэтические клетки происходят из стволовых клеток, которые в норме самореплицируются, обеспечивая непрерывную продукцию клеток крови в течение всей жизни человека, а также дифференцируются в зрелые специализированные клетки, необходимые для функционирования организма. Тщательно сбалансированный и регулируемый рост клеток обычно сопровождается образованием соответствующего количества зрелых потомков. При этом первичные стволовые клетки не истощаются, и существует достаточный резерв возможностей для адекватного ответа на такой стресс, как инфекции или кровотечение(глава 1).
Следует отметить, что созревшие клетки крови: эритроциты, лейкоциты и тромбоциты — запрограммированы на клеточную смерть, тогда как стволовые клетки должны сохраняться для поддержания жизни организма. Эта закономерность нарушается при злокачественных опухолях системы крови. Так, при мие-лопролиферативных заболеваниях усиливается самовозобновление ранних стволовых клеток с поддержанием нормального уровня дифференцировки в целом и интенсификацией дифференцировки некоторых ростков кроветворения (например, эритроидного ростка при истинной полицитемии). При остром миелобласт-ном лейкозе бласты самовозобновляются, но не дифференцируются и, следовательно, бластные формы накапливаются без образования из них зрелых потомков.
Хромосомные повреждения гемопоэтических стволовых клеток вызывают аномальный и клональный рост. Количество идентифицированных хромосомных аномалий, связанных с болезнями кроветворного аппарата, увеличивается. Их обнаружение, например выявление bcr-abl-транслокации t(9;22) при хроническом миелолейкозе или t(15;17) при остром промиелоцитарном лейкозе, позволяет объяснить нарушение клеточного роста и злокачественную трансформацию клеток. Вероятно, в будущем мы будем лучше понимать молекулярные механизмы развития подобныхзаболеванийииспользоватьэтизнаниядляихпрофилактикиилечения.
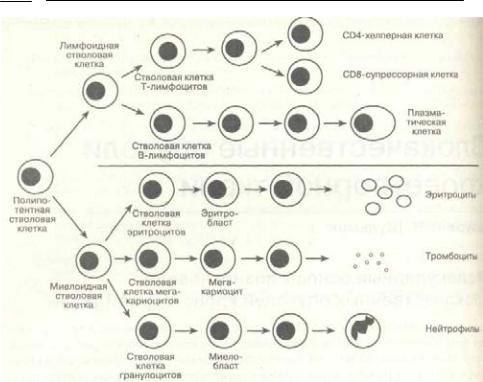
336Глава 9. Злокачественные опухоли кроветворной ткани
Рис. 9-1. Упрощенная схема миелоидного и лимфоидного ростков кроветворения
Лейкозы подразделяются на острые и хронические. Острые лейкозы характеризуютсяпродукциейнезрелыхбластныхклетокбезсозревания, чтоприводитк быстрой замене нормальных гемопоэтических элементов костного мозга. Могут повреждаться миелоидный или лимфоидный ростки кроветворения. Без лечения острые лейкозы быстро завершаются гибелью пациента из-за нейтропении, способствующей возникновению инфекции, и тромбоцитопении, вызывающей кровотечения. Хронические лейкозы при отсутствии лечения развиваются менее стремительно. При хроническом миелолейкозе повышена пролиферация миело-идных клеток-предшественников, однако дифференцировка до зрелых клеток (эритроциты, лейкоциты и тромбоциты) сохраняется. Хронический лимфолейкоз по сути дела представляет собой вялотекущую неходжкинскую лимфому с вовлечением периферической крови. Он будет обсуждаться в разделе этой главы, посвященном лимфомам.
Острые лейкозы
Патофизиология и классификация. К острым лейкозам относятся острый мие-лобластный лейкоз (ОМЛ) и острый лимфобластный лейкоз (ОЛЛ). Обе болезни характеризуются злокачественной и клональной пролиферацией незрелыхбластныхпредшественников, которыевзначительнойстепенипотеряли дифференци-ровочный потенциал. Проявления каждого из этих заболеваний обусловлены способностью лейкозных бластов замещать нормальные элементы костного моз-

Острые лейкозы _____________________________________________________ 337
га, что ведет к панцитопении, а также инфильтрировать другие ткани, например десныимозговыеоболочки.
Острый миелобластный лейкоз. ОМЛ объединяет группу болезней, характеризующихся пролиферацией злокачественных бластов миелоидного ряда. К ним относятся миелобласты, промиелобласты, монобласты, эритробласты и мегака-риобласты. Все эти клетки — потомство общей миелоидной стволовой клетки, и в норме они самовозобновляются и дифференцируются в функционально зрелые клетки крови: эритроциты, нейтрофилы, моноциты и тромбоциты (рис. 9-1). Поскольку понятие миелоидный иногда используют, чтобыобозначитьтольконейт-рофильнуюлинию, впрошломэтугруппулейкозов называли острыми нелимфо-цитарными лейкозами, но в настоящее время предпочтительно использовать термин "острый миелобластный лейкоз". Специалистами франко-американо-британской (FAB) рабочей группы предложена классификация ОМЛ, приведенная в табл. 9-1 и 9-2. Подтипы Ml, M2 иМЗпредставляютразличные стадиидиффе-ренцировкимиелобластов. МО ОМЛ можно определить по миелоидной природе поверхностных маркеров клетки, например CD33, однако в бластах при этом заболевании не продуцируются миелоидные ферменты, из-за чего гистохимическое окрашивание на миелопероксидазу отрицательно. В подтипах М1-МЗ постепенно возрастает степень первичной грануляции так, что подтип МЗ представляет собой острый промиелоцитарный лейкоз. М4-М5 ОМЛ — это монобластные лейкозы с миелоидными элементами или без них соответственно. Мб ОМЛ — эритро-лейкоз, а М7 — мегакариобластный лейкоз. Как показано в табл. 9-2, подтипы ОМЛ различаются по морфологии, гистохимическому окрашиванию, кариотипу и иммунофенотипу патологических клеток. Перечисленные методы помогают также отличать ОМЛ от ОЛЛ при неоднозначной морфологии клеток.
Для развития ОМЛ достаточно одной клетки, повреждение хромосом которой приводит к экспансии злокачественного клона со сниженной способностью к дифференцировке до зрелых потомков. Из-за потребности в саморепликации и воспроизводстве клеток в течение всей жизни человека бласты не запрограммированы на умирание. Зрелые потомки (эритроциты, нейтрофилы, тромбоциты) имеют конечную продолжительность жизни, и их гибель предопределена. При ОМЛ бласты продолжают реплицироваться без последующей дифференцировки и, следовательно, накапливаются в костноммозгеи других тканях. Дефектные бласты
ТАБЛИЦА 9-1. Франко-американо-британская (FAB) классификация острого миелоидного лейкоза
МО: Острый недифференцированный лейкоз М1: Острый миелобластный лейкоз без дифференцирования
М2: Острый миелобластный лейкоз с формированием некоторых гранул МЗ: Острый промиелобластный лейкоз (промиелоцитарный1)
М4: Острый миеломоноцитарный лейкоз (миеломонобластный1) М5: Острый моноцитарный лейкоз (монобластный1)
Мб: Эритролейкоз М7: Мегакариобластный лейкоз
По: Bennett J. M., Catovsky D., Daniel M.-T. et. al. Proposals for the classification of the acute leukemias.
Br. J. Haematol., 1976; 33: 329-331. 1 Названия, принятые в России.
338 |
Глава 9. Злокачественные опухоли кроветворной ткани |
|
|||
ТАБЛИЦА 9-2. Гистохимические, иммунофенотипические и хромосомные |
|
|
|||
|
характеристики измененных клеток при острых лейкозах |
|
|||
Заболевание |
Гистохимия |
Иммуно- |
Хромосомные |
|
|
|
|
фенотип |
аномалии |
|
|
ОМЛ, МО ОМЛ, |
Все тесты отрицательны |
CD13, CD33, CD34 |
|
|
|
М1,2 |
Миелопероксидаза |
CD13, CD33 |
t(8;21) |
|
|
|
Судан черный |
|
|||
ОМЛ, МЗ |
Миелопероксидаза |
CD13, CD33 |
t(15;17) |
|
|
|
Судан черный |
|
|||
ОМЛ, М4 |
Миелопероксидаза |
CD13, CD33, |
|
|
|
|
Неспецифическая эстераза |
|
|
|
|
ОМЛ, М5 ОМЛ, |
Неспецифическая эстераза |
CD11b, CD14 |
Inv16 |
|
|
Мб ОМЛ, М7 |
PAS |
CD11b, CD14 |
|
|
|
ОЛЛ, |
Антиген фактора VIII |
CD13, CD33 |
5q-, 7q- |
|
|
Т-кле-точный |
PAS |
CD13, CD33.CD41 |
|
|
|
тип ОЛЛ, |
PAS |
CD3, CD5, CD7 |
|
|
|
пре-В-клеточн |
CD10, CD19 |
t(9;22) |
|
||
ый тип |
|
|
|||
|
|
|
|
|
|
развиваются не быстрее нормальных, но из-за отсутствия дифференцировки они накапливаются, вытесняя неповрежденные элементы костного мозга, что приводит к дефициту эритроцитов, зрелых лейкоцитов и тромбоцитов.
В большинстве случаев причина возникновения ОМЛ неизвестна, однако идентифицирован ряд этиологических факторов. Слабым, но достоверным лей-козогеном является радиация. Лейкозы вызывают и некоторые химиотерапевти-ческие агенты, такие как алкилирующие вещества и ингибиторы топоизомеразы II, а также растворители, например бензол. Кроме того, ОМЛ может развиваться как следствие предшествующих гематологических нарушений: истинной полиците-мии, миелоидной метаплазии, пароксизмальной ночной гемоглобинурии имие-лодисплазии.
С лейкозными бластами ассоциированы определенные хромосомные аномалии, играющие важную роль в лейкозогенезе. Идентификация этих хромосомных аберраций имеет прогностическое значение. Некоторые из них являются патогно-моничными для конкретного подтипа ОМЛ. Так, t(15;17) всегда обнаруживают при МЗ — остром промиелоцитарном лейкозе (ОПМЛ). Наличие некоторых аномалий, таких как транслокация t(8;21) или инверсия в хромосоме 16, предвещает хороший прогноз. Другие, например делеции длинного плеча хромосом 5 и 7,— маркеры неблагоприятного прогноза. Выяснениемолекулярныхпроцессов, связанныхсподобнымитранслокациямии делециями, несомненно, значительноприблизиткпониманиюпатогенезаОМЛи, возможно, повлияет на терапию, что уже имеет место при МЗ (см. далее). Все пациенты с недавно диагностированным ОМЛ должны пройти цитогенетическое исследование лейкозных бластов, полученных из костного мозга или периферической крови.
Острыйлимфобластныйлейкоз. ОЛЛ могут быть пре-В- или Т-клеточного типа (в главе 4 рассмотрена физиология лимфоидной ткани). В обоих случаях продуцируются незрелые лимфобласты, которые в дальнейшем не дифференцируются до зрелых лимфоидных потомков. Существует две классификации ОЛЛ: морфологическая (FAB) и иммунологическая (табл. 9-2 и 9-3). Классификация FAB не яв-
