
3 курс / Патологическая физиология / Патофизиология_крови,_Фред_Дж_Шиффман
.pdf
238 |
Глава 6. Гемостаз и |
|
тромбоз |
присущ значительный недостаток — передача вирусных инфекций, поэтому в настоящее время он заменен концентратом ФВ, содержащим полный спектр муль-1 тимеров ФВ, но применение которого связано с минимальным риском передачи вирусной инфекции. Концентраты ФУШ не содержат интактного ФВ, а поэтому их не рекомендуется использовать для лечения БВ.
Продолжительность и интенсивность лечения БВ еще не установлены точно, как при гемофилии. Во время подготовки к серьезному хирургическому вмешательству необходимо повысить уровень ФВ до 80 % и поддерживать его в течение трех дней после операции на уровне 40%, а последующие 5 дней — на уровне 30 %, 1 ед/кг концентрата ФВ повышает уровень в плазме до 24 ед/дл. В редких случаях у больных с БВ образуются ингибиторы. Тогда возникает сильное кровотечение и лечение дополняют плазмообменом, экстракорпоральной адсорбцией или введением у-глобулина.
Во время беременности у больных с БВ типа I нет осложнений, связанных с кровотечением, поскольку уровень ФВ повышается. После родоразрешения его уровень быстро падает, соответственно, необходимо применять десмопрессин или концентрат ФВ. У женщин с БВ типа III или типа НА и НВ могут возникать (интенсивные) кровотечения во время беременности, родов и после родов. Им необходимо вводить концентрат ФВ.
Приобретенная болезнь Виллебранда. Приобретенная БВ — результат понижен-
ного синтеза ФВ, вторичной аномалии ФВ или выработки аутоантител. Последние нарушают функцию ФВ или образуют с ним комплексы, тем самым ускоряя его клиренс. Состояния, связанные с развитием БВ, представлены в табл. 6-7. Лечение включает устранение основного заболевания и инфузии концентрата ФВ. При злокачественных заболеваниях нужно попытаться удалить опухоль или провести химиотерапию. Больных с аутоиммунными нарушениями лечат стероидами, иммуносупрессивными средствами и введением у-глобулина. Иногда этого достаточно для остановки кровотечения. Если кровотечение не прекращается, следует использовать концентрат ФВ.
Дефицит фактора XI
ДефицитФХ1 — врожденнаяпатология, наследуемаяаутосомно-рецессивнымпутем; наблюдается в основном у евреев-ашкенази.
У гетерозигот кровотечения обычно незначительны. У гомозигот с дефицитом ФХ1 осложнений, связанных с кровоточивостью, мало. Но при травме или хирургическом вмешательстве не исключено возникновение сильного кровотечения с формированием гемартроза и гематомы.
ТАБЛИЦА 6-7. Патологические состояния, связанные с приобретенной болезнью Виллебранда
Гипертиреоз |
Пролапсмитральногоклапана |
ОпухольВильмса |
Ангиодисплазия |
Миелопролиферативныезаболевания |
Легочная гипертензия |
Наследственнаятелеангиэктазия |
Множественнаямиелома |
Лимфопролиферативныезаболевания |
Аденокарцинома |
Острый респираторный дистресс-синдром |
|
Аутоиммунные нарушения (например, системнаякраснаяволчанка)

Нарушениягемостаза_____________________________________________ 239
Лабораторная диагностика. Результаты скрининг-тестов:
1.ПролонгированноеАЧТВ; нормальноеПВ; нормальноеколичество тромбо цитов; нормальное ВК.
2.АЧТВ 1 : 1 микст-тесты — коррекция до нормы; дефицит фактора.
3.УровниФХ1:С иФХ1:Агснижены илиравны нулю.
Лечение. Замещение ФХ1 вливанием свежезамороженной плазмы или рекомби-нантного ФХ1. Перед экстракцией зуба необходимо профилактическое введение £-аминокапроновой кислоты или транексамовой кислоты (как при гемофилии).
Наследственные дефициты других факторов свертывания крови
Наследственные дефициты других факторов свертывания крови встречаются редко (менее чем 1 на 1 млн человек). Путь передачи чаще всего аутосомно-рецес-сивный. Дефицит ФХП, ПК и ВМК не связан с возникновением кровотечения, в отличие от дефицита других факторов. У людей с такой патологией выявлено снижение функциональной активности факторов, уменьшение их содержания в плазме или увеличение АЧТВ/ПВ.
Лабораторная диагностика Дефицит ФХП, ПК и ВМК. Результаты скрининг-тестов:
1.ПролонгированноеАЧТВ; нормальноеПВ и нормальное количество тром боцитов.
2.АЧТВ 1 : 1 микст-тесты — коррекция АЧТВ; дефицит фактора.
3.Уровни ФХИ, или ПК, или ВМК снижены либо равны нулю.
Дефицит ФУП. Результаты скрининг-тестов:
1.Пролонгированное ПВ; нормальное АЧТВ и нормальное количество тром боцитов.
2.Уровень фактора VII снижен или отсутствует.
ДефицитфакторовV, X, II, I. Результатыскрининг-тестов:
1.Пролонгированные АЧТВ и ПВ; нормальное количество тромбоцитов.
2.АЧТВ и ПВ 1 : 1 микст-тесты - коррекция АЧТВ и ПВ;
3.Факторы V, X, II, I: уровень снижен или они отсутствуют.
Аномалии фибриногена. Наиболее тяжелой формой аномалии фибриногена, ведущей к кровотечению, является афибриногенемия. Гипофибриногенемии, как правило, бессимптомны. При дисфибриногенемиях увеличиваются АЧТВ и ПВ на фоне нормальной концентрации фибриногена, но сниженной его активности. Некоторые мутации, связанные с дисфибриногенемией, клинически проявляются кровотечением, другие — тромбозом или спонтанными абортами. Большинство дефектов наследуется аутосомно-доминантным путем.
Дефицит фактора XIII. Это редкое заболевание с аутосомно-рецессивным типом наследования, которое проявляется тяжелым кровотечением, гемартрозом, гематомами, плохим заживлением ран и спонтанными абортами. Результаты скрининг-тестов на ПВ, АЧТВ, количество тромбоцитов, ВК и фибриноген в пределах нормы. Повышенная растворимость кровяного сгустка в 5 М мочевине или 1 % монохлоруксусной кислоте указывает на наличие дефицита ФХШ, что подтверждается при определении ФХШ:Аг и ФХШ:С.
Лечение включает проведение заместительной терапии свежезамороженной плазмой.

240 |
|
|
Глава 6. Гемостаз и |
|
|
|
тромбоз |
Приобретенные нарушения факторов свертывания крови
Приобретенныенарушениясистемысвертываниякровинаблюдаютсячаще, чемнаследственные, и, как правило, обусловленымножественным дефицитомфакторов свертывания. Восновееговозникновениялежатразличныемеханизмы(табл. 6-8
Дефицит витамина К
ВитаминКпоступаетспищей(сзеленымиовощами) иобразуетсяворганизмеза счет бактериального синтеза в кишечнике. Это жирорастворимый витамин, содержание которого зависит от активности липаз поджелудочной железы, наличия желчи, всасывающей способности кишечника (поступление в кровообращение) и степени утилизации гепатоцитами. Дефицит витамина К возникает в результате неадекватного питания, заболеваний поджелудочной железы, закупорки желчных путей, нарушенного всасывания, лечения антибиотиками, а также при лечении антикоагулянтами.
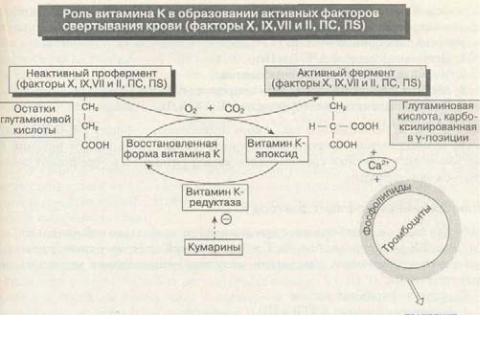
Витамин К необходим в заключительных стадиях синтеза факторов X, IX, VII и II, ПС и nS для проявления их биологической активности. Окисление витаминаК в его эпоксидную форму существенно для у-карбоксилирования остатков глутами-новой кислоты на этих витамин К-зависимых белках. Данный посттрансляционный процесс включает карбоксилирование у-углерода нескольких остатков глутамино-вой кислоты на N-конце белковых молекул. Затем у-карбоксилированнаяглутами-новаякислотасвязываетсяскальциемипосредством его прикрепляется к фосфоли-пидным рецепторам клеточных мембран (например, тромбоцитов, ЭК). Данныйпроцессспособствуетактивациисистемысвертывания крови. Во время карбокси-лирования витамин К окисляется в эпоксид и затем снова восстанавливается в активную форму редуктазой (рис. 6-25). Перорально принимаемые антикоагулянты (кумарины) ингибируют восстановление эпоксида витамина К, мешая эффективному превращению витамина К в его активную ферментную форму, и ограничивают действие карбоксилазы. У больных, получающихкумарины, образуютсянеактивныевитаминК-зависимыефакторы, а кровьимеетпониженнуюсвертываемость.
У детей и взрослых с недостатком витамина К возникают кровотечения, которые могут быть сильными и обычно проявляются в виде экхимоза, гематом, желу- дочно-кишечных кровотечений, гематурии. Дефицит витамина К следует предполагать при наличии геморрагического синдрома (сочетанных заболеваний) и отклонения показателей крови от нормы.
ТАБЛИЦА 6-8. Приобретенные нарушения свертывания крови
Дефицит витамина К Мальабсорбциявитамина К(целиакия, спру) Обструкцияжелчевыводящихпутей
Лечение антагонистами витамина К (кумарины) Лечение антибиотиками Геморрагическая болезньноворожденногоПриобретенный дефицит ФХБолезнь печени
Массивный трансфузионный синдром Приобретенные ингибиторы свертывания крови Диссеминированное внутрисосудистое свертывание (ДВС) Фибринолитические состояния
Нарушениягемостаза |
241 |
Активация
свертывания
Рис. 6-25. Способы влияния витамина К на активацию факторов X, IX, VII, II, ПС и IIS (сокращения см. втексте)
Результаты скрининг-тестов:
1.Пролонгированные АЧТВ и ПВ.
2.Нормальное количество тромбоцитов.
3.АЧТВ и ПВ 1 : 1 микст-тесты — коррекция АЧТВ и ПВ.
4.Пониженная активность факторов VII, IX, X, II.
5.Нормальная концентрация антигенов факторов VII, IX, X, П.
Наличие нефункционирующих витамин К-зависимых факторов подтверждает дефицит витамина К. Клинически диагноз дефицита витамина К можно поставить на основании положительного эффекта назначения витамина К, сопровождающегося нормализацией ПВ и АЧТВ.
Лечение включает коррекцию основного нарушения, введение витамина К, переливание свежезамороженной плазмы при сильном кровотечении. С целью профилактики витамин К принимают перорально. ПВ отчасти улучшается через 7 ч благодаря восстановлению CDVII (Т(/2 = 4-7 ч). Витамин К вводят ежедневно в течение 3 дней, так как другие витамин К-зависимые факторы имеют более длительный период полусуществования (Ф1Х — около 1 сут; ФХ — 2 сут; ФП — 3 сут). Через 3 дня ПВ и АЧТВ полностью нормализуются.
Геморрагическая болезнь новорожденного
Дефицит витамина К у новорожденного — иной синдром. Геморрагическая болезнь возникает на 2-4-й день жизни и обусловлена пониженным синтезом витамин К-за- висимых факторовсвертывания крови. Причины дефицита витаминаК— уменьшение его запасов и функциональная незрелость печени, отсутствие бактериально-

242 |
Глава 6. Гемостаз и |
|
тромбоз I |
го синтеза в кишечнике, низкое количество витамина К в грудном молоке и, редко, | приемлекарственныхпрепаратовматерью(аспирин, фенитоинидр.). Результаты скрининг-тестов:
1.Пролонгированные АЧТВ и ПВ.
2.Нормальное количество тромбоцитов.
3.АЧТВ и ПВ 1 : 1 микст-тесты — коррекция АЧТВ и ПВ.
4.Пониженная активность факторов VII, IX, X, II.
Всем детям, за исключением тех, у кого подозревают дефицит Г-6-ФДГ (опасность возникновения гемолиза эритроцитов [глава 3]), назначают витамин К( (фитоменадион). Детям с кровотечением вводят витамин К и переливают свежезамороженную плазму.
Приобретенный дефицит фактора X
Дефицит фактора X наблюдается при амилоидозе вследствие избирательной ад-1 сорбции ФХ амилоидным белком. Геморрагический синдром у таких пациентов проявляется экхимозами, гематомами, желудочно-кишечными и мочеполовыми | кровотечениями.
Результаты скрининг-тестов:
1.Пролонгированные АЧТВ и ПВ.
2.Нормальное количество тромбоцитов.
3.АЧТВ и ПВ 1 : 1 микст-тесты - коррекция АЧТВ и ПВ.
4.Уровни ФХ:С и ФХ:Аг снижены или равны нулю.
Болезни печени
Коагулопатия при болезнях печени ассоциируется с кровоточивостью, в ряде случаев — тяжелой. Она возникает в результате множественных нарушений гемостаза (табл. 6-9). Нарушенный синтез витамин К-зависимых факторов в данном случае опосредован внутрипеченочным холестазом, ухудшением утилизации витамина К, снижением его всасывания, нарушениями диеты. Снижение синтеза других факторов, не зависящих от витамина К (факторы V, XI, XII иXIII, фибриноген), такжеспособствуетвозникновениюкровоточивости. Крометого, упациентовсболезнямипеченинаблюдаетсяхроническаяактивация свертывания крови и фибринолитической системы; регуляторные механизмы (естественные ингибиторы) последней также нарушены.
ТАБЛИЦА 6-9. Коагулопатия при заболеваниях печени
Пониженныйсинтез факторов свертывания крови: | Витамин К-зависимые факторы X, IX, VII, II
I Витамин К-независимые факторы V, XI, XII, I, ПК, ВМК Активацияфакторов свертываниякрови(диссеминированнаявнутрисосудистая коагулопатия)
Дисфибриногенемия Тромбоцитопения и нарушение функции тромбоцитов
Пониженныйсинтез иповышение потребления ингибиторов Повышенный фибринолиз (|ТАП, |а2-антиплазмин)
Нарушения гемостаза |
243 |
Снижается количество тромбоцитов, возникает их дисфункция. Первое происходит из-за уменьшения продукции костным мозгом. В'результате спленомега-лии увеличивается секвестрация тромбоцитов селезенкой, а в печени
иселезенке усиливается их разрушение. Механизмы, лежащие в основе дисфункции тромбоцитов, неясны. Предполагают, что при повышенном фибринолизе аномальный фибриноген, который связывается с мембраной тромбоцитов, нарушает их реактивность. У некоторых больных возникает дисфибриногенемия (пониженное содержаниесиаловойкислотывфибриногене), чтотакжеобусловливаетвозникновениедефектагемостаза.
Ускоренный фибринолиз — результат повышенногоуровня ТАП в плазме в связи с нарушением печеночного клиренса, отсутствием соответствующего прироста содержания ингибиторов активатора плазминогена (ИАП) и снижением
синтеза а2-антиплазмина. В ответ на активацию системы свертывания крови возникает гиперфибринолиз.
При хронических заболеваниях печени активация свертывания крови, вероятно, является результатом выделения тканевого фактора некротизированными клетками, а также нарушения клиренса активированных факторов свертывания
иснижения синтеза основных регуляторных белков (AT III, ПС, ПЭ, ГПН).
При остром и тяжелом поражениях гепатоцитов острая активация наслаивается на хроническую активацию свертывания. Полагают, что причинами этого являются: изменение выделительной функции некротизированных клеток, выделяющих тканевый фактор, другие прокоагулянты, интерлейкины (ФНО, ИЛ-1), эндотоксины, а также аккумуляция активированных факторов в расширеннойпортальнойсистемеснизкойскоростьюкровотока. Всеэтоприводит
кобразованию тромбина и плазмина за счет активации как свертывания крови, так и фибринолитических систем. Наличие тромбина и плазмина in vivo способствует тромбозу в микроцир-куляторном русле и тяжелому нарушению гемостаза, так называемому синдрому диссеминированного внутрисосудистого свертывания(ДВС).
Характерные показатели лабораторных исследований: пролонгированное ПВ; несколько увеличенное АЧТВ; количество тромбоцитов — 80 000-120 000/мкл; низкий уровень фибриногена; очень высокий уровень ПДФ. Специфическиефакторы: снижено содержание факторов X, IX, VII, II (витамин К-зависимых); также — факторов V, XI, XII, КР, НК, XIII и фибриногена. ФУШ:С нормальный. ФВ:Аг повышен (реактант острой фазы); плазминоген
снижен; AT III, ПС, US и а2-антиплазмин снижены; а2-М иИАПповышены. Лечение заключается в коррекции дефицита витамина К. Витамин К вводится
парентерально, и степень коррекции ПВ определяется через 6-8 ч. Заместительная терапия включает трансфузию больших объемов свежезамороженной плазмы (6-8 доз), которая содержит все факторы свертывания и ингибиторы, способствующие остановке кровотечения. При сильном кровотечении (во время или после хирургического вмешательства) для обеспечения гемостаза необходимо вводить СЗП каждые 6-12 ч. В некоторых случаях требуются дополнительные меры, например заменные трансфузии, применение концентратов протромбин-комплекса (активированный ФХ может вызвать ДВС), трансфузии тромбоцитов, введение концентратов AT III.
Больным с тяжелыми дефектами функции тромбоцитов можно вводить дес-мопрессин. Перед удалением зубов пациентам назначают антифибринолитичес-кие препараты, например ЭАКК.

244 |
Глава 6. Гемостаз и тромбоз |
|
|
|
|
Подготовка к большой хирургической операции, как правило, включает: ^лечение введением витамина К и свежезамороженной плазмы; 2) трансфузии тромбоцитов для обеспечения их количества на уровне приблизительно 100 000/мкл, Трансфузии тромбоцитов при подготовке к эндоскопии, торакоцентезу, лапаро-центезу и люмбальной пункции показаны больным с количеством тромбоцитов < 50 000/мкл.
Синдром массивных трансфузий
Синдром массивных трансфузий, являющийся приобретенным нарушением кровоточивости, развивается после переливания больших объемов консервированной крови. Возникновению геморрагического диатеза способствуют многие факторы. Тяжесть кровотечения зависит от количества перелитой крови и скорости переливания, от времени хранения гемокомпонентов, а также от предшествующей и сопутствующей патологии.
1.Количество перелитой крови и скорость переливания. Если больные получа ют более 10 доз консервированной крови за период менее 24 ч, у них может возникнуть кровотечение. После переливания 10 доз крови количество тромбоцитов иногда снижается на 50 %. В консервированной крови количе ство тромбоцитов снижается и происходят качественные изменения этих клеток, поэтому чем больше скорость переливания, тем тяжелее тромбоцитопения и сильнее кровотечение. Переливание эритоцитарной массы и плазмозаменяющих растворов (декстранов) сопровождается разведением тромбоцитов и факторов свертывания крови. Кроме того, декстраны, по крывая мембраны тромбоцитов, ухудшают функцию этих клеток, что усу губляет тяжесть кровотечения.
2.Время хранения продуктов крови. После 24-часового хранения при темпера туре 4 °С происходит агрегация тромбоцитов и утрата ими своих функций. Некоторые факторы свертывания крови теряют активность медленно. Со держание 2-х лабильных факторов, VIII и V, снижается до 80 % первона чальной величины. Активация факторов свертывания крови, микроагрега ты тромбоцитов, пораженные или активированные лейкоциты, бактерии, вирусы, попадая в кровь больного, могут инициировать или усиливать ДВС.
3.Предшествующие или сопутствующие клинические нарушения. Чрезмерная потеря крови приводит к снижению числа тромбоцитов, содержания факто ров свертывания и естественных ингибиторов. Гемостатический дефект в ре зультате массивных трансфузий усиливается, когда нарушается образование тромбоцитов или факторов свертывания. Это происходит у пациентов с за болеваниями печени, идиопатической тромбоцитопенией и ДВС в анамнезе.
При лабораторном обследовании выявляются пролонгированные ПВ и АЧТВ с коррекцией в 1: 1 микст-тесте. Количество тромбоцитов снижено.
Гемостатический дефект предотвращают введением 2-х доз свежезаморожен- нойплазмыи5-тиедиництромбоцитовнакаждые10 илибольшедозперелитойкрови. Может потребоваться использование препаратов кальция, поскольку раствор цитрата, фосфата и глюкозы (декстрозы), применяемый в качестве антикоагулянта для продуктов крови, способен связывать кальций в крови у пациента и вызвать гипокальцемию. Лечение кровотечения включает переливание свежезамороженной плазмы и тромбоцитов (помимо терапии основного заболевания).

Нарушениягемостаза
24
5
Приобретенные ингибиторы свертывания крови
Приобретенные ингибиторы свертывания крови, известные также как циркулирующие антикоагулянты, представляют собой антитела, непосредственно инги-бирующие факторы свертывания крови или их реакции. Ингибиторы могут появляться в результате трансфузии белков плазмы, например у больных гемофилией, или возникать спонтанно у пациентов без исходного нарушения гемостатических механизмов. Большинство приобретенных ингибиторов свертывания крови вызывает кровотечение, а некоторые — тромбоз (волчаночный антикоагулянт/анти-фосфолипидные антитела).
Приобретенные ингибиторы OVIII. Ингибиторы OVIII, образующиеся у больных гемофилией А, были описаны ранее. Спонтанно возникающие ингибиторы ФУШ обнаруживаются с равной частотой у мужчин и женщин, преимущественно в возрасте после 60 лет. У половины пациентов нет сочетанных заболеваний. У остальных выявляются иммунологические нарушения, коллагенозы, злокачественные новообразования или лекарственная аллергия. Ингибиторы OVIII могут возникать у молодых женщин после родов (примерно в 7 % случаев) без каких-либо основных заболеваний. Общее спонтанное исчезновение ингибиторов ФУШ наблюдается у 38 % больных, а летальность в связи с кровотечением достигает 22 %. Нарушения, вызванные ингибиторами OVIII, представлены в табл. 6-10. Ингибитор появляется при рождении первого или второго ребенка. Склонность к кровотечению становится очевидной сразу же или через 2-5 месяцев. Клиническое течение различно, но ингибитор исчезает у большинства пациентов спонтанно через 12-18 месяцев. Причина такой послеродовой реакции неясна.
Подобно ингибиторам, образующимся у гемофиликов, спонтанно приобретенные ингибиторы OVIII являются IgG-антителами, которые не фиксируют комплемент и видоспецифичны. Их эффект зависит от температуры, поэтому для обнаружения ингибирующих свойств требуется инкубирование в течение 1-2 ч при 37 °С. Однако есть разница в кинетике их реакции. При лабораторном обследовании выявляется пролонгированное АЧТВ без коррекции в 1 : 1 микст-тесте. Снижена активность OVIILC, наблюдаются различные уровни содержания ингибитора OVIII. В то время как линейная взаимосвязь между концентрацией ингибитора и количеством инактивированного OVIII характерна для страдающих гемофилией; при появлении спонтанных ингибиторов такая связь отсутствует. У большинствапациентов активностьOVIII вплазменеопределяется. Полагают, чтоОВ может частично блокировать эпитопы OVIII за счет взаимодействия с ингибитором.
ТАБЛИЦА 6-10. Нарушения и состояния, связанные с ингибиторами cpVIII
Иммунологические |
Злокачественные |
Прочие |
расстройства |
заболевания |
|
Системная красная волчанка |
Моноклональные гаммапатии |
После родов |
Ревматоидный артрит |
Лимфопролиферативные |
|
Герпетиформный дерматит |
нарушения |
|
Воспаление кишечника |
Миелофиброз |
|
Рассеянный склероз |
Солидные опухоли |
|
Аллергия к пенициллину |
(плоскоклеточный рак) |
|
246 |
Глава 6. Гемостаз и |
тромбоз! |
|
Лечение аналогично описанному для больных гемофилией, имеющих ингии торы ФУШ.
Длительное лечение пациентов с основными заболеваниями включает та! иммуносупрессию продукции аутоантител.
Приобретенные ингибиторы ФУ. Они появляются у больных с дефицитом Ф однако это наблюдается редко. В большинстве случаев ингибиторы ФУ появля ся у пожилых пациентов, недавно перенесших хирургическое вмешательство, лечение антибиотиками или инфекции (туберкулез), а также не имеющих явных признаков заболевания. Часть таких ингибиторов исчезает спонтанно. Редко ин- ] гибиторы ФУ образуются при миелофиброзе, множественной миеломе, амилои-1 дозе, раке прямой кишки. Ингибиторы ФУ относятся к IgG, IgG-IgM или IgG-lgA. |
При лабораторном обследовании выявляются пролонгированные ПВ и АЧТВ | без коррекции в 1 : 1 микст-тесте. Активность ФУ отсутствует или снижена, титр ингибитора ФУ повышен.
Метод выбора лечения тяжелых кровотечений при наличии ингибитора ФУ-трансфузии тромбоцитов. Тромбоциты содержат ФУ в а-гранулах, поэтому образующийся комплекс тромбоцит-ингибитор ФУ удаляется из кровообращения РЭС-клетками. ФУ, избежавший воздействия ингибитора, и внутриклеточный тромбоцитарный ФУ в данной ситуации способны обеспечить гемостаз.
Приобретенные ингибиторы ФН возникают при системной красной волчанке, циррозе печени и протезировании сердечных клапанов (у больных после операции). Лабораторное обследование выявляет пролонгированные ПВ и АЧТВ без коррекции в 1:1 микст-тесте; увеличение тромбинового времени (глава 11) в связи с действием ингибитора ФН; снижение активности ФП (или ее отсутствие); высокий титр ингибитора ФП.
Приобретенные ингибиторы ФУН — это аутоантитела (IgG), становящиеся причиной тяжелых кровотечений у больных с моноклональной гаммапатией, тяжелой апластической анемией либо у пациентов без сопутствующей патологии. При лабораторном обследовании выявляются пролонгированное ПВ без коррекции в 1 : 1 микст-тесте; АЧТВ нормальное; активность ФУН отсутствует; повышен уровень ингибитора ФУН.
Приобретенные ингибиторы Ф1Х встречаются чрезвычайно редко: при системной красной волчанке и после родов. В большинстве случаев исчезают через 1-7 месяцев.
Приобретенные ингибиторы ФХ1 и ФХН также наблюдаются при системной красной волчанке и лечении хлорпромазином. За исключением больных с наследственным дефицитом ФХ1, у которых развиваются антитела к ФХ1 после трансфузии плазмы, у остальных пациентов ингибиторы к факторам контактной фазы не появляются.
Приобретенные аутоантитела к фибриногену (I), к факторам стабилизации фибрина (ФХШ) и полимеризации фибрина также наблюдаются при системной красной волчанке, моноклональной гаммапатии и после лечения изониазидом. Последний нарушает стабилизацию фибрина (ингибитор ФХШ). Ингибиторы ФХШ подразделяются на 3 типа: типа I направлены против активации ФХШ, но не нарушают трансмидазной активности ФХШ; типа II нарушают трансмидаз-ную активность; типа III препятствуют взаимодействию ФХШ с фибриновым субстратом. Появление спонтанных ингибиторов ФХШ (фибринстабилизирую-

Нарушениягемостаза
24
7
щего фактора) может привести к тяжелым кровотечениям, в том числе с летальным исходом. Лечение направлено на терапию основного заболевания, отмену этиологически значимых лекарственных препаратов, переливание плазмы.
Приобретенные гепариноподобные антикоагулянты, которые являются спонтан-
но возникающими ингибиторами этого типа, наблюдаются у больных с плазмоци-тарными злокачественными новообразованиями, различными опухолями, а также у пациентов с аденокарциномой или раком предстательной железы, получающих терапию сурамином. У некоторых больных развиваются тяжелые геморрагические осложнения. Все ингибиторы в плазме проявляют свойства глюкозаминогликанов и нейтрализуются протамин сульфатом или гепариназой. При тяжелых кровотечениях эффективным лечебным средством считаетсяпротаминсульфат.
Диссеминированное внутрисосудистое свертывание (ДВС)
Острое ДВС — приобретенное тромбогеморрагическое нарушение, возникающее в результате чрезмерного образования тромбина и плазмина в периферической крови. ДВС — всегда явление вторичное, следствие основного патологического процесса, способствующего активации системы свертывания крови и генерации ромбина. Разнообразными способами тромбин вызывает распространенное отложение фибрина в микроциркуляторном русле с потреблением тромбоцитов (агрегация тромбоцитов) и специфических факторов свертывания крови. Плазмин, обеспечивающий протеолиз фибрина и факторов свертывания, еще более влияет на развитие геморрагических осложнений ДВС
(рис. 6-26).
СинонимыДВС— коагулопатияпотребления, синдромдефибринирования, внутрисосудистое свертывание с вторичным фибринолизом, тромбогеморрагическое нарушение потребления. ДВС возникает при заболеваниях, способствующих выделению в кровообращение прокоагулянтов, которые вызывают распространенное поражение эндотелия или стимулируют тромбоциты/макрофаги. Острое ДВС наблюдается при состояниях, представленных в табл. 6-11. ДВС может бытьхроническим или локальным.
Основные пути патогенеза ДВС (рис. 6-26):
1.Повреждение тканей. Поступление прокоагулянтов (например, тканевого фактора) в кровообращение вызывает активацию системы свертывания крови прежде всего за счет активации CDVII. Этот вид повреждений наблю даетсяприакушерскихосложнениях, злокачественных заболеваниях, после
травмы, хирургических вмешательств, принекрозепечени, внутрисосудистом гемолизе, укусах некоторых змей и ряде инфекций (малярии).
2.Повреждение эндотелия способствует обнажению коллагена в субэндотелиальной зоне, что активирует факторы свертывания контактной фазы, атакжетромбоцитыиприводиткизбыточномуобразованиютромбина. Ме няются физиологические свойства эндотелия (в основном, от антикоагулянтных к сильным прокоагулянтным), что сопровождается непрерывной активацией свертывания крови. Обширное повреждение эндотелия может быть вызвано бактериями и продуктами их жизнедеятельности (эндотокси ном; грамотрицательными бактериями, включая менингококки; грамположительными бактериями), некоторыми вирусными инфекциями (вирусом герпеса, который вызывает фульминантную пурпуру), тяжелыми ожогами, острым поражением легких, нарушениями обмена веществ.
