
3 курс / Патологическая физиология / Патофизиология_крови,_Фред_Дж_Шиффман
.pdf
Аллогеннаятрансплантация |
309 |
|
|
|
|
риферической крови (КППК), полученных от здоровых доноров-сибсов, которым вводился Г-КСФ. Их результаты обнадеживают.
Третий потенциальный источник СГК — пуповинная кровь, содержащая, как представляется, большую концентрацию примитивных клеток, чем костный мозг. До 250 мл крови можно получить при родах без ущерба для матери или новорожденного. Создание банков пуповинной крови расширяет возможности неродственной аллогенной трансплантации, правда, собираемая кровь может не содержать необходимого для взрослых реципиентовколичества СГК.
Процедура трансплантации заключается в инфузии клеточного концентрата через широкий в/в катетер. Даже медики бывают удивлены, узнав, что клетки практически не вводятся повторно в костномозговые полости и что трансплантации костного мозга выполняются врачами-интернами или педиатрами, которые специализировались по гематологии или онкологии, а не хирургами. Раствор ди-.метилсульфоксида (ДМСО), используемый для криоконсервации аутологичногоКМилиКППК, можетнемедленновызыватьумереннуюлегочную и системные токсические реакции, тогда как реинфузии свежих аллогенных компонентов не имеют таких последствий. Механизмы "хоуминга" (миграции) СГК в полости костного мозга пока плохо изучены, но известно, что в течение 10-25 дней начинается продукция первых нейтрофилов, затем тромбоцитов и эритроцитов. Эти процессы подтверждают приживление донорских стволовых клеток.
Аллогенная трансплантация
Обзор
Перечень приобретенных и генетических болезней, при которых используется аллогенная трансплантация, все возрастает (табл. 8-1). Из-за высокой заболеваемости и смертности, наблюдаемой при этом виде лечения, большинство трансплантаций проводится пациентам с приобретенными гематологическими заболеваниями, угрожающими жизни, прежде всего лейкозами или апластической
ТАБЛИЦА 8-1. Применение аллогенной трансплантации
Приобретенные болезни Острый миелолейкоз Хронический миелолейкоз Апластическая анемия
Миелодиспластический синдром Множественная миелома1 Острый лимфобластный лейкоз взрослых1 Лимфома1 Генетические болезни Талассемия
Врожденные иммунодефицитные состояния Анемия Фанкони Серповидно-клеточная анемия1 Болезни накопления1
1 В настоящее время показания к проведению аллогенной трансплантации точно не определены.
310 |
Глава 8. Трансплантация стволовых |
|
клеток |
анемией. Но поскольку и заболеваемость, и смертность при трансплантации постепенно снижаются, данная процедура становится все более обычной для пациентов с хронической несмертельной врожденной патологией, например серпо- видно-клеточной анемией. К потенциальным преимуществам аллогенной трансплантации по сравнению с аутологичной при злокачественных новообразованиях относят обеспечение реципиента гемопоэтическими стволовыми клетками от здорового донора, что уменьшает риск реинфузии жизнеспособных опухолевых клеток, которые способствуют возникновению рецидива заболевания. При некоторых опухолях, особенно хроническом миелолейкозе, чрезвычайно важно иммунологическое противоопухолевое действие донорских клеток.
Выбор донора
Совместимость по белкам (антигенам) главного комплекса гистосовместимости (ГКГ) — основа для выбора подходящего аллогенного донора. У человека эти антигены называются системой человеческих лейкоцитарных антигенов (human leukocyte antigens — HLA). Они представлены фактически на всех ядросодержа-щих клетках в организме. Эти белки связывают и презентируют пептиды других белков Т-клеткам; ГКГ-зависимые взаимодействия являются центральными почти во всех типах иммунных реакций (глава 4). Чужеродные HLA-белки распознаются и могут вызывать мощный иммунный ответ. При аллогенной трансплантации эффекторное звено иммунной системы (Т- и В-клетки) замещается клетками донора. Это же относится к моноцитам и макрофагам, которые являются важными в презентации чужеродных антигенов лимфоидным клеткам. Наличие общих HLA-антигенов у донора и реципиента уменьшает риск немедленного отторжения трансплантата лимфоцитами реципиента, а также риск распознавания и "нападения" на ткани реципиента (хозяина) лимфоцитами, полученными от донора. Последний процесс называют болезнью "трансплантат против хозяина".
Наиболее часто аллогенными донорами становятся HLA-совместимые сибсы. Таковыми считаются сибсы, имеющие одинаковые HLA-антигены I класса А, В и С, а также HLA-антигены II класса DR, DQ и DP. Так как все гены HLA-белков локализованы на коротком плече 6-й хромосомы и каждый сибс получает по одной хромосоме (гаплотип) с комплексом HLA-генов от каждого родителя, сибсы будут HLA-идентичными с 25 % вероятностью. Трансплантат от полностью HLA-совместимого сибса имеет очень низкий риск отторжения, однако может развиться БТПХ из-за различий между донором и реципиентом по недостаточноизученныммалымантигенамгистосовместимости, ненайденнымна 6-й хромосоме. При сингенных трансплантациях, когда донор и реципиент являются однояйцовыми близнецами, не существует угрозы отторжения трансплантата или возникновения БТПХ.
Только 25-30 % пациентов, нуждающихся в аллогенной трансплантации, имеютHLA-идентичныхсибсов. Уостальныхпациентовиспользуюттрансплантат от частично совместимого родителя, иного родственника или HLA-совместимого неродственного донора, соотнося риск развития БТПХ и других посттрансплантационных осложнений с потенциальными выгодами от проведения ТКМ. За последние 10 лет были созданы большие регистры HLA-типированных лиц, желающих пожертвовать свой костный мозг для неродственных реципиентов, что позволяет значительно увеличить количество трансплантаций от совместимых
Аллогенная трансплантация |
311 |
неродственных доноров (СНД). В США внедрение национальной программы донорства костного мозга позволило накопить сведения более чем об 1 млн потенциальных доноров. К сожалению, только 60 % пациентов находят совместимые пары через регистры. Иногда на поиски донора уходит 3-6 месяцев, из-за чего трансплантация становится невозможной. Особенно трудно найти донора для пациентов-неевропеоидов из-за низкого представительства некоторых этнических групп в регистрах и их существенного генетического многообразия. Долгосрочная выживаемость после трансплантаций от СНД или частично совместимых родствен* ников по сравнению с трансплантациями от совместимых сибсов значительно ниже вследствие более высокой встречаемости отторжения трансплантата, развития инфекций и БТПХ, особенно у взрослых пациентов.
Подготовка к трансплантации
Как только показания для аллогенной трансплантации установлены и найден подходящий донор, начинается предоперационная подготовка пациента. Ее цели зависят от основного заболевания. Однако в любом случае режим подготовки (кондиционирования) должен так супрессировать иммунитет реципиента, чтобы предотвратить отторжение аллотрансплантата, а также подавить костный мозг реципиента, что позволит прижиться стволовым клеткам донора. При наличии злокачественных новообразований нужно обеспечить максимальное уничтожение клеток опухоли при ограниченной токсичности по отношению к другим органам (не костному мозгу). При доброкачественных заболеваниях для иммуносуп-рессии используют циклофосфамид в сочетании с антитимоцитарным глобулином, общее облучение лимфоидной ткани или комбинацию сравнительно низкой дозы бусульфана для миелосупрессии и циклофосфамида для иммуно-супрессии. Такие режимы относительно безопасны для больных талассемией и апластической анемией (при использовании полностью совместимого донора-сибса смертность, связанная с трансплантацией, составляету молодыхпациентовтолько 5-15 %).
При подготовке к трансплантации пациентов со злокачественными новообра-юваниями обычно используется общее облучение тела в комбинации с приемом цитотоксического агента (или агентов). Положительные эффекты данной процедуры обусловлены антинеопластическим воздействием на организм в целом и сильной миело- и иммуносупрессией. Циклофосфамид — лекарственный препарат, наиболее часто назначаемый при общем облучении тела. Для усиления противоопухолевого действия применяют также этопозид, цитозинарабинозид и мелфалан. Комбинации циклофосфамида и бусульфана могутслужить альтернативой схемам, включающим общееоблучение тела.
Получение стволовых клеток донора и трансплантация
Для успешного и длительного приживления необходимо адекватное количество СГК. Трансплантаты, содержащиеоченьбольшоеколичествотакихCD34+ клеток, имеют более низкую частоту отторжения трансплантата и развития ранних посттрансплантационных инфекционных осложнений. Процедура взятия костного мозга безопасна, частота осложнений у здоровых доноров не превышает 0,1 % (их возникновение обычно связано с последствиями общей анестезии).

312 |
Глава 8. Трансплантация стволовых клето |
|
|
|
|
Доноры госпитализируются в большинстве случаев на 1 сутки после процедуры,' а возвращение к нормальному образу жизни и плановой работе происходит в течение 1-2 недель. В настоящее время в аллогенных трансплантациях п] мущественноиспользуюткостныймозгдоноракакисточник для СГК, но в перс-| пективе, вероятно, его заменят трансплантаты донорских КППК. Для по; чения КППК донорам вводят Г-КСФ или другие цитокины подкожно в течение' 4-6 дней, после чего клетки периферической крови собирают путем афереза, что позволяет получить для трансплантации клеток CD34+ в 3-10 раз больше, чем из костного мозга. Увеличивается также частота трансплантаций пуповинной крови; ее банки могут оказаться ценным источником неродственных донорских стволовых клеток, если будет доказано, чтоэтитрансплантациибезопасныиэффективны для взрослых и детей.
Техника аллогенной трансплантации
Ранее аллогенные трансплантации выполнялись методом инфузии в периферическуювенунеобработанногокостногомозга, которыйвпоследствиисталифильтроватьдляпрофилактикитромботическихосложнений, вызываемыхкрупными частицами. Поскольку показаниядляаллогенныхтрансплантацийрасширяютсяи увеличивается риск возникновения осложнений, становится общепринятым дотрансплантационноеманипулированиестрансплантатом. Принесовместимости эритроцитов донора и реципиента из трансплантата удаляются донорские эритроциты и/или сыворотка, чтобы предотвратить непосредственный лизис эритроцитовдонораилиреципиентаизогемагглютининами. Т-клеточноеистоще- ниекостногомозгауменьшаетчастотуразвитияБТПХ, ноегоприменениеимеет некоторые ограничения. Когда используется костный мозг, обедненный Т-лим фоцитами, нарушение функции трансплантата или его отторжение происходят чаще. Из-заотсроченногоиммунного восстановлениячащеразвиваютсяинфекционныеосложнения, например цитомегаловируснаяболезнь. Крометого, стара ясьуменьшить риск возникновения БТПХ, можно свести нанетэффект "трансплантат против лейкоза" (ТПЛ), что приведет кувеличению частоты рецидивов лейкозного процесса, особенно при миелолейкозах. Для преодоления этих проблем активно испытываются такиеусовершенствования, как определение оптимальной степени истощения Т-клеток или возврат Т-клеток после приживления трансплантатаивосстановленияорганизмапослеиммуносупрессии. Уменьшить вероятность развития БТПХ без отмены эффекта ТПЛ может также истощение отдельныхсубпопуляцийТ-клеток, напримерCD8+, нонеCD4+. Упациентовс доброкачественными заболеваниями истощение Т-клеток, предотвращающее отторжениетрансплантата, становитсявсеболеепредпочтительнымприиспользовании адекватного кондиционирования.
График проведения трансплантации
Материалы этого раздела могут служить руководством по ведению пациентов, подвергающихся трансплантации. В нем хронологически изложена последовательность ожидаемых событий и осложнений, связанных с этой процедурой (рис. 8-1). День 0 всегда определяется вливанием аутологичных или аллогенных СГК пациенту. До приживления характер (виды) осложнений у пациентов пр,и
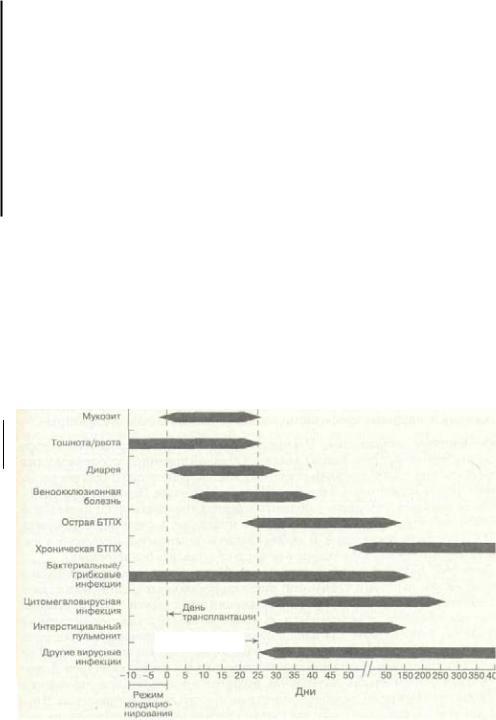
Аллогенная трансплантация |
313 |
аутологичных и аллогенных трансплантациях очень сходен. После приживления реципиенты аутологичного трансплантата имеют меньше проблем, и последующиеразделы касаются только реципиентов аллогенного трансплантата.
От подготовительной терапии к приживлению
Профилактика инфекции. С момента начала подготовительной терапии наиболее частыми являются инфекционные осложнения. Количество лейкоцитов в крови приближается к самому низкому уровню в день 0 или вскоре после него, поэтому данный период рассматривается как критический по восприимчивости к бактериальным и грибковым инфекциям. Даже при нормализации количества пейтрофилов пациенты имеют глубокую иммунодепрессию, особенно после алло-генной трансплантации. В некоторых случаях назначение антибиотиков и асептика окружающей среды эффективно уменьшают частоту развития инфекционных осложнений. Боксы, оборудованные вентиляционными фильтрами с повышенным давлением и ламинарным током воздуха, теперь имеются в большинстве отделений трансплантации. Они эффективны для удаления большинства переносимых воздухом бактериальных частиц игрибковых спор.
В качестве антибактериальных профилактических средств обычно используют литеральные фторхинолоны. Плохо адсорбируемый хинолон норфлоксацин можно назначать для деконтаминации кишечника. В основе профилактики грибко-
Приблизительно день приживления
Рис. 8-1. Время появления осложнений при трансплантации стволовых клеток. До приживления у пациентов, подвергающихся аутологичиой и аллогенной трансплантации, осложнения сходны. После приживления осложнения в основном проявляются у реципиентов аллогенных трансплантатов. Полосы ограничивают периоды возникновения каждого осложнения (усредненные данные). Пациенты с тяжелой болезнью "трансплантат против хозяина" имеют намного более длительную иммуиосупрессию, у них иногда развиваются серьезные бактериальные, грибковые и вирусные инфекции даже после периода наибольшего риска, показанного на рисунке
314 |
Глава 8. Трансплантация стволовых |
|
клеток |
выхинфекцийлежиттерапияфлуконазолом. Показанаэффективность флукона-золавуменьшении риска возникновения как инвазивных, так и поверхностных кандидозов. Однако Aspergillus и некоторые стойкие штаммы Candida нечувствительныкнемуипо-прежнемувызываютосложнения. В большинствемедицинских центровпрекращаютбактериальнуюигрибковую профилактикупослеприживлениянейтрофильногоростка. Реципиентампри аллогенныхиаутологичныхтрансплантациях в течение 3 месяцев или длительнее проводится также профилактика инфекций, вызываемых Pneumocystis carinii. Используется или триметоп-рим-сульфаметоксазол перорально 1 раз в неделю, или аэрозоль пентамидина ежемесячно. Антивирусныемероприятиянаправленынавирусыгруппыгерпеса: вирус простого герпеса (ВПГ), вирус Varicella zoster и цитомегаловирус (ЦМВ). Реактивация ВПГ и V. zoster предотвращается внутривенным введением низкой дозыацикловира. ОптимальныйрежимпрофилактикиЦМВвсеещев процессеразработки. Еслиидонор, иреципиентЦМВ-серонегативны, необходимо предотвратить развитие первичной инфекции, для чего используют ЦМВ-негативные или профильтрованные компоненты крови. Серопозитивным реципиентам для предупрежденияреактивацииназначаютацикловирввысокой дозе. Крометого, доказано, чтопрофилактику ЦМВможнообеспечить еженедельным внутривеннымвведениему-глобулинакаксеропозитивным пациентам, такисеронегатив-ным, получившимтрансплантатотсеропозитивного донора. Упациентовсвысоким риском развития ЦМВ-инфекции рассматривалась также возможность применения ганцикловира, хотя наличие у него миелосупрессивного действия препятствует широкому профилактическому использованию этого препарата.
Инфекционные осложнения. Несмотря на оптимальные профилактические меры, инфекционные осложнения являются главной причиной заболеваемости и смертности при трансплантации стволовых клеток. Клиницисты обычно расценивают лихорадку как первый признак развития инфекции. Вероятно, значительная доля эпизодов лихорадки у больных в период трансплантации является не результатом активной или распознаваемой инфекции, а следствием мукозита, БТПХ или других воспалений. В любом случае возникновение лихорадки у им-мунокомпрометированного пациента не следует оставлять без внимания.
Бактерии. Бактериальные инфекции преобладают в дотрансплантационном периоде нетолько потому, что пациент имеет глубокуюнейтропению, но ивсвязи с появлением новых входных ворот для инфекции при поражении кожи, мембран слизистых оболочек и поверхности ЖКТ из-за воздействия лекарственных препаратов, применяемых для кондиционирования. Бактериемия наблюдается у 15-50 % пациентов. Источник ее, как правило, эндогенный, происходящий из желудочно-кишечного тракта или от установленных постоянно катетеров. Доминирует грамположительная бактериемия, вероятно, в результате использования в профилактических целях антибиотиков с грамотрицательной активностью. В некоторых центрах пациенту сразу, как только у него развивается нейтропения, назначаютцефтазидимиливводятвнутривенноинойантибиотикширокогоспектра действия, тогда как в других лечение начинают лишь при первых признаках лихорадки. При возникновении нейтропенической лихорадки часто также назначают ванкомицин.
Иные распространенные локализации бактериальной инфекции в дотрансплантационном периоде — кожа, легкие, синусы и ЖКТ. Еженедельная скринин-

Аллогенная трансплантация |
315 |
говая рентгенография или компьютерная томография (КТ) грудной полости и синусовмогутбытьполезныдляраннегообнаруженияочаговинфекции. Тифлит
— скоротечная (молниеносная) некротизирующая инфекция стенки слепой кишки, вызываемая грамотрицательными микроорганизмами, разновидностями кандида и/или клостридий. Пациенты обычно жалуются на боль в животе, тошноту и рвоту. Если ультразвуковое исследование или КТ-сканирование позволяют предположить утолщение или воспаление кишечной стенки, может понадобиться хирургическое вмешательство. Смертность при тифлите составляет от 50 % до 100 %. Нередко возникает бактериальная пневмония, но типичные долевые (крупозные) инфильтраты встречаются очень редко. Диагностика диффузных инфильтратов вдотрансплантационном периодеможет быть затруднена, поскольку дифференциальный диагноз нужно проводить между перегрузкой жидкостью, легочным кровоизлиянием, ранними эффектами облучения и ЦМВ-пульмонитом. Пациентам с лихорадкой и легочным инфильтратом часто назначают эмпирическое лечение антибиотиками широкого спектрадействия, чтобыобеспечитьдвойнуюанти-грамотрицательнуютерапиюи антигрибковую защиту. Амфотерицин обычно вводят до получения результатов исследования бронхоальвеолярного лаважа, который в большинстве случаев бывает неинформативным.
Грибки. Почти у 30 % реципиентов в дотрансплантационном периоде развиваются грибковые инфекции. Чаще всего удается выделить разновидности Candida, прежде всего albicans, ш Aspergillus.
Идентифицировать грибковую инфекцию бывает трудно. Когда эпизоды возвратной лихорадки длятся более 3-7 дней, несмотря на применение антибиотиков широкого спектра действия, должна быть назначена эмпирическая антигрибковая терапия амфотерицином, даже у пациентов, уже получающих флуконазол профилактически. Кандидозы проявляются в виде эритематозных пятнистых кожных высыпаний, фунгемии или висцеральной инфекции. Повышеннаяактивностьпеченочныхферментов, особеннощелочнойфосфатазы, и типичные повреждения печени при КТили при магнитно-резонансном исследовании (МРИ) позволяют заподозрить развитие гепатоспленического кандидоза. Лечение инвазивных кандидозных инфекций в дотрансплантационном периоде относительно неэффективно, и персистирующая инфекция является очень плохим прогностическим признаком. Поверхностные инфекции слизистой оболочки полости рта и пищевода можно предотвратить, соблюдая правила гигиены ротовой полости, профилактическим приемом флуконазола и антигрибковых средств втаблетках, антисептическими полосканиями полости рта.
Пневмония, вызываемая Aspergillus pneumoniae,— наиболее частое и грозное грибковое осложнение. Причиной развития инфекции является ингаляция спор Aspergillus, которые попадают в воздух, ускользая от вентиляторных фильтров, или их предсуществующая колонизация у пациента. Aspergillus может также вызывать воспалительный процесс в синусах, коже или ЦНС. Диагностика аспер-гиллезной инфекции иногда достаточно трудна: характерныедлянееузелковыеилиполостныепроявленияи/илиспецифический ареол, который представляет собой зону размягчения окружающих легочных масс, определяемую при просмотре КТ, нередко отсутствуют. Единственное средство подтверждения диагноза — биопсия поврежденной ткани, но у компрометированных пациентов с низким количеством тромбоцитов проведение этой процедуры не всегда оправдано. Если есть серьезные основания подозревать аспергиллез, должно быть назначено лечение высокими дозами амфотерицина.
316 |
Глава 8. Трансплантация стволовых |
|
клеток |
Вирусные инфекции. В дотрансплантационном периоде вирусные инфекции развиваются реже, чем после трансплантации, по крайней мере, у реципиентов аллогенных трансплантатов. Реактивация вируса простого герпеса (ВПГ) происходит у 85 % пациентов, которым не назначался ацикловир с профилактической целью. Стоматиты с гингивитами — наиболее частое проявление ВПГ-1-инфекции, эти болезненные повреждения ограничивают прием пищи через рот. Они также являются входными воротами для бактериальной и грибковой суперинфекции. К другим потенциально опасным вирусным агентам относятся аденовирус и респираторно-синцитиальный вирус. Очень опасна также ранняя ЦМВ-инфекция или ее реактивация, но пик ее встречаемостиотмечаетсявпосттрансплантационном периоде.
Желудочно-кишечные осложнения. Химиотерапия высокими дозами препаратов, общее облучение тела и прием таких преператов, как имипенем, ганцикловир и амфотерицин, могут вызывать тяжелую тошноту и рвоту. Мукозит развивается через 5-14 дней после начала режима кондиционирования и связан с периодом глубокой нейтропении. Быстро делящиеся клетки, которые выстилают ЖКТ, повреждаются лекарственными средствами, используемыми в предоперационной подготовке, а последующая суперинфекция язв бактериями, грибками, ВПГ или ЦМВ усугубляет нарушение. Заживление этих повреждений происходит не ранее повышения уровня нейтрофилов. Клинические признаки включают боль, тошноту, рвоту и диарею. При очень тяжелых мукозитах не исключено поражение воздухоносных путей из-за слущивания эпителия и кровоизлияний в периларингеальной ткани. Любой пациент, у которого заподозрено развитие этого осложнения, должен быть помещен в стационар, где есть условия для немедленного выполнения трахеостомии. Адекватное обезболивание — наиболее важный компонент в лечении мукозитов; при прогрессировании симптомов от умеренных к тяжелым для пациента нужно подобрать индивидуальную дозу анальгетиков. Средства для полоскания полости рта, например хлоргексидины, способны уменьшить развитие суперинфекции и должны использоваться в период нейтропении. Поскольку прием пищи через рот затруднен из-за описанных вторичных осложнений, постояннорегулируется объем парентерального питания.
Воспаление и слущивание слизистой оболочки ЖКТ нарушает всасывание в толстом и тонком отделах кишечника. Хотя это наиболее частая причина возникновения диареи, клиницисты должны помнить, что одновременно могут развиваться и другие, более тяжелые, осложнения. Распространенной является инфекция Clostridium difficile, приводящая к псевдомембранозному колиту даже без длительного применения антибиотиков широкого спектра. Скрининг токсина Clostridium difficile выполняется при резком увеличении объема стула, особенно если он кровянистый и сопровождается лихорадкой.
Нарушения функции печени. В дотрансплантационном периоде всегда имеет место умеренное повышение активности ферментов печени и содержания билирубина. Причины его множественны: действие принимаемых лекарственных препаратов, общий холестаз, обусловленный парентеральным питанием, инфекции. Более серьезной является печеночная веноокклюзионная болезнь, часто заканчивающаяся смертью во время кондиционирования. Она встречается у 10— 20 % реципиентов аллогенных и аутологичных трансплантатов. Триада симптомов веноокклюзионной болезни, обычно развивающихся в период от 7 до

Аллогеннаятрансплантация |
317 |
|
|
|
|
14 суток, включает гепатомегалию, желтуху и асцит или необъяснимое увеличение массы тела. Кроме того, есть сведения о возникновении боли в правомверхнемквадрантеживота, напоминающейтаковуюпри"остромживоте". Тяжесть симптомов варьируется. Веноокклюзионную болезнь нужно дифференцировать от БТПХ либо гепатита, обусловленного инфекцией или действием принимаемых лекарственных препаратов. Увеличение уровня билирубинаприотсутствиизначительногоповышенияактивноститрансаминази щелочной фосфатазы позволяет отличить ранние стадии заболевания от этих и других осложнений. При необходимости для подтверждения диагноза может выполняться трансвенозное измерение давления в печеночной вене или трансвенозная биопсия печени, но на практике эти процедуры проводятся редко. Хотя патогенез веноокклюзионной болезни неясен, при гистологическом исследовании всегда отмечают повреждение эндотелия венул печени и тромбоз. Выявляются снижение уровня эндогенных антикоагулянтов, например протеина С, и- изменения количественных соотношений мультимеров фактора Виллебранда (глава 6). Большинство этих нарушений, по-видимому, вторичны по отношению к повреждению печени.
Лечение веноокклюзионной болезни, за исключением поддерживающей терапии, не стандартизовано. Пациентам с подозрением на данное заболевание необходимо следить за массой тела и, по возможности, не допускать ее увеличения, ограничивая потребление натрия и жидкости или применяя форсированный диурез. В некоторых исследованиях была показана целесообразность использования антикоагулянтов или пополнения резервов эндогенных антикоагулянтов, однако полученные результаты противоречивы, тем более что существует очевидный риск при назначении антикоагулянтов этим пациентам. Смертность по разным сообщениям достигает 50 %, но фактически может быть ниже, так как многие умеренно выраженные случаи скорее всего не учитывались. Плохой прогноз связан с развитием полиорганной недостаточности, особенно гепаторенального синдрома. Развитие веноокклюзионной болезни более вероятно при очень интенсивных режимах кондиционирования, у реципиентов пожилого возраста, а также при наличии дотрансплантационных повреждений печени любой этиологии.
Поддерживающая терапия. Переливание компонентов крови до периода приживления неизбежно. В среднем реципиенту аллогенного трансплантата требуется до 10-15 доз эритроцитсодержащих компонентов и до 150 доз тромбоцитов. Реципиенты аутологичного трансплантата обычно менее зависимы от поддержки компонентамикрови. Из-заглубокойиммуносупрессиидолжныпредприниматься шаги для предотвращения посттрансфузионной БТПХ. Этот вид БТПХ развивается, когда жизнеспособные лимфоциты в компонентах крови реагируют с антигенами реципиента. Фильтры, удаляющие до 99 % лейкоцитов, и облучение гемокомпонентов инактивируют остающиеся лейкоциты. Если и донор КМ, и реципиент ЦМВ-негативны, необходимо предотвратить первичное ЦМВ-инфици-оование через компоненты крови путем фильтрации через лейкоцитарные фильтры. Стандартной практикой в большинстве трансплантационных центров !вляется обеспечение уровня гемоглобина от 80
до 100 г/л.
У многих реципиентов затруднена поддержка тромбоцитоконцентратами из-за ^трансплантационной аллосенсибилизации, развившейся после предшествую-цих трансфузий. В отличие от эритроцитов тромбоциты несут на себе HLA-анти-ены I класса и являются чрезвычайно иммуногенными. Переливание по крайней

318 |
Глава 8. Трансплантация стволовых клеток |
|
|
|
|
мере частично HLA-совместимых тромбоцитов способно решить проблему увеличения их количества у реципиента. Рефрактерность к тромбоцитам может быть обусловлена также гиперспленизмом, лихорадкой и сепсисом. Считается, что у пациентов с уровнем тромбоцитов менее 5000/мкл повышен риск развития спонтанных кровотечений. Клиническая практика свидетельствует, что содержание тромбоцитов менее 5000/мкл является показанием для переливания. Активное кровотечение, лихорадка или использование инвазивных методов мониторинга — серьезные основания для повышения количества тромбоцитов.
Использование мобилизованных периферических клеток крови вместо костного мозга при аутологичных трансплантациях сокращает время приживления настолько, что лечение цитокинами (Г-КСФ или ГМ-КСФ), стимулирующими миелопоэз, не приводит к его дальнейшему уменьшению. Продолжающиеся исследования результатов применения новых цитокинов, таких как тромбопоэтин и интерлейкин-11, позволят установить их роль в ускорении восстановления тромбоцитов. Пока не разработаны общие принципы использования гемопоэти-ческих факторов роста (ГФР) после аллогенных трансплантаций. Очевидно, что высокое содержание эндогенных факторов роста в течение дотрансплантацион-ного периода прогностически благоприятно. Некоторые клиницисты настороженно относятся к использованию ГФР у пациентов с миелолейкозами из-за теоретической возможности стимуляции злокачественного клона, однако на практике не зарегистрировано увеличения частоты рецидивов миелолейкоза при использовании ГФР. Несмотря на сомнительную эффективность применения ГФР в раннем посттрансплантационном периоде, их назначение в ситуации отсроченного приживления общепринято.
Приживление. Существуют большие индивидуальные различия по времени приживления трансплантатов, но признаки донорского гемопоэза у реципиентов после аллогенных трансплантаций костного мозга обычно замечают на 12-23 сутки. При аутологичных трансплантациях КППК восстановление нейтрофилов в периферической крови реципиентов может происходить уже на 7-9 сутки. Первымиобычнопоявляютсявпериферическойкровимоноцитыиз восстановленного костного мозга, потом нейтрофилы, а затем тромбоциты и эритроциты.
Возможных причин отсроченного приживления много. Среди них отторжение трансплантата у аллогенных реципиентов и низкое число СГК в донорском или аутологичном трансплантате. Т-клеточное истощение, элиминация опухолевых клеток, подавление инфекций или медикаментозная супрессия костного мозга такими препаратами, как ганцикловир, также могут задерживать или угнетать приживление. Гемопоэтические цитокины, по-видимому, способны ускорять восстановление, но в некоторых случаях необходима повторная трансплантация либо донорских КППК, либо дополнительного количества костного мозга.
Приживление через 100 дней
Остраяболезнь"трансплантатпротивхозяина"
Патофизиология. Когда иммунокомпетентные Т-лимфоциты, полученные отдонора, реагируютпротивантигенов, экспрессированныхнатканяхреципиента, развивается БТПХ. Сроки возникновения и клиническая картина БТПХ достаточно вариабельны и зависят от многих факторов, часть из которых еще плохо изучена. Совокупность признаков и симптомов, обычно отмечаемых в первые
