
- •СОВРЕМЕННАЯ ПЛАСТИЧЕСКАЯ ХИРУРГИЯ И ЕЕ ИСТОРИЯ
- •1.3. СОВРЕМЕННАЯ ПЛАСТИЧЕСКАЯ ХИРУРГИЯ
- •2.2. КРОВОСНАБЖЕНИЕ ПОКРОВНЫХ ТКАНЕЙ
- •2.2.1. СОСУДИСТЫЕ СПЛЕТЕНИЯ ПОКРОВНЫХ ТКАНЕЙ
- •2.3. КРОВОСНАБЖЕНИЕ МЫШЦ
- •2.3.1. ОБЩАЯ ХАРАКТЕРИСТИКА
- •2.4. КРОВОСНАБЖЕНИЕ КОСТЕЙ
- •2.4.1. ОБЩАЯ ХАРАКТЕРИСТИКА
- •2.5. КРОВОСНАБЖЕНИЕ НЕРВОВ
- •2.5.1. ВНЕШНЯЯ СОСУДИСТАЯ СЕТЬ НЕРВА
- •2.5.2. ВНУТРИСТВОЛЬНАЯ СОСУДИСТАЯ СЕТЬ
- •2.6. КРОВОСНАБЖЕНИЕ СУХОЖИЛИЙ
- •2.6.1. КРОВОСНАБЖЕНИЕ СУХОЖИЛИЙ ВНЕ СИНОВИАЛЬНЫХ КАНАЛОВ
- •2.6.2. КРОВОСНАБЖЕНИЕ СУХОЖИЛИЙ В ПРЕДЕЛАХ СИНОВИАЛЬНЫХ КАНАЛОВ
- •КЛАССИФИКАЦИЯ ЛОСКУТОВ, МЕТОДЫ ИХ ИСПОЛЬЗОВАНИЯ И ФУНКЦИЯ
- •3.1.1. ПРОСТЫЕ ЛОСКУТЫ
- •3.1.2. СЛОЖНЫЕ ЛОСКУТЫ
- •3.2. ДЕЛЕНИЕ ЛОСКУТОВ ПО ТИПУ КРОВОСНАБЖЕНИЯ
- •3.7. ДЕЛЕНИЕ НЕСВОБОДНЫХ ЛОСКУТОВ ПО ФОРМЕ ИХ НОЖКИ
- •ИССЛЕДОВАНИЕ КРОВООБРАЩЕНИЯ В ЛОСКУТАХ
- •4.1. ПРЕДОПЕРАЦИОННОЕ ИССЛЕДОВАНИЕ ЛОСКУТОВ
- •4.1.1. ВЫБОР ДОНОРСКОЙ ЗОНЫ
- •4.2. ИНТРАОПЕРАЦИОННОЕ ИССЛЕДОВАНИЕ ЛОСКУТОВ
- •4.3. ПОСЛЕОПЕРАЦИОННОЕ ИССЛЕДОВАНИЕ ЛОСКУТОВ
- •КРОВООБРАЩЕНИЕ В СЛОЖНЫХ ЛОСКУТАХ И ЗАКОНОМЕРНОСТИ ЕГО ИЗМЕНЕНИЙ
- •5.4. ПЕРИФЕРИЧЕСКАЯ НЕОСЕВАЯ РЕВАСКУЛЯРИЗАЦИЯ ЛОСКУТОВ И МЕТОДЫ ЕЕ УСКОРЕНИЯ
- •КРОВООБРАЩЕНИЕ ПРИ АТИПИЧНЫХ ВАРИАНТАХ ВКЛЮЧЕНИЯ ТКАНЕЙ В КРОВОТОК
- •6.1. ОБЩИЕ ПОЛОЖЕНИЯ
- •6.4.2. АРТЕРИАЛИЗАЦИЯ ВЕНОЗНОГО РУСЛА СО СБРОСОМ КРОВИ В РЕЦИПИЕНТНУЮ АРТЕРИЮ
- •ОСТРАЯ ИШЕМИЯ И ВЫЖИВАЕМОСТЬ ТКАНЕЙ
- •7.2.1. ПРЕДЕЛЫ ПЕРЕНОСИМОСТИ ГИПОКСИИ
- •7.4. ПРОФИЛАКТИКА И ЛЕЧЕНИЕ ИШЕМИЧЕСКИХ РЕПЕРФУЗИОННЫХ ПОРАЖЕНИЙ ТКАНЕЙ
- •7.4.1 ПРОФИЛАКТИКА
- •7.4.2. ЛЕЧЕНИЕ
- •РЕИННЕРВАЦИЯ ПЕРЕСАЖЕННЫХ ТКАНЕЙ
- •8.1. ПРОБЛЕМА РЕИННЕРВАЦИИ ТКАНЕЙ В ПЛАСТИЧЕСКОЙ ХИРУРГИИ
- •8.2.1. СПОНТАННАЯ РЕИННЕРВАЦИЯ ТКАНЕЙ
- •8.2.2. НАПРАВЛЕННАЯ РЕИННЕРВАЦИЯ ТКАНЕЙ
- •8.3. ХИРУРГИЧЕСКИЕ МЕТОДЫ НАПРАВЛЕННОЙ РЕИННЕРВАЦИИ ТКАНЕЙ
- •ОБЩАЯ И МИКРОХИРУРГИЧЕСКАЯ ТЕХНИКА ПЛАСТИЧЕСКИХ ОПЕРАЦИЙ
- •9.2. ОБЩАЯ ХИРУРГИЧЕСКАЯ ТЕХНИКА
- •9.3. МИКРОХИРУРГИЧЕСКАЯ ТЕХНИКА
- •10.1. ОБЩАЯ ХАРАКТЕРИСТИКА МЕТОДА
- •10.3. ПЛАНИРОВАНИЕ ОПЕРАЦИЙ
- •10.2. ПОКАЗАНИЯ К ОПЕРАЦИЯМ
- •10.4. ОБЩАЯ ТЕХНИКА ОПЕРАЦИЙ
- •10.5. ПРОБЛЕМА ПРОХОДИМОСТИ МИКРОСОСУДИСТЫХ АНАСТОМОЗОВ И АНТИКОАГУЛЯНТНАЯ ТЕРАПИЯ
- •10.5.1. КАЧЕСТВО СОСУДИСТОГО ШВА
- •10.5.2. НАРУШЕНИЯ ГЕМОДИНАМИКИ В ЗОНЕ МИКРОСОСУДИСТОГО АНАСТОМОЗА
- •10.5.3. НАРУШЕНИЯ СВЕРТЫВАЮЩЕЙ СИСТЕМЫ КРОВИ И АНТИКОАГУЛЯНТНАЯ ТЕРАПИЯ
- •10.6. ОЦЕНКА РЕЗУЛЬТАТОВ ОПЕРАЦИЙ
- •11.2. ПЕРЕСАДКА ОСТРОВКОВЫХ МОНОЛОСКУТОВ
- •11.3. ПЕРЕСАДКА ПОЛИКОМПЛЕКСОВ ТКАНЕЙ
- •11.4. ПЕРЕСАДКА МЕГАКОМПЛЕКСОВ ТКАНЕЙ
- •11.5. ДВОЙНЫЕ ПЕРЕСАДКИ КОМПЛЕКСОВ ТКАНЕЙ
- •11.6. ВРЕМЕННЫЕ ЭКТОПИЧЕСКИЕ ПЕРЕСАДКИ КОМПЛЕКСОВ ТКАНЕЙ
- •12.2.1. ОСНОВНЫЕ ВИДЫ РАН
- •12.2.2. ТИПЫ ЗАЖИВЛЕНИЯ РАН
- •12.3.1. ОБЩИЕ ФАКТОРЫ
- •12.3.2. МЕСТНЫЕ ФАКТОРЫ
- •12.4. КАКИМ БУДЕТ ЗАЖИВЛЕНИЕ РАНЫ? ПРОГНОСТИЧЕСКАЯ ОЦЕНКА ИСХОДНЫХ УСЛОВИЙ
- •12.4.1. ИДЕАЛЬНЫЕ УСЛОВИЯ ДЛЯ ЗАКРЫТИЯ РАН
- •12.5.1. ПРИНЦИПЫ ЗАКРЫТИЯ РАН
- •12.5.2. ЗАКРЫТИЕ РАН В ИДЕАЛЬНЫХ УСЛОВИЯХ
- •12.5.3. ЗАКРЫТИЕ РАН В БЛАГОПРИЯТНЫХ УСЛОВИЯХ
- •12.6.1. ОБЩАЯ ХАРАКТЕРИСТИКА
- •12.6.2. СПОСОБЫ НАЛОЖЕНИЯ ШВОВ НА КОЖУ
- •13.7. КОСТНАЯ АЛЛОПЛАСТИКА
- •13.8. НЕКОТОРЫЕ ДРУГИЕ ВИДЫ КОСТНО-ПЛАСТИЧЕСКИХ ОПЕРАЦИЙ
- •ПЛАСТИКА СУХОЖИЛИЙ
- •14.1. КЛИНИКО-МОРФОЛОГИЧЕСКИЕ АСПЕКТЫ РЕГЕНЕРАЦИИ СУХОЖИЛИЙ
- •14.2. ВИДЫ ПЛАСТИЧЕСКИХ ОПЕРАЦИЙ НА СУХОЖИЛИЯХ
- •14.4. ВИДЫ И СПОСОБЫ НАЛОЖЕНИЯ СУХОЖИЛЬНОГО ШВА
- •14.5. ИСТОЧНИКИ СУХОЖИЛЬНЫХ ТРАНСПЛАНТАТОВ
- •14.6. АУТОПЛАСТИКА СУХОЖИЛИЙ
- •ПЛАСТИКА ДЕФЕКТОВ МЫШЦ
- •15.2. ПЛАСТИЧЕСКИЕ ОПЕРАЦИИ ПРИ ДЕФЕКТАХ МЫШЦ
- •15.3. СВОБОДНАЯ ПЕРЕСАДКА МЫШЦ
- •ПЛАСТИКА ДЕФЕКТОВ НЕРВОВ
- •16.4.2. ТЕХНИКА ОПЕРАЦИЙ
- •16.4.3. ЧАСТИЧНЫЕ ПОВРЕЖДЕНИЯ НЕРВОВ
- •16.4.4. МИКРОХИРУРГИЧЕСКИЙ НЕВРОЛИЗ
- •16.5. ВИДЫ АУТОПЛАСТИКИ НЕРВОВ
- •16.7. ТЕХНИКА И ВАРИАНТЫ ПЕРЕСАДКИ КРОВОСНАБЖАЕМЫХ НЕВРАЛЬНЫХ ТРАНСПЛАНТАТОВ
- •16.8. ПЛАСТИЧЕСКИЕ ОПЕРАЦИИ ПРИ БОЛЕЗНЕННЫХ НЕВРОМАХ
- •ПЛАСТИКА ДЕФЕКТОВ СОСУДОВ
- •17.4. ПЛАСТИКА ДЕФЕКТОВ СОСУДОВ
- •18.2. ПАЛЬЦЕВЫЕ ЛОСКУТЫ
- •18.2.1. МИКРОСОСУДИСТАЯ АНАТОМИЯ
- •18.2.2. ПЕРЕКРЕСТНЫЙ ПАЛЬЦЕВОЙ ЛОСКУТ
- •18.2.3. ОСТРОВКОВЫЙ ПАЛЬЦЕВОЙ ЛОСКУТ
- •18.2.4. СВОБОДНЫЙ ПАЛЬЦЕВОЙ ЛОСКУТ
- •18.2.5. НЕСВОБОДНЫЙ ТЫЛЬНЫЙ ПАЛЬЦЕВОЙ ЛОСКУТ
- •18.2.6. ОБЩИЕ ПРЕИМУЩЕСТВА И НЕДОСТАТКИ ПАЛЬЦЕВЫХ ЛОСКУТОВ
- •18.3. ТЫЛЬНЫЕ МЕТАКАРПАЛЬНЫЕ ЛОСКУТЫ
- •18.3.1. ЛОСКУТЫ ИЗ БАССЕЙНА 1-й ТМА
- •18.3.2. ЛОСКУТЫ ИЗ БАССЕЙНА 2-й ТМА
- •18.3.3. ТЫЛЬНЫЕ МЕТАКАРПАЛЬНЫЕ ЛОСКУТЫ НА ПЕРИФЕРИЧЕСКОЙ СОСУДИСТОЙ НОЖКЕ
- •18.4. КОЖНЫЕ ЛОСКУТЫ ЛАДОННОЙ ПОВЕРХНОСТИ КИСТИ
- •18.5. МЫШЕЧНЫЕ ЛОСКУТЫ, ВКЛЮЧАЮЩИЕ ЧЕРВЕОБРАЗНЫЕ МЫШЦЫ
- •КОМПЛЕКСЫ ТКАНЕЙ ПРЕДПЛЕЧЬЯ
- •19.1. ОБЩИЕ АСПЕКТЫ СОСУДИСТОЙ АНАТОМИИ
- •19.3. ЛОСКУТЫ ИЗ БАССЕЙНА ЛОКТЕВОЙ АРТЕРИИ
- •19.4. ЛОСКУТЫ ИЗ БАССЕЙНА ЗАДНЕЙ МЕЖКОСТНОЙ АРТЕРИИ
- •19.6. ЛОСКУТЫ ИЗ БАССЕЙНА ВОЗВРАТНОЙ ЛОКТЕВОЙ АРТЕРИИ
- •19.7. ЛОСКУТЫ ИЗ БАССЕЙНА ЗАДНЕЙ ВЕТВИ ПЕРЕДНЕЙ МЕЖКОСТНОЙ АРТЕРИИ
- •19.9. НЕОСЕВЫЕ ЛОСКУТЫ ПРЕДПЛЕЧЬЯ
- •КОМПЛЕКСЫ ТКАНЕЙ ПЛЕЧА
- •20.1. ОБЩИЕ АСПЕКТЫ СОСУДИСТОЙ АНАТОМИИ
- •20.5. ЗАДНИЙ ЛОСКУТ ПЛЕЧА
- •20.6. ВНУТРЕННИЙ ПРОКСИМАЛЬНЫЙ ЛОСКУТ ПЛЕЧА
- •ЛОСКУТЫ ИЗ БАССЕЙНА ПОВЕРХНОСТНОЙ ВИСОЧНОЙ АРТЕРИИ
- •21.1. ОБЩАЯ И МИКРОХИРУРГИЧЕСКАЯ АНАТОМИЯ
- •21.2. ВЗЯТИЕ И ВАРИАНТЫ ПЕРЕСАДКИ
- •21.2.1. ФАСЦИАЛЬНЫЙ ВИСОЧНО-ТЕМЕННОЙ ЛОСКУТ
- •21.2.2. КОЖНО-ФАСЦИАЛЬНЫЕ ЛОСКУТЫ
- •КОМПЛЕКСЫ ТКАНЕЙ ГРУДНОЙ КЛЕТКИ
- •22.1. ОБЩИЕ АСПЕКТЫ СОСУДИСТОЙ АНАТОМИИ ГРУДНОЙ КЛЕТКИ
- •22.3. ЛОСКУТЫ ИЗ БАССЕЙНА ОГИБАЮЩЕЙ ЛОПАТКУ АРТЕРИИ (ОКОЛОЛОПАТОЧНЫЕ)
- •22.4. НАРУЖНЫЙ ЛОСКУТ ГРУДНОЙ КЛЕТКИ
- •22.6. ЛОСКУТЫ ИЗ БАССЕЙНА ГРУДОАКРОМИАЛЬНОЙ АРТЕРИИ (ГРУДНЫЕ ЛОСКУТЫ)
- •22.7. ЛОСКУТ, ВКЛЮЧАЮЩИЙ ПЕРЕДНЮЮ ЗУБЧАТУЮ МЫШЦУ
- •КОМПЛЕКСЫ ТКАНЕЙ ПЕРЕДНЕЙ БРЮШНОЙ СТЕНКИ
- •23.2. ЛОСКУТЫ ИЗ БАССЕЙНА НАДЧРЕВНОЙ ГЛУБОКОЙ ВЕРХНЕНИЖНЕЙ СОСУДИСТОЙ ОСИ
- •КОМПЛЕКСЫ ТКАНЕЙ ТАЗА И БЕДРА
- •24.1. ОБЩИЕ АСПЕКТЫ СОСУДИСТОЙ АНАТОМИИ
- •24.2. ПАХОВЫЕ ЛОСКУТЫ
- •24.2.1. ЛОСКУТЫ ИЗ БАССЕЙНА ПОВЕРХНОСТНОЙ ОГИБАЮЩЕЙ ПОДВЗДОШНУЮ КОСТЬ АРТЕРИИ
- •24.2.2. ПАХОВЫЕ ЛОСКУТЫ НА ГЛУБОКОЙ ОГИБАЮЩЕЙ ПОДВЗДОШНУЮ КОСТЬ АРТЕРИИ
- •24.2.3. ПАХОВЫЕ МЕГАЛОСКУТЫ, ВКЛЮЧАЮЩИЕ ОБЕ СОСУДИСТЫЕ СИСТЕМЫ (ПОА И ГОА)
- •24.3. ЛОСКУТЫ ИЗ БАССЕЙНА ВЕРХНЕЙ ЯГОДИЧНОЙ АРТЕРИИ
- •24.3.1. ЛОСКУТ, ВКЛЮЧАЮЩИЙ ПОДВЗДОШНЫЙ ГРЕБЕНЬ
- •24.4. ЛОСКУТЫ ИЗ БАССЕЙНА НИЖНЕЙ ЯГОДИЧНОЙ АРТЕРИИ
- •24.4.1. ЯГОДИЧНО-БЕДРЕННЫЙ КОЖНО-ФАСЦИАЛЬНЫЙ ЛОСКУТ
- •24.4.2. ЛОСКУТ ИЗ НИЖНЕЙ ПОРЦИИ БОЛЬШОЙ ЯГОДИЧНОЙ МЫШЦЫ
- •24.5. ПОЯСНИЧНО-КРЕСТЦОВЫЕ КОЖНО-ФАСЦИАЛЬНЫЕ ЛОСКУТЫ
- •24.5.1 ВЗЯТИЕ ЛОСКУТОВ ИЗ БАССЕЙНА ЗАДНЕЙ ВЕТВИ 4-й ПОЯСНИЧНОЙ АРТЕРИИ
- •24.6. МЫШЕЧНЫЕ ЛОСКУТЫ БЕДРА
- •24.7.1. ЛОСКУТЫ ИЗ БАССЕЙНА 1-й ПРОБОДАЮЩЕЙ АРТЕРИИ
- •24.7.2. ЛОСКУТЫ ИЗ БАССЕЙНА 2-й, 3-й и 4-й ПРОБОДАЮЩИХ АРТЕРИЙ
- •25.1. ОБЩИЕ АСПЕКТЫ СОСУДИСТОЙ АНАТОМИИ
- •25.3.1. МИКРОХИРУРГИЧЕСКАЯ АНАТОМИЯ
- •25.4. КОМПЛЕКСЫ ТКАНЕЙ ИЗ БАССЕЙНА ЗАДНЕЙ БОЛЬШЕБЕРЦОВОЙ АРТЕРИИ
- •25.4.1. КОЖНО-ФАСЦИАЛЫШЕ ЛОСКУТЫ
- •25.4.2. МЫШЕЧНЫЕ ЛОСКУТЫ
- •25.5. КОЖНО-ФАСЦИАЛЬНЫЕ ЛОСКУТЫ НА ПРЯМЫХ КОЖНЫХ ЗАДНИХ ВЕТВЯХ ПОДКОЛЕННЫХ СОСУДОВ И ИХ ВЕТВЕЙ
- •КОМПЛЕКСЫ ТКАНЕЙ СТОПЫ
- •26.1. ОБЩИЕ АСПЕКТЫ СОСУДИСТОЙ АНАТОМИИ
- •26.2. ЛОСКУТЫ ИЗ БАССЕЙНА ПОДОШВЕННЫХ АРТЕРИЙ
- •26.2.1. СРЕДИННЫЙ КОЖНО-ФАСЦИАЛЬНЫЙ ПОДОШВЕННЫЙ ЛОСКУТ
- •26.2.2. МЕДИАЛЬНЫЙ КОЖНО-ФАСЦИАЛЫШЙ ЛОСКУТ
- •26.2.3. СРЕДИННЫЙ НАДАПОНЕВРОТИЧЕСКИЙ ЛОСКУТ НА ШИРОКОМ ОСНОВАНИИ
- •26.2.4. ЛОСКУТ ИЗ МЫШЦЫ, ОТВОДЯЩЕЙ I ПАЛЕЦ
- •26.2.5. ЛОСКУТЫ ИЗ ЛАТЕРАЛЬНОЙ ГРУППЫ МЫШЦ
- •26.2.6. ЛОСКУТ ИЗ КОРОТКОГО СГИБАТЕЛЯ ПАЛЬЦЕВ СТОПЫ
- •26.2.7. ОСТРОВКОВЫЕ НЕРВНО-СОСУДИСТЫЕ ЛОСКУТЫ ПАЛЬЦЕВ СТОПЫ
- •26.3. ЛОСКУТЫ ИЗ БАССЕЙНА ТЫЛЬНОЙ АРТЕРИИ СТОПЫ
- •26.3.1. ТЫЛЬНЫЙ ЛОСКУТ СТОПЫ
- •26.3.3. ЛОСКУТ ИЗ ПЕРВОГО МЕЖПАЛЬЦЕВОГО ПРОМЕЖУТКА СТОПЫ
- •26.4.1. МИКРОХИРУРГИЧЕСКАЯ АНАТОМИЯ
- •26.4.3. ОБЩАЯ ТЕХНИКА ОПЕРАЦИЙ
- •26.4.4. ПЕРЕСАДКА I ПАЛЬЦА СТОПЫ НА КИСТЬ
- •26.4.6. ПЕРЕСАДКА БЛОКА II-III И ДРУГИХ ПАЛЬЦЕВ СТОПЫ
- •26.4.7. ПЕРЕСАДКА СУСТАВОВ
- •26.5. ЛОСКУТЫ ИЗ БАССЕЙНА КОНЕЧНЫХ ВЕТВЕЙ МАЛОБЕРЦОВОЙ АРТЕРИИ
- •2 6.5.1. НАРУЖНЫЙ ПЯТОЧНЫЙ ЛОСКУТ
- •ХИРУРГИЯ КИСТИ
- •27.1.1. ФУНКЦИЯ КИСТИ И ЕЕ СОСТАВЛЯЮЩИЕ
- •27.1.2. ОСОБЕННОСТИ АНАТОМИИ КИСТИ
- •27.1.3. ПРИНЦИПЫ ХИРУРГИИ КИСТИ
- •27.2. ХИРУРГИЯ СУХОЖИЛИЙ
- •27.2.1. ПОВРЕЖДЕНИЯ СУХОЖИЛИЙ СГИБАТЕЛЕЙ ПАЛЬЦЕВ (ОБЩИЕ ПОЛОЖЕНИЯ)
- •27.2.2. ПЕРВИЧНЫЕ ПОВРЕЖДЕНИЯ СУХОЖИЛИЙ СГИБАТЕЛЕЙ ПАЛЬЦЕВ
- •27.2.7. ОЦЕНКА РЕЗУЛЬТАТОВ ОПЕРАЦИЙ НА СУХОЖИЛИЯХ СГИБАТЕЛЕЙ
- •27.2.8. ПОВРЕЖДЕНИЯ СУХОЖИЛИЙ РАЗГИБАТЕЛЕЙ (ОБЩИЕ ПОЛОЖЕНИЯ)
- •27.2.9. ПОВРЕЖДЕНИЯ СУХОЖИЛИЙ РАЗГИБАТЕЛЕЙ В ОБЛАСТИ ДИСТАЛЬНОЙ И СРЕДНЕЙ ФАЛАНГ ПАЛЬЦА
- •27.2.10. ПОВРЕЖДЕНИЯ СУХОЖИЛИЙ РАЗГИБАТЕЛЕЙ НА УРОВНЕ ПРОКСИМАЛЬНОГО МЕЖФАЛАНГОВОГО СУСТАВА И ОСНОВНОЙ ФАЛАНГИ
- •27.2.11. ТРАВМЫ СУХОЖИЛИЙ РАЗГИБАТЕЛЕЙ НА УРОВНЕ ПЯСТНО-ФАЛАНГОВЫХ СУСТАВОВ
- •27.2.13. ТРАВМЫ СУХОЖИЛИЙ РАЗГИБАТЕЛЕЙ НА УРОВНЕ ЗАПЯСТЬЯ
- •27.3. ПОВРЕЖДЕНИЯ НЕРВОВ КИСТИ
- •27.3.1. ОСОБЕННОСТИ АНАТОМИИ НЕРВОВ КИСТИ
- •27.3.2. ПЕРВИЧНЫЕ ПОВРЕЖДЕНИЯ НЕРВОВ КИСТИ
- •27.3.3. ЗАСТАРЕЛЫЕ ПОВРЕЖДЕНИЯ НЕРВОВ КИСТИ
- •27.3.4. ПРОБЛЕМА ВОССТАНОВЛЕНИЯ ЧУВСТВИТЕЛЬНОСТИ ПАЛЬЦЕВ В ОСОБО СЛОЖНЫХ СИТУАЦИЯХ
- •27.3.5. БОЛЕЗНЕННЫЕ НЕВРОМЫ НА КИСТИ
- •27.4.1. ОБЩИЕ ПРИНЦИПЫ ЛЕЧЕНИЯ БОЛЬНЫХ
- •27.4.3. ВНУТРИСУСТАВНЫЕ ПЕРЕЛОМЫ
- •27.4.4. ОСЛОЖНЕНИЯ И ПОСЛЕДСТВИЯ ПЕРЕЛОМОВ
- •27.4.5. ПЕРЕЛОМЫ ДИСТАЛЬНЫХ ФАЛАНГ ПАЛЬЦЕВ КИСТИ
- •27.5.1. ПОВЕРХНОСТНЫЕ ДЕФЕКТЫ ТКАНЕЙ КИСТИ
- •27.5.2. ГЛУБОКИЕ ДЕФЕКТЫ ТКАНЕЙ КИСТИ
- •27.5.6. ПЛАСТИКА ДЕФЕКТОВ ТКАНЕЙ КИСТИ ПРИ УСТРАНЕНИИ РУБЦОВЫХ ДЕФОРМАЦИЙ И КОНТРАКТУР
- •27.6. ТРАВМЫ КИСТИ С НАРУШЕНИЕМ ПЕРИФЕРИЧЕСКОГО КРОВООБРАЩЕНИЯ. РЕПЛАНТАЦИОННАЯ ХИРУРГИЯ КИСТИ
- •27.6.3. ОБЩАЯ ТЕХНИКА ОПЕРАЦИЙ
- •27.6.4. ОСОБЕННОСТИ ТЕХНИКИ РЕПЛАНТАЦИИ (РЕВАСКУЛЯРИЗАЦИИ) ПАЛЬЦЕВ КИСТИ В ЗАВИСИМОСТИ ОТ ХАРАКТЕРА ТРАВМЫ
- •27.6.5. РЕЗУЛЬТАТЫ ОПЕРАЦИЙ
- •27.7. АМПУТАЦИИ ПАЛЬЦЕВ И ЛЕЧЕНИЕ БОЛЬНЫХ С БЕСПАЛОЙ КИСТЬЮ
- •27.7.1. АМПУТАЦИИ И СОЗДАНИЕ I ПАЛЬЦА КИСТИ
- •27.7.2. МЕТОДЫ СОЗДАНИЯ I ПАЛЬЦА КИСТИ
- •27.7.3. ИЗОЛИРОВАННЫЕ АМПУТАЦИИ ДЛИННЫХ ПАЛЬЦЕВ КИСТИ
- •27.7.4. МНОЖЕСТВЕННЫЕ АМПУТАЦИИ ПАЛЬЦЕВ КИСТИ
- •27.8.2. ЛЕЧЕНИЕ ПОВРЕЖДЕНИЙ НОГТЯ И ОКРУЖАЮЩИХ ЕГО ТКАНЕЙ
- •27.9. ПРИВОДЯЩИЕ КОНТРАКТУРЫ I ПАЛЬЦА КИСТИ
- •27.9.1. ЭТИОЛОГИЯ
- •27.10.1. ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
- •27.10.2. ВЫБОР МЕТОДА ЛЕЧЕНИЯ КОНТРАКТУР
- •27.10.3. ОСНОВНЫЕ ПРИНЦИПЫ И СХЕМЫ ЛЕЧЕНИЯ ПЕРВИЧНЫХ ДЕСМОГЕННЫХ И ВТОРИЧНЫХ КОНТРАКТУР ПЯСТНО-ФАЛАНГОВЫХ СУСТАВОВ
- •27.11. КОНТРАКТУРА ДЮПЮИТРЕНА
- •27.11.1. ОБЩИЕ ДАННЫЕ
- •27.11.2. КЛИНИЧЕСКИЕ ФОРМЫ КОНТРАКТУРЫ ДЮПЮИТРЕНА
- •27.11.3. ОПЕРАТИВНОЕ ЛЕЧЕНИЕ
- •27.11.4. РЕЦИДИВЫ И НОВЫЕ ОЧАГИ КОНТРАКТУРЫ ДЮПЮИТРЕНА
- •ХИРУРГИЯ ПРЕДПЛЕЧЬЯ
- •28.1. ПОВРЕЖДЕНИЯ СУХОЖИЛИЙ ЛАДОННОЙ ГРУППЫ МЫШЦ ПРЕДПЛЕЧЬЯ
- •28.1.1. ВАРИАНТЫ ПОВРЕЖДЕНИЙ
- •28.1.2. ЗОНЫ ПОВРЕЖДЕНИЯ СУХОЖИЛИЙ СГИБАТЕЛЕЙ И УСЛОВИЯ ИХ ВОССТАНОВЛЕНИЯ
- •28.1.3. ВОССТАНОВЛЕНИЕ СУХОЖИЛИЙ СГИБАТЕЛЕЙ ПАЛЬЦЕВ НА ПРЕДПЛЕЧЬЕ В БЛАГОПРИЯТНЫХ УСЛОВИЯХ
- •28.1.4. ВОССТАНОВЛЕНИЕ СУХОЖИЛИЙ СГИБАТЕЛЕЙ ПАЛЬЦЕВ НА ПРЕДПЛЕЧЬЕ В МЕНЕЕ БЛАГОПРИЯТНЫХ УСЛОВИЯХ
- •28.2.1. ПЕРВИЧНЫЕ ПОВРЕЖДЕНИЯ
- •28.2.2. ЗАСТАРЕЛЫЕ ПОВРЕЖДЕНИЯ СУХОЖИЛИЙ РАЗГИБАТЕЛЕЙ НА УРОВНЕ ПРЕДПЛЕЧЬЯ
- •28.2.3. ПОСЛЕОПЕРАЦИОННОЕ ВЕДЕНИЕ БОЛЬНЫХ
- •28.3. ПОВРЕЖДЕНИЯ НЕРВОВ ПРЕДПЛЕЧЬЯ
- •28.3.1. РАНЕНИЯ СРЕДИННОГО НЕРВА
- •28.3.2. ПОВРЕЖДЕНИЯ ЛОКТЕВОГО НЕРВА
- •28.3.4. ПОВРЕЖДЕНИЯ ЛУЧЕВОГО НЕРВА
- •28.4. МЕХАНИЧЕСКИЕ ПОВРЕЖДЕНИЯ МЫШЦ ПРЕДПЛЕЧЬЯ
- •28.4.2. ЛЕЧЕНИЕ БОЛЬНЫХ С ОБШИРНЫМИ ПОВРЕЖДЕНИЯМИ ЛАДОННОЙ ГРУППЫ МЫШЦ ПРЕДПЛЕЧЬЯ И ТОТАЛЬНЫМИ (СУБТОТАЛЬНЫМИ) НАРУШЕНИЯМИ ИХ СПОСОБНОСТИ К СОКРАЩЕНИЮ
- •28.5. ДИАФИЗАРНЫЕ ДЕФЕКТЫ КОСТЕЙ ПРЕДПЛЕЧЬЯ
- •28.5.3. ДЕФЕКТЫ ОБЕИХ КОСТЕЙ ПРЕДПЛЕЧЬЯ
- •28.6. ПОВРЕЖДЕНИЯ МАГИСТРАЛЬНЫХ СОСУДОВ ПРЕДПЛЕЧЬЯ
- •28.6.1. ОСНОВНЫЕ ВИДЫ ПОВРЕЖДЕНИЙ МАГИСТРАЛЬНЫХ АРТЕРИЙ ПРЕДПЛЕЧЬЯ
- •28.6.3. ИШЕМИЧЕСКИЕ ПОРАЖЕНИЯ МЫШЦ ПРЕДПЛЕЧЬЯ
- •28.6.5. ИШЕМИЧЕСКИЕ ПОРАЖЕНИЯ ПЕРЕДНЕЙ И ЗАДНЕЙ ГРУПП МЫШЦ ПРЕДПЛЕЧЬЯ
- •28.7. РЕПЛАНТАЦИОННАЯ ХИРУРГИЯ ПРЕДПЛЕЧЬЯ
- •28.7.1. ПОКАЗАНИЯ К СОХРАНЯЮЩИМ ОПЕРАЦИЯМ ПРИ ОТЧЛЕНЕНИИ КОНЕЧНОСТЕЙ
- •28.7.2. ТЕХНИКА ОПЕРАЦИЙ
- •28.7.4. РЕЗУЛЬТАТЫ СОХРАНЯЮЩИХ ОПЕРАЦИЙ
- •28.7.5. АМПУТАЦИИ И ПРОТЕЗИРОВАНИЕ НА УРОВНЕ ПРЕДПЛЕЧЬЯ
- •29.2. ОСНОВНЫЕ ПАТОГЕНЕТИЧЕСКИЕ ФАКТОРЫ, ОПРЕДЕЛЯЮЩИЕ ТЯЖЕСТЬ КОНТРАКТУРЫ ЛОКТЕВОГО СУСТАВА
- •29.2.1. ПАТОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ КАПСУЛЫ ЛОКТЕВОГО СУСТАВА
- •29.2.2. РУБЦОВЫЕ ИЗМЕНЕНИЯ КОЖНОГО ПОКРОВА
- •29.2.3. ЗАРАСТАНИЕ ЛОКТЕВЫХ ЯМОК
- •29.2.4. ОБРАЗОВАНИЕ ПАРАОССАЛЬНЫХ оссификатов
- •29.2.5. ДЕФОРМАЦИЯ СУСТАВНЫХ ПОВЕРХНОСТЕЙ
- •29.3. ПРИНЦИПЫ И СОДЕРЖАНИЕ ОСНОВНЫХ ЭТАПОВ ОПЕРАЦИЙ ПРИ КОНТРАКТУРАХ ЛОКТЕВОГО СУСТАВА
- •29.3.1. ДОСТУПЫ ПРИ ОПЕРАЦИЯХ ПО ПОВОДУ КОНТРАКТУР ЛОКТЕВОГО СУСТАВА
- •29.3.2. ПЕРЕСАДКА КОЖНО-ФАСЦИАЛЬНЫХ ЛОСКУТОВ ПРИ ОБШИРНЫХ РУБЦОВЫХ ИЗМЕНЕНИЯХ КОЖИ
- •29.3.3. УДЛИНЕНИЕ (ПЛАСТИКА) СУХОЖИЛИЯ ТРЕХГЛАВОЙ МЫШЦЫ ПЛЕЧА
- •29.3.4. УСТРАНЕНИЕ ВНУТРИСУСТАВНЫХ МЕХАНИЧЕСКИХ ПРЕПЯТСТВИЙ
- •29.3.5. СОЗДАНИЕ ПОЛНОЦЕННОЙ БИОЛОГИЧЕСКОЙ СРЕДЫ В ОКОЛОСУСТАВНЫХ ТКАНЯХ
- •ПОВРЕЖДЕНИЯ ПЛЕЧА
- •30.1. ПОВРЕЖДЕНИЯ СУХОЖИЛИЙ ДВУГЛАВОЙ МЫШЦЫ ПЛЕЧА
- •30.1.1. ОТРЫВЫ СУХОЖИЛИЯ ДЛИННОЙ ГОЛОВКИ ДВУГЛАВОЙ МЫШЦЫ ПЛЕЧА
- •30.1.2. ПОВРЕЖДЕНИЯ ДИСТАЛЬНОГО СУХОЖИЛИЯ ДВУГЛАВОЙ МЫШЦЫ ПЛЕЧА
- •30.2.2. РАНЕНИЯ СРЕДИННОГО НЕРВА
- •30.2.3. РАНЕНИЯ ЛОКТЕВОГО НЕРВА
- •30.2.4. ПОВРЕЖДЕНИЯ ЛУЧЕВОГО НЕРВА
- •30.3.2. ТРАНСПОЗИЦИЯ ШИРОЧАЙШЕЙ МЫШЦЫ СПИНЫ НА ПЕРЕДНЮЮ ПОВЕРХНОСТЬ ПЛЕЧА
- •30.3.3. ТРАНСПОЗИЦИЯ СУХОЖИЛИЯ ТРЕХГЛАВОЙ МЫШЦЫ ПЛЕЧА
- •30.3.4. ПЕРЕСАДКА БОЛЬШОЙ ГРУДНОЙ МЫШЦЫ
- •30.3.5. СРАВНИТЕЛЬНАЯ ОЦЕНКА ВОЗМОЖНОСТЕЙ РАЗЛИЧНЫХ МЕТОДОВ ВОССТАНОВЛЕНИЯ АКТИВНОГО СГИБАНИЯ В ЛОКТЕВОМ СУСТАВЕ
- •30.4. ДЕФЕКТЫ МЯГКИХ ТКАНЕЙ ПЛЕЧА
- •30.5. ДЕФЕКТЫ ПЛЕЧЕВОЙ КОСТИ
- •30.5.1. ДИАФИЗАРНЫЕ ДЕФЕКТЫ ПЛЕЧЕВОЙ КОСТИ
- •30.6. ПОВРЕЖДЕНИЯ МАГИСТРАЛЬНЫХ АРТЕРИЙ НА УРОВНЕ ПЛЕЧА РЕПЛАНТАЦИОННАЯ ХИРУРГИЯ
- •30.6.1. НАРУШЕНИЯ ПЕРИФЕРИЧЕСКОГО КРОВООБРАЩЕНИЯ ПРИ ПОВРЕЖДЕНИЯХ ПЛЕЧЕВОЙ АРТЕРИИ
- •30.6.2. ТЕХНИКА НАЛОЖЕНИЯ ШВОВ (ПЛАСТИКИ) НА ПЛЕЧЕВУЮ АРТЕРИЮ
- •30.6.4. ОСОБЕННОСТИ ТЕХНИКИ СОХРАНЯЮЩИХ ОПЕРАЦИЙ НА УРОВНЕ ПЛЕЧА
- •30.6.5. РЕЗУЛЬТАТЫ СОХРАНЯЮЩИХ ОПЕРАЦИЙ
- •30.7. АМПУТАЦИИ ПЛЕЧА
- •30.7.2. УДЛИНЕНИЕ КОРОТКОЙ КУЛЬТИ ПЛЕЧА
- •30.8. ПРИВЫЧНЫЙ ВЫВИХ ПЛЕЧА
- •30.8.1. МЕХАНОГЕНЕЗ РАЗВИТИЯ ПРИВЫЧНОГО (ПЕРЕДНЕВНУТРЕННЕГО) ВЫВИХА ПЛЕЧА
- •30.8.2. ВЫБОР МЕТОДА ЛЕЧЕНИЯ
- •ПОВРЕЖДЕНИЯ БЕДРА
- •31.1. ПОВРЕЖДЕНИЯ СУХОЖИЛЬНОГО РАСТЯЖЕНИЯ ЧЕТЫРЕХГЛАВОЙ МЫШЦЫ БЕДРА
- •31.1.1. ОТРЫВЫ СУХОЖИЛЬНОГО РАСТЯЖЕНИЯ ЧЕТЫРЕХГЛАВОЙ МЫШЦЫ БЕДРА ОТ ВЕРХНЕГО КРАЯ НАДКОЛЕННИКА
- •31.1.3. ОТРЫВЫ СУХОЖИЛИЯ ЧЕТЫРЕХГЛАВОЙ МЫШЦЫ БЕДРА У НИЖНЕГО ПОЛЮСА НАДКОЛЕННИКА ЛИБО ОТ БУГРИСТОСТИ БОЛЬШЕБЕРЦОВОЙ КОСТИ
- •31.1.4. ПОСЛЕОПЕРАЦИОННОЕ ВЕДЕНИЕ БОЛЬНЫХ
- •31.2. ПОВРЕЖДЕНИЯ НЕРВОВ БЕДРА
- •31.2.1. РАНЕНИЯ СЕДАЛИЩНОГО НЕРВА
- •31.2.2. РАНЕНИЯ БЕДРЕННОГО НЕРВА
- •31.2.3. РАНЕНИЯ ЗАПИРАТЕЛЬНОГО НЕРВА
- •31.3. ДЕФЕКТЫ МЫШЦ БЕДРА
- •31.3.3. КОНТУРНЫЙ ДЕФЕКТ БЕДРА
- •31.4. ДЕФЕКТЫ БЕДРЕННОЙ КОСТИ
- •31.4.1. ДЕФЕКТЫ СУСТАВНЫХ КОНЦОВ КОСТЕЙ
- •31.4.2. ДИАФИЗАРНЫЕ ДЕФЕКТЫ БЕДРЕННОЙ КОСТИ
- •31.5.1. ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
- •31.6.3. ПЕРЕСАДКА КОМПЛЕКСОВ ТКАНЕЙ ГОЛЕНИ И СТОПЫ ДЛЯ УДЛИНЕНИЯ И СОЗДАНИЯ ТОРЦЕВОЙ ОПОРОСПОСОБНОСТИ КУЛЬТИ БЕДРА
- •31.6.4. РЕКОНСТРУКТИВНАЯ АМПУТАЦИЯ БЕДРА ПО С. VAN NES
- •ПОВРЕЖДЕНИЯ И ДЕФЕКТЫ ТКАНЕЙ ГОЛЕНИ
- •32.1. ПОВРЕЖДЕНИЯ ПЯТОЧНОГО (АХИЛЛОВА) СУХОЖИЛИЯ
- •32.1.1. ЛЕЧЕНИЕ БОЛЬНЫХ С ПЕРВИЧНЫМИ ПОВРЕЖДЕНИЯМИ ПЯТОЧНОГО СУХОЖИЛИЯ
- •32.1.2. ЗАСТАРЕЛЫЕ ПОВРЕЖДЕНИЯ ПЯТОЧНОГО СУХОЖИЛИЯ
- •32.1.3. ПОСЛЕОПЕРАЦИОННЫЕ ОСЛОЖНЕНИЯ: ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
- •32.2.3. ВЫБОР МЕТОДА ПЛАСТИКИ И ДОНОРСКОГО ИСТОЧНИКА В ЗАВИСИМОСТИ ОТ РАСПОЛОЖЕНИЯ ДЕФЕКТА МЯГКИХ ТКАНЕЙ
- •32.3. ПОВРЕЖДЕНИЯ КРУПНЫХ МНОГОПУЧКОВЫХ НЕРВОВ НА УРОВНЕ ГОЛЕНИ
- •32.3.1. ПОВРЕЖДЕНИЯ БОЛЬШЕБЕРЦОВОГО НЕРВА
- •32.3.2. ПОВРЕЖДЕНИЯ МАЛОБЕРЦОВОГО НЕРВА
- •32.4. ЛЕЧЕНИЕ БОЛЬНЫХ С ДЕФЕКТАМИ БОЛЬШЕБЕРЦОВОЙ КОСТИ*
- •32.4.1. ОСОБЕННОСТИ СТРОЕНИЯ ГОЛЕНИ И ПАТОГЕНЕЗ ПОСТТРАВМАТИЧЕСКОГО ОСТЕОМИЕЛИТА БОЛЬШЕБЕРЦОВОЙ КОСТИ
- •32.4.2. КЛАССИФИКАЦИЯ ДЕФЕКТОВ БОЛЬШЕБЕРЦОВОЙ КОСТИ
- •32.4.3. ЛЕЧЕНИЕ БОЛЬНЫХ С КРАЕВЫМИ ДЕФЕКТАМИ БОЛЬШЕБЕРЦОВОЙ КОСТИ БЕЗ ЗНАЧИТЕЛЬНОГО НАРУШЕНИЯ ЕЕ МЕХАНИЧЕСКОЙ ПРОЧНОСТИ
- •32.4.4. ЛЕЧЕНИЕ БОЛЬНЫХ С КРАЕВЫМИ ДЕФЕКТАМИ БОЛЬШЕБЕРЦОВОЙ КОСТИ ПРИ ЗНАЧИТЕЛЬНОМ СНИЖЕНИИ ЕЕ МЕХАНИЧЕСКОЙ ПРОЧНОСТИ
- •32.4.5. ЛЕЧЕНИЕ БОЛЬНЫХ С ЦИРКУЛЯРНЫМИ ДЕФЕКТАМИ БОЛЬШЕБЕРЦОВОЙ КОСТИ
- •32.4.9. РЕЗУЛЬТАТЫ ЛЕЧЕНИЯ
- •32.4.11. ПЕРЕСАДКА КРОВОСНАБЖАЕМЫХ КОМПЛЕКСОВ ТКАНЕЙ ПРИ ЛЕЧЕНИИ БОЛЬНЫХ С ЛОЖНЫМИ СУСТАВАМИ БОЛЬШЕБЕРЦОВОЙ КОСТИ
- •32.5. РЕПЛАНТАЦИЯ И АМПУТАЦИЯ НИЖНИХ КОНЕЧНОСТЕЙ НА УРОВНЕ ГОЛЕНИ
- •ПЛАСТИКА ДЕФЕКТОВ ТКАНЕЙ СТОПЫ
- •33.2. ОБЩИЕ ПРИНЦИПЫ ВЫБОРА МЕТОДА ПЛАСТИКИ ПОСТТРАВМАТИЧЕСКИХ ДЕФЕКТОВ ТКАНЕЙ СТОПЫ
- •33.4. ТЕХНИЧЕСКИЕ ОСОБЕННОСТИ ПЕРЕСАДКИ СЛОЖНЫХ ЛОСКУТОВ ПРИ ДЕФЕКТАХ ТКАНЕЙ СТОПЫ
- •33.4.2. ПЕРЕСАДКА ОСТРОВКОВЫХ ЛОСКУТОВ
- •33.4.3. ПЕРЕСАДКА СВОБОДНЫХ СЛОЖНЫХ ЛОСКУТОВ
- •ЭСТЕТИЧЕСКАЯ ХИРУРГИЯ
- •34.2. ИСТОРИЯ РАЗВИТИЯ ЭСТЕТИЧЕСКОЙ ХИРУРГИИ
- •34.3. РОЛЬ ВНЕШНОСТИ В ЖИЗНИ ЧЕЛОВЕКА
- •34.7. ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
- •ОМОЛАЖИВАЮЩИЕ ОПЕРАЦИИ НА ЛИЦЕ*
- •35.1. НЕКОТОРЫЕ ОСОБЕННОСТИ АНАТОМИИ ТКАНЕЙ ЛИЦА
- •35.1.1. КРОВОСНАБЖЕНИЕ
- •35.1.2. МЫШЦЫ
- •35.1.3. ИННЕРВАЦИЯ
- •35.2.1. СТАРЕНИЕ КОЖИ ЛИЦА
- •35.2.2. СТАРЕНИЕ ЖИРОВОГО СЛОЯ
- •35.2.3. МЫШЦЫ ЛИЦА И СТАРЕНИЕ
- •35.2.4. КОСТИ
- •35.3. ПОДТЯЖКА КОЖИ ЛИЦА
- •35.3.1. ИСТОРИЯ
- •35.3.2. ПРЕДОПЕРАЦИОННАЯ ПОДГОТОВКА
- •35.3.3. ТЕХНИКА ОПЕРАЦИИ
- •35.3.4. ВМЕШАТЕЛЬСТВА НА ПОВЕРХНОСТНОЙ МЫШЕЧНО-ФАСЦИАЛЬНОЙ СИСТЕМЕ
- •35.3.5. СУБМЕНТАЛЬНАЯ ПЛАСТИКА
- •35.3.6. ПОСЛЕОПЕРАЦИОННЫЙ ПЕРИОД
- •35.3.7. ОСЛОЖНЕНИЯ
- •35.3.8. ЯТРОГЕННЫЕ ПОВРЕЖДЕНИЯ НЕРВОВ
- •35.3.9. ОЦЕНКА РЕЗУЛЬТАТОВ
- •35.4.1. ИСТОРИЯ И ПОКАЗАНИЯ К ОПЕРАЦИИ
- •35.4.4. РЕЗУЛЬТАТЫ
- •35.5. БЛЕФАРОПЛАСТИКА
- •35.5.3. ХИРУРГИЧЕСКАЯ ТЕХНИКА
- •35.5.4. ОСЛОЖНЕНИЯ
- •РИНОПЛАСТИКА
- •36.1.2. ПОКРОВНЫЕ ТКАНИ
- •36.1.4. ОСНОВАНИЕ НОСА
- •36.1.5. КОСТНО-ХРЯЩЕВОЙ СВОД НОСА
- •36.1.6. НОСОВАЯ ПЕРЕГОРОДКА
- •36.1.1. ОБЩАЯ ХАРАКТЕРИСТИКА
- •36.2. ПЛАНИРОВАНИЕ РИНОПЛАСТИКИ
- •36.2.1. ОПРЕДЕЛЕНИЕ ЦЕЛЕЙ ПАЦИЕНТА
- •36.2.2. ЭСТЕТИЧЕСКИЙ И АНАТОМИЧЕСКИЙ АНАЛИЗ
- •36.3.1. ЗАКРЫТЫЕ ДОСТУПЫ
- •36.3.2. ОТКРЫТЫЕ ДОСТУПЫ
- •36.4. ПОСЛЕДОВАТЕЛЬНОСТЬ ОСНОВНЫХ ЭТАПОВ РИНОПЛАСТИКИ
- •36.5. ХИРУРГИЯ КОНЧИКА НОСА
- •36.5.2. ОСНОВНОЙ ПРИНЦИП РЕКОНСТРУКЦИИ КОНЧИКА НОСА И ВИДЫ ОПЕРАЦИЙ
- •36.5.5. ИЗМЕНЕНИЕ РОТАЦИИ КОНЧИКА НОСА
- •36.6.1. ВАРИАНТЫ РАСПОЛОЖЕНИЯ СПИНКИ НОСА И ВЫБОР ДОСТУПА ПРИ КОРРИГИРУЮЩИХ ОПЕРАЦИЯХ
- •36.6.2. КОРРЕКЦИЯ ВЫСОКОЙ СПИНКИ НОСА
- •36.6.3. СПИНКА НОСА С ИЗМЕНЕННЫМ НАКЛОНОМ
- •36.6.4. НИЗКАЯ СПИНКА НОСА
- •36.6.5. ШИРОКАЯ СПИНКА НОСА
- •36.6.6. УЗКАЯ СПИНКА НОСА
- •36.6.7. БОКОВЫЕ ИСКРИВЛЕНИЯ СПИНКИ НОСА
- •36.6.8. ДРЕНИРОВАНИЕ ПРИ ОПЕРАЦИЯХ НА СПИНКЕ НОСА
- •36.7. ХИРУРГИЯ НОСОВОЙ ПЕРЕГОРОДКИ
- •36.7.1. ОСНОВНЫЕ ВИДЫ ДЕФОРМАЦИЙ НОСОВОЙ ПЕРЕГОРОДКИ
- •36.7.2. ДОСТУПЫ И ВИДЫ ОПЕРАЦИЙ НА НОСОВОЙ ПЕРЕГОРОДКЕ
- •36.7.3. КОРРЕКЦИЯ ДЕФОРМАЦИЙ НОСОВОЙ ПЕРЕГОРОДКИ
- •36.7.4. ЗАВЕРШЕНИЕ ОПЕРАЦИЙ НА НОСОВОЙ ПЕРЕГОРОДКЕ
- •36.8. ОСНОВАНИЕ НОСА
- •36.8.1. ЭСТЕТИЧЕСКИЕ ХАРАКТЕРИСТИКИ ОСНОВАНИЯ НОСА
- •36.8.2. КОЖНАЯ ЧАСТЬ НОСОВОЙ ПЕРЕГОРОДКИ
- •36.8.3. КРЫЛЬЯ НОСА
- •36.10. ОЦЕНКА РЕЗУЛЬТАТОВ РИНОПЛАСТИКИ
- •ЭСТЕТИЧЕСКАЯ ХИРУРГИЯ МОЛОЧНЫХ ЖЕЛЕЗ*
- •37.1. АНАТОМИЯ МОЛОЧНОЙ ЖЕЛЕЗЫ
- •37.1.1. СТРОЕНИЕ
- •37.1.2. КРОВОСНАБЖЕНИЕ
- •37.1.3. ЛИМФАТИЧЕСКАЯ СИСТЕМА
- •37.1.4. ИННЕРВАЦИЯ
- •37.1.5. ФОРМА И РАЗМЕРЫ МОЛОЧНЫХ ЖЕЛЕЗ
- •37.2. УВЕЛИЧИВАЮЩАЯ МАММОПЛАСТИКА
- •37.2.1.ИСТОРИЯ РАЗВИТИЯ МЕТОДОВ УВЕЛИЧЕНИЯ МОЛОЧНЫХ ЖЕЛЕЗ
- •37.2.2. ПРЕДОПЕРАЦИОННОЕ ОБСЛЕДОВАНИЕ
- •37.2.4. ВИДЫ ИМПЛАНТАТОВ
- •37.2.5. ТЕХНИКА ОПЕРАЦИИ
- •37.2.6. ПОСЛЕОПЕРАЦИОННЫЙ ПЕРИОД
- •37.2.7. ОСЛОЖНЕНИЯ
- •37.2.8. КАПСУЛЯРНАЯ КОНТРАКТУРА
- •37.3. РЕДУКЦИОННАЯ МАММОПЛАСТИКА
- •37.3.1. ИСТОРИЯ
- •37.3.2. КЛАССИФИКАЦИЯ ГИПЕРТРОФИИ МОЛОЧНЫХ ЖЕЛЕЗ
- •37.3.4. ПЛАНИРОВАНИЕ ОПЕРАЦИИ
- •37.3.6. ОПЕРАЦИИ ПРИ НЕЗНАЧИТЕЛЬНОЙ И СРЕДНЕЙ СТЕПЕНИ ГИПЕРТРОФИИ МОЛОЧНЫХ ЖЕЛЕЗ
- •37.3.7. ОПЕРАЦИИ ПРИ ВЫРАЖЕННОЙ ГИПЕРТРОФИИ МОЛОЧНЫХ ЖЕЛЕЗ
- •37.3.8. ОПЕРАЦИИ ПРИ ГИГАНТОМАСТИИ
- •37.3.9. ДРУГИЕ ВИДЫ УМЕНЬШАЮЩЕЙ МАММОПЛАСТИКИ
- •37.3.10. ОСЛОЖНЕНИЯ ПОСЛЕ РЕДУКЦИОННОЙ МАММОПЛАСТИКИ
- •37.4. ПОДТЯЖКА МОЛОЧНЫХ ЖЕЛЕЗ (МАСТОПЕКСИЯ)
- •37.4.1. ИСТОРИЯ
- •37.4.4. ОПЕРАЦИИ ПОДТЯЖКИ МОЛОЧНЫХ ЖЕЛЕЗ
- •37.5. ОПЕРАЦИИ ПРИ ДЕФОРМАЦИЯХ СОСКОВО-АРЕОЛЯРНОГО КОМПЛЕКСА
- •37.5.1. ВТЯНУТЫЙ СОСОК
- •37.5.2. ГИПЕРТРОФИРОВАННЫЙ СОСОК
- •37.5.3. ДЕФОРМАЦИЯ АРЕОЛЫ
- •ПЛАСТИКА ПЕРЕДНЕЙ БРЮШНОЙ СТЕНКИ (абдоминопластика) *
- •38.1. ИСТОРИЯ
- •38.2.1. ПОВЕРХНОСТНЫЙ СЛОЙ МЯГКИХ ТКАНЕЙ
- •38.2.2. МЫШЕЧНО-АПОНЕВРОТИЧЕСКИЙ СЛОЙ
- •38.4. ПЕРВИЧНЫЙ ОСМОТР ПАЦИЕНТОВ
- •38.5.4. ОПТИМАЛЬНЫЙ ДОСТУП
- •38.5.5. РАЦИОНАЛЬНАЯ ОТСЛОЙКА КОЖНО-ЖИРОВОГО ЛОСКУТА
- •38.5.6. ПЛАСТИКА МЫШЕЧНО-АПОНЕВРОТИЧЕСКОГО СЛОЯ
- •38.5.8. УДАЛЕНИЕ ИЗБЫТКА МЯГКИХ ТКАНЕЙ ЛОСКУТА И УШИВАНИЕ РАНЫ
- •38.5.9. ПОСЛЕОПЕРАЦИОННОЕ ВЕДЕНИЕ БОЛЬНЫХ
- •38.6. КЛАССИЧЕСКАЯ АБДОМИНОПЛАСТИКА
- •38.6.1. РАЗМЕТКА ОПЕРАЦИОННОГО ПОЛЯ
- •38.6.2. ТЕХНИКА ОПЕРАЦИИ
- •38.7. НАПРЯЖЕННО-БОКОВАЯ АБДОМИНОПЛАСТИКА
- •38.7.1. ОБОСНОВАНИЕ И ТЕХНИКА ОПЕРАЦИИ
- •38.7.2. ПОКАЗАНИЯ К ОПЕРАЦИИ
- •38.7.3. ХИРУРГИЧЕСКАЯ ТЕХНИКА
- •38.8. ВЕРТИКАЛЬНАЯ АБДОМИНОПЛАСТИКА
- •38.8.2. ТЕХНИКА ОПЕРАЦИИ
- •38.9. ОСОБЕННОСТИ АБДОМИНОПЛАСТИКИ ПРИ НАЛИЧИИ РУБЦОВ НА ПЕРЕДНЕЙ БРЮШНОЙ СТЕНКЕ
- •38.10. СОЧЕТАНИЕ АБДОМИНОПЛАСТИКИ И ЛИПОСАКЦИИ
- •38.10.1. ВАРИАНТЫ ЛИПОСАКЦИИ И ИХ ВЛИЯНИЕ НА РЕЗУЛЬТАТЫ АБДОМИНОПЛАСТИКИ
- •38.10.2. ПРЕДВАРИТЕЛЬНАЯ ЛИПОСАКЦИЯ
- •38.10.3. ЛИПОСАКЦИЯ В ХОДЕ АБДОМИНОПЛАСТИКИ
- •38.10.4. ЛИПОСАКЦИЯ ПОСЛЕ АБДОМИНОПЛАСТИКИ
- •38.11.1. ОБЩИЕ ОСЛОЖНЕНИЯ
- •38.11.2. МЕСТНЫЕ ОСЛОЖНЕНИЯ
- •ЛИПОСАКЦИЯ*
- •39.1. ИСТОРИЯ РАЗВИТИЯ МЕТОДА
- •39.2. ТЕРМИНЫ
- •39.3.2. ВИДЫ И ФОРМЫ ЖИРОВЫХ ОТЛОЖЕНИЙ
- •39.3.3. ЛОКАЛЬНЫЕ ФОРМЫ ЖИРОВЫХ ОТЛОЖЕНИЙ
- •39.4. ПОКАЗАНИЯ К ЛИПОСАКЦИИ
- •39.5. ТЕХНИКА ЛИПОСАКЦИИ
- •39.6. ОБЪЕМ ЛИПОСАКЦИИ
- •39.7. ПОСЛЕОПЕРАЦИОННЫЙ ПЕРИОД
- •39.8. ОСЛОЖНЕНИЯ ЛИПОСАКЦИИ
- •39.9. ОЦЕНКА РЕЗУЛЬТАТОВ ОПЕРАЦИИ
- •КОРРЕКЦИЯ КОЖНЫХ РУБЦОВ*
- •40.1. КЛАССИФИКАЦИЯ РУБЦОВ
- •40.1.1. ТИПЫ КОЖНЫХ РУБЦОВ
- •40.1.2. ФОРМА КОЖНЫХ РУБЦОВ
- •40.1.3. ЧУВСТВИТЕЛЬНОСТЬ КОЖНЫХ РУБЦОВ
- •40.1.4. ВЛИЯНИЕ КОЖНЫХ РУБЦОВ НА ФУНКЦИЮ
- •40.2.1. ПОДТЯЖКА КОЖИ ЛИЦА И ЛБА
- •40.2.2. ПЛАСТИКА ПЕРЕДНЕЙ БРЮШНОЙ СТЕНКИ
- •40.2.3. ПОДТЯЖКА МОЛОЧНЫХ ЖЕЛЕЗ
- •40.2.4. ЛИПОСАКЦИЯ
- •40.3. КОРРЕКЦИЯ РУБЦОВ
- •40.3.1. УДЛИНЕНИЕ РУБЦОВ
- •40.3.2. ИССЕЧЕНИЕ РУБЦОВ
- •40.4. КОРРЕКЦИЯ КЕЛОИДНЫХ РУБЦОВ
- •40.4.1. КОНСЕРВАТИВНОЕ ЛЕЧЕНИЕ
- •АНЕСТЕЗИЯ В ЭСТЕТИЧЕСКОЙ ХИРУРГИИ*
- •41.1. МЕСТНАЯ ИНФИЛЬТРАЦИОННАЯ АНЕСТЕЗИЯ
- •41.2. ВНУТРИВЕННОЕ ВВЕДЕНИЕ СЕДАТИВНЫХ СРЕДСТВ
- •41.3. ОБЩАЯ АНЕСТЕЗИЯ
- •41.4. ИСПОЛЬЗОВАНИЕ АДРЕНАЛИНСОДЕРЖАЩИХ РАСТВОРОВ
- •ДОКУМЕНТАЛЬНОЕ ОФОРМЛЕНИЕ СОГЛАСИЯ ПАЦИЕНТА НА ОПЕРАЦИЮ
- •42.1.4. СОГЛАСИЕ ПАЦИЕНТА НА ОПЕРАЦИЮ ПЛАСТИКИ УШНЫХ РАКОВИН
- •42.1.5. СОГЛАСИЕ ПАЦИЕНТА НА ОПЕРАЦИЮ ПЛАСТИКИ НОСА
- •42.1.10. СОГЛАСИЕ ПАЦИЕНТА НА ОПЕРАЦИЮ ЛИПОСАКЦИИ

лоскута, замедленным симптомом пятна и даже его отсутствием. В некоторых случаях возможны цианоз и венозный застой в этой части лоскута, но при этом симптом пятна не бывает ускоренным.
С усугублением метаболических расстройств ткани темнеют, развивается их некроз. Все это сочетается с относительно нормальным кровообращением в основной части пересаженного лоскута.
Л е ч е н и е острых нарушений кровообращения в лоскутах по периферическому типу заключается, с одной стороны, в устранении их причин (если это возможно в полной мере). С другой стороны, они требует использования методов профилактики и лечения метаболических нарушений, развивающихся в тканях при их недостаточном питании (см. раздел 7.4, стр. 80).
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1.Белоусов А.Е., Ткаченко С.С. Микрохирургия в травматоло- гии.—Л.: Медицина, 1988.— 224 с.
2.Белоусов А.Е., Мезенцев И А. О перестройке кровообращения реваскуляризованных трансплантатов после свобод-
ОБЩИЕ ВОПРОСЫ
ной микрохирургической пересадки // Acta Chir. Plast.- 1985.- Vol. 27, № 2 . - P. 82—89.
3. Batchelor A.G. A simplified pedicle delay for axial pattern flaps
//Brit. J. Plast. Surg,— 1987.— Vol. 40, № 5.— P. 540-541,
4.Finseth F., Adelberg M.G. Prevention of skin flap necrosis by a course of treatment with vasodilator drugs // Plast. reconstr. Surg.- 1978,- Vol. 61, № 5 . - P. 738 - 743 .
5.Finseth F. Cutting С An experimental neurovascular island skin flap for the study of the delay phenomenon // Plast. reconstr, Surg.- 1978,- Vol. 61, № 3 . - P. 412 - 420 .
6.FicherJ., WoodM.B, Late necrosis of a latissimus dorsi free flap
//Plast. reconstr. Surg.— 1984.—Vol. 74, № 2,—P. 274 - 278.
7.Krag C, Hesselfeldt-Niehen /., Gothgen /.Late patency of clinical microvascular anastomoses to free composite tissue transplants. 2. Hemodynamical aspects // Scand. J. Plast, reconstr. Surg.- 1985, - Vol. 19, № 1 . - P. 73 - 79 .
8.Okada T. Revascularization of free full thickness skin grafts in rubbits: a scanning electron microscope study of microvascular casts // Brit. J. Plast. Surg.- 1986 . - Vol. 39, № 2 . - P. 1 8 3 - 189.
9.Pang С Y, Forrest C.R., Neligan P.C., Lindsay W.K. Augmentation of blood flow in delayed random skin flaps in the pig: effect of length of delay period and angiogenesis // Plast. reconstr. Surg.— 1986.— Vol. 78, № 1.— P. 68—74.
10.Sumi Y, Ueda M., Kaneda T. et al Marginal vascular changes in pedicle skin flaps // Ann. Plast. Surg.— 1986.—Vol. 16 № 1 . - P. 5 1 - 5 9 .
11.Thatte R.L, Yelicar A.D., Chhajlani P., Thatte M.R. Successful detachment of cross-leg fasciocutaneous flaps on the tenth day: a report of 10 cases // Brit. J. Plast. Surg.— 1986.— Vol. 39, № 4.— P. 491—497.
Г л а в а 6
КРОВООБРАЩЕНИЕ ПРИ АТИПИЧНЫХ ВАРИАНТАХ ВКЛЮЧЕНИЯ ТКАНЕЙ В КРОВОТОК
6.1.ОБЩИЕ ПОЛОЖЕНИЯ
В1628 г. W.Harvey предложил концепцию артерии восстановление окольного кровообра-
циркуляции крови, в соответствии с которой питание тканей осуществляется из основной артерии, делящейся на все более мелкие ветви. Затем кровь проходит через капилляры, после чего собирается в венулы, вены и, наконец, в главные венозные стволы (рис. 6.1.1).
Как показывают клиническая практика и некоторые исследования, эта концепция, базирующаяся на идеальной картине продолжающегося кровотока, слишком проста для такой сложной циркуляторной системы, какой является организм человека. В ходе эволюции природа создала определенные и пока еще плохо изученные физиологические механизмы перераспределения и реверсирования кровотока в тканях, которые обеспечивают различным частям организма сохранность при повреждении или временном блокировании отдельных звеньев сосудистой сети.
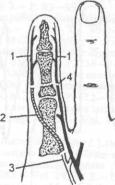
В частности, перевязка всех тыльных вен пальца при ранении фаланги сопровождается значительной переориентацией венозного кровотока (рис. 6.1.2). При повреждении крупной
щения также может осуществляться путем реверсирования кровотока в определенных участках сосудов.
С развитием микрососудистой хирургии возможности искусственного создания новых способов включения тканей в кровоток резко возросли. В настоящее время используются четыре таких варианта:
1)восстановление сквозного артериального кровотока при отсутствии венозного оттока;
2)восстановление сквозного венозного кровотока при отсутствии артериального притока;
Рис. 6.1.1. Принципиальная схема кровообращения в тканях по W.Garvey.

КРОВООБРАЩЕНИЕ ПРИ АТИПИЧНЫХ ВАРИАНТАХ ВКЛЮЧЕНИЯ ТКАНЕЙ В КРОВОТОК |
65 |
6.2. ПИТАНИЕ ТКАНЕЙ ПРИ СКВОЗНОМ АРТЕРИАЛЬНОМ КРОВОТОКЕ
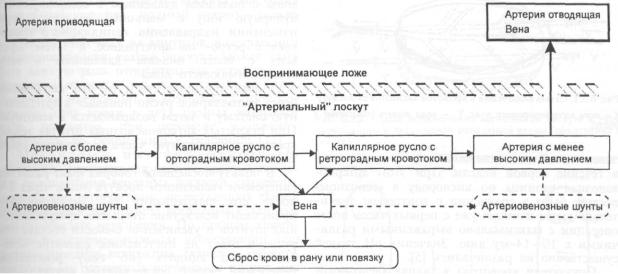
БЕЗ ВОССТАНОВЛЕНИЯ ВЕНОЗНОГО ОТТОКА. «АРТЕРИАЛЬНЫЕ» ЛОСКУТЫ
|
Хорошо известно, что при сохраненном |
|||
|
артериальном притоке и полном отсутствии |
|||
|
венозного оттока наступает гибель тканей. |
|||
|
Однако клиническая практика свидетельствует |
|||
|
о том, что отсутствие сшитых вен при |
|||
|
реплантации (трансплантации) тканей вовсе не |
|||
|
обязательно приведет к гибели последних, и в |
|||
|
частности при наличии сквозного кровотока |
|||
|
через артериальную сеть. Для удобства изло- |
|||
Рис. 6.1.2. Схематическое изображение преимущественных |
жения такие лоскуты можно условно назвать |
|||
путей венозного оттока (стрелки) на пальце кисти в норме |
артериальными. |
|
|
|
(а) и после перевязки тыльных подкожных вен (б). |
В настоящее время известны два основных |
|||
|
варианта клинического применения «артериаль- |
|||
3) обеспечение притока артериальной крови |
ного» лоскута: с оттоком крови в артериальное |
|||
в венозное русло (артериализация венозного |
либо в венозное русло воспринимающего ложа. |
|||
русла или приводящая артериовенозная фис- |
|
|
|
|
тула); |
|
|
|
|
4) применение островковых лоскутов на |
6.2.1. «АРТЕРИАЛЬНЫЙ» ЛОСКУТ С ОТТОКОМ КРОВИ |
|||
периферической сосудистой ножке с реверсиро- |
В АРТЕРИАЛЬНОЕ РУСЛО |
|
||
ванием в основных сосудах артериального и |
|
|
|
|
венозного кровотока. Более того, уже накоплены |
При свободной пересадке комплексов тканей |
|||
и первые свидетельства возможности использо- |
с восстановлением их кровообращения путем |
|||
вания этих вариантов в клинической практике. |
микроанастомозирования артерий и вен с |
|||
Как известно, для обеспечения метаболизма |
сосудами воспринимающего ложа могут воз- |
|||
в тканях необходим взаимообмен веществ |
никать ситуации, когда восстановление веноз- |
|||
между тканевой жидкостью и плазмой крови. |
ного оттока не представляется возможным. |
|||
Он достигается при движении крови через |
Такая ситуация нам впервые встретилась при |
|||
капиллярное русло. |
пересадке малоберцовой кости, диаметр вен |
|||
Однако еще ранние прижизненные иссле- |
которой в несколько раз превышал диаметр |
|||
дования сосудистого русла показали, что ка- |
донорских сосудов. В связи с тромбозом |
|||
пиллярная сеть представляет собой не систему |
венозных анастомозов |
попытки |
восстановить |
|
параллельных трубок, а конструкцию с очень |
нормальный венозный |
сброс были оставлены |
||
сложной архитектоникой. |
и в этой, казалось бы безвыходной, ситуации |
|||
Кровоток в капиллярах непостоянен и может |
впервые произвели успешную пересадку мало- |
|||
изменять направление при открытии (закры- |
берцового трансплантата, артерию которого в |
|||
тии) того или иного сосуда [Zweifach В., 1939, |
виде вставки включили в артерию восприни- |
|||
цит. по Baek S.-M, 1985]. Так, общеизвестно, |
мающего ложа (рис. 6.2.1) [1]. |
|
||
что в организме человека переброс крови из |
Последующие наблюдения продемонстриро- |
|||
одной части артериального (венозного) русла |
вали возможность сохранения жизнеспособно- |
|||
в другую достигается через хорошо развитые |
сти и Репаративных способностей пересаженной |
|||
межартериальные (межвенозные) анастомозы. |
таким образом кости. В двух аналогичных |
|||
Существуют анатомические основания и для |
наблюдениях в состав трансплантата был вклю- |
|||
переброски крови из артериальной в венозную |
чен кожно-фасциальный лоскут, |
который у |
||
систему и обратно, через систему артериове- |
|
|
|
|
нозных шунтов [30]. |
|
|
|
|
Разность концентраций диффундирующих |
|
|
|
|
веществ может быть обеспечена в довольно |
|
|
|
|
широких пределах, так как степень накопления |
|
|
|
|
конечных продуктов обмена в тканях может |
|
|
|
|
значительно колебаться в пределах состояния |
|
|
|
|
тканей, определяемого как «компенсированная |
|
|
|
|
острая ишемия». |
Рис. 6.2.1. Схема включения в кровоток «артериального» |
|||
Каковы же уже установленные и предпола- |
||||
гаемые особенности гемодинамики в тканевых |
костного малоберцового лоскута. |
|
||
1 — малоберцовый трансплантат; 2 — артерия трансплантата, вшитая |
||||
комплексах при различных вариантах атипич- |
||||
в артерию воспринимающего ложа; 3 — перевязанные вены транс- |
||||
ного включения в кровоток? |
плантата. |
|
|
|
ОБЩИЕ ВОПРОСЫ
Наш опыт 8 операций свидетельствует о |
|
|
|
|||||||||||
том, что использование данного варианта |
|
|
|
|||||||||||
включения тканей в кровоток целесообразно |
|
|
|
|||||||||||
лишь при пересадке малоберцовой кости, |
|
|
|
|||||||||||
взятой |
без |
кожно-фасциального лоскута |
с |
Рис. 6.2.2. Схема отводящей артериовенозной фистулы при |
||||||||||
минимальным |
объемом мягких |
тканей. В |
то |
|||||||||||
реплантации пальца кисти (по A.Smith и соавт., 1983). |
||||||||||||||
же время вероятность выживания мягкотканных |
||||||||||||||
1 — пальцевые артерии; 2 — аутовенозная вставка; 3 — тыльная вена |
||||||||||||||
лоскутов, по-видимому, во многом зависит от |
||||||||||||||
кисти; 4 — место артериального анастомоза. |
|
|||||||||||||
их сосудистой архитектоники. В пользу этого |
|
|
|
|||||||||||
говорит |
наблюдение |
С. Егег |
и |
соавт. |
(1991), |
лоскута могут быть связаны с наличием градиента |
||||||||
которые |
успешно |
пересадили |
«артериальный» |
давления между различными участками его арте- |
||||||||||
лучевой лоскут размерами 6*9 см с его |
риальной сети. При этом кровь из артерии с |
|||||||||||||
полным |
приживлением [13]. |
|
|
|
|
относительно высоким давлением может попадать |
||||||||
Накопление |
коллективного |
опыта |
покажет, |
в капиллярное русло с преимущественно ортоград- |
||||||||||
какие виды «артериальных» комплексов тканей |
ным кровотоком и затем через соседние участки |
|||||||||||||
являются более эффективными, а какие должны |
с ретроградным направлением движения — в арте- |
|||||||||||||
применяться, скорее, в безвыходной ситуации, |
рию с относительно малым перфузионным дав- |
|||||||||||||
когда хирурги не имеют возможности восста- |
лением и, наконец, в артерию или вену воспри- |
|||||||||||||
новить венозный возврат от пересаженных |
нимающего ложа. |
|
||||||||||||
тканей в его классическом варианте. Тем не |
По данным ряда исследователей, значитель- |
|||||||||||||
менее уже сейчас ясно, что малоберцовый |
ную роль в перфузии пересаженных тканей |
|||||||||||||
костный «артериальный» лоскут может быть |
могут играть и артериовенозные шунты как |
|||||||||||||
успешно применен, а сокращение объема мик- |
путь перетока крови из артериального русла в |
|||||||||||||
рососудистого |
этапа |
операции |
значительно |
венозное и обратно [6, 19, 24]. В данном случае |
||||||||||
уменьшает ее продолжительность. |
|
|
кровь может двигаться из вен через шунты в |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
артерию с относительно меньшим давлением, |
|||
|
|
|
|
|
|
|
|
|
|
|
а затем в сосуд воспринимающего ложа. |
|||
6.2.2. «АРТЕРИАЛЬНЫЙ» ЛОСКУТ С ОТТОКОМ КРОВИ |
Есть все формально-логические основания |
|||||||||||||
|
В ВЕНОЗНОЕ РУСЛО (ОТВОДЯЩАЯ |
|
|
считать, что эффективность «работы» этого |
||||||||||
АРТЕРИОВЕНОЗНАЯ ФИСТУЛА ИЛИ АРТЕРИАЛИЗАЦИЯ |
механизма гемоциркуляции в первую очередь |
|||||||||||||
ВЕНОЗНОГО РУСЛА ВОСПРИНИМАЮЩЕГО ЛОЖА ДЛЯ |
зависит от градиента перфузионного давления |
|||||||||||||
|
ОБЕСПЕЧЕНИЯ СБРОСА КРОВИ) |
|
|
на входе и на выходе из лоскута. Чем больше |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
расстояние между «входом» и «выходом» арте- |
|||
Данный |
вариант |
пересадки |
«артериального» |
рии лоскута, тем больше и разница в давлении. |
||||||||||
лоскута предусматривает анастомозирование од- |
Следовательно, более благоприятны и условия |
|||||||||||||
ного из концов артерии комплекса тканей с |
для перфузии капиллярного русла. |
|||||||||||||
артерией, а другого — с веной воспринимающего |
Однако при пересадке малоберцовой кости |
|||||||||||||
ложа. Подобное вмешательство было впервые |
длина отрезка артерии трансплантата невелика |
|||||||||||||
выполнено |
A. Smith |
|
и соавт. |
в |
1983 |
г. при |
и возможности для возврата крови на протя- |
|||||||
реплантации пальцев кисти [31]. В связи с |
жении |
небольшого расстояния |
минимальны. |
|||||||||||
отсутствием подходящих для анастомозирования |
Поэтому реальнее предположить, что в этом |
|||||||||||||
вен хирурги накладывали артериовенозную фи- |
случае значительную роль в выживании тканей |
|||||||||||||
стулу между свободной парной артерией реплан- |
могут |
сыграть следующие факторы. |
||||||||||||
тированного пальца и веной воспринимающего |
Устойчивость тканей к острой ишемии. Как |
|||||||||||||
ложа (через аутовенозную вставку) (рис. 6.2.2). |
известно, на конечностях наибольшей устой- |
|||||||||||||
Хорошие результаты операций этого типа сви- |
чивостью к острой ишемии обладает костная |
|||||||||||||
детельствуют |
об |
их |
перспективности. |
|
|
ткань, а наименьшей — мышечная. По-видимо- |
||||||||
Возможные |
механизмы |
кровообращения |
в |
му, именно эта особенность позволяет переса- |
||||||||||
тканях при притоке и оттоке крови только через |
женной кости сохранять жизнеспособность на |
|||||||||||||
артериальную сеть представлены на схеме 6.2.1. |
протяжении того периода, в течение которого |
|||||||||||||
Можно |
предположить, |
что |
возможности |
устанавливаются связи между сосудами транс- |
||||||||||
перфузии капиллярного русла |
«артериального» |
плантата и воспринимающего |
ложа (первые |
|||||||||||
КРОВООБРАЩЕНИЕ ПРИ АТИПИЧНЫХ ВАРИАНТАХ ВКЛЮЧЕНИЯ ТКАНЕЙ В КРОВОТОК |
67 |
Схема 6.2.1. Схема вероятных путей движения крови в «артериальном» лоскуте при ее сбросе в артерию или вену воспринимающего ложа.
4—5 сут). Параллельно с их образованием восстанавливаются и обычные пути оттока.
Отток крови через костно-мозговой канал.
Возможен ли он и в какой степени, пока точно не установлено. Н.-С. Chen и соавт. (1991) считают такую возможность реальной на основании пересадки «артериального» малоберцового кожно-костного лоскута с участком кожи размерами 12x7 см. Концы малоберцовой кости были внедрены в костномозговое пространство большеберцовой кости с внеочаговой фиксацией внешним аппаратом. Лоскут прижил с краевым некрозом, площадь которого составила около 50% от площади комплекса тканей
[10].
Однако, с нашей точки зрения, этот путь вряд ли способен сыграть существенную роль в сохранении жизнеспособности костной части трансплантата. Это подтверждается сохранением рентгенологических признаков репаративного остеогенеза, характерных для живой кости, при внутрикостной фиксации малоберцового трансплантата металлическим гвоздем, когда интрамедуллярная сосудистая сеть разрушается.
Сброс крови в рану и повязку. Данный путь обеспечения венозного оттока представляется наиболее значимым. Его возможности доказаны при реплантации дистальных отделов пальцев кисти, когда при невозможности сшивания вен отток крови осуществляется через специально нанесенные на коже или ногтевой пластинке отверстия [14].
При пересадке относительно крупных комплексов тканей этот путь также может иметь практическое значение, хотя перспективы его
использования резко ухудшаются по двум причинам. Во-первых, сброс крови в герметизированную pairy приводит к формированию гематомы с последующим развитием осложнений. Кровотечение же наружу возможно только при включении в трансплантат кожно-фасциалыюго лоскута, вероятность гибели которого при нарушенном венозном оттоке остается весьма высокой.
Кроме того, наружное кровотечение быстро приводит к развитию анемии и по этой причине может допускаться лишь в весьма ограниченном объеме.
Значительно более благоприятные условия создаются при реплантации пальцев с наложением отводящей артериовенозной фистулы, когда расстояние между «входом» и «выходом», а также длина эффективно функционирующих звеньев сосудистого русла трансплантата более велики. При этом создаются условия и для выживания значительных участков мягких тканей.
6.3. ПИТАНИЕ ТКАНЕЙ ПРИ СКВОЗНОМ ВЕНОЗНОМ КРОВОТОКЕ БЕЗ АРТЕРИАЛЬНОГО ПРИТОКА. «ВЕНОЗНЫЙ» ЛОСКУТ
В 1985 г. S.-M. Baek и соавт. опубликовали сообщение о возможности сохранения жизнеспособности кожно-фасциального лоскута (в эксперименте на собаках) за счет сквозного венозного кровотока (рис. 6.3.1). Авторы отмечали развитие гиперемии лоскутов, которая появлялась через 2 ч после выделения комп-
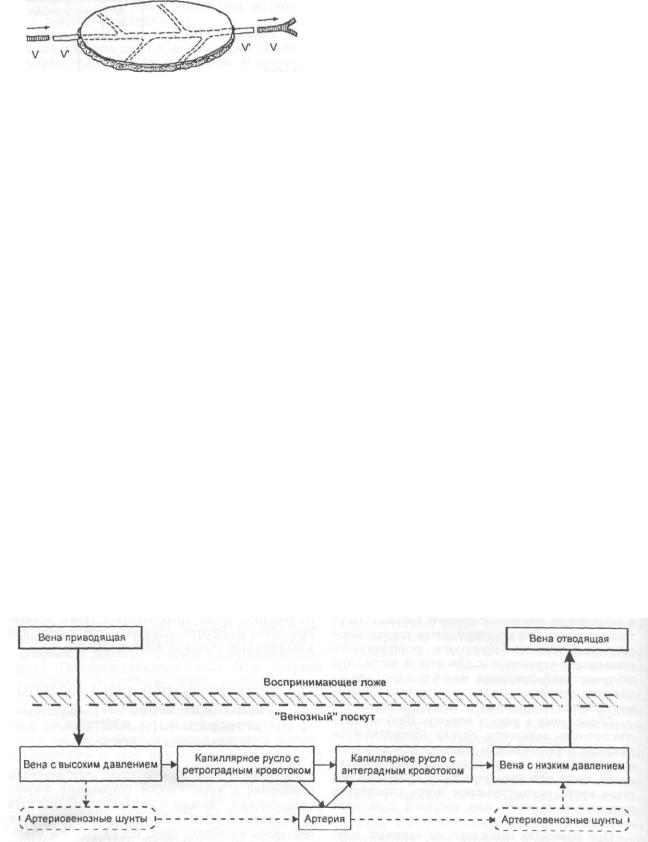
68
Рис. 6.3.1. Схема включения в кровоток «венозного» лоскута.
V— вены воспринимающего ложа; V — вены лоскута (объяснение в тексте).
лекса тканей на подкожной вене и сохранялась в течение первой недели. При этом артериовенозная разница по кислороду в «венозном» лоскуте была в сравнении с контролем значительно выше начиная уже с первых часов после операции с максимально выраженными различиями к 10—14-му дню. Значения рН тканей существенно не различались [5].
Показатели кровотока в тканях «венозного» лоскута колебались у разных собак от 2 до 6 мл/мин при 3—10,5 мл/мин в артериовенозном лоскуте (контроль). В последующем рядом хирургов была доказана возможность эффективного использования «венозного» лоскута для пластики дефектов кожи на тыле пальцев при их реплантации [38].
Еще больше вопросов возникло по поводу сообщения R.Thatte и M.Thatte, которые продемонстрировали в эксперименте и в клинике возможность выживания островковых кожнофасциальных лоскутов на центральной (!) венозной ножке [34, 35]. Рассмотрим возможные механизмы кровообращения в «венозных» лоскутах в двух основных ситуациях.
Сквозной венозный кровоток через лоскут.
При транзитном прохождении крови через вены кожно-фасциального лоскута перфузия капиллярного русла может обеспечиваться за счет градиента давления между «входом» в его сосудистую систему и «выходом» из нее (схема 6.3.1). Это может быть обеспечено за счет движения крови из капиллярно-венулярной
ОБЩИЕ ВОПРОСЫ
зоны с большим давлением в капиллярно-ве- нулярную зону с меньшим давлением при изменении направления капиллярного кровотока с ретрона антеградное и затем через вену с более низким давлением в вену воспринимающего ложа.
Можно предполагать и то, что часть крови через капиллярное русло попадает в артериальную систему и затем возвращается в венозную. При открытых артериовенозных шунтах заброс крови в артериальную часть сосудистого русла может усилиться.
В пользу последнего говорит факт развития гиперемии «венозного» лоскута лишь через 2 ч после его выкраивания [5]. Вероятно, это происходит вследствие открытия артериовенозных шунтов и увеличения емкости сосудистого русла в ответ на постепенное развитие метаболического ацидоза (по типу реактивной гиперемии тканей после снятия жгута).
Лоскуты на центральной венозной ножке.
Если сохранение жизнеспособности островкового «венозного» лоскута обеспечивается через вигу, то через этот единственный сосуд должен осуществляться и приток и отток крови в двух взаимно противоположных направлениях. Возможно ли это?
G.Foucher и R. Norris (1988) пересадили кожно-жировые лоскуты с тыльной поверхности пальцев кисти на центральной венозной ножке у 23 больных и получили полное приживление пересаженных тканей у всех пациентов. Средняя площадь лоскутов составила 3,2 см2. Данный опыт свидетельствует о том, что рассматриваемый вариант питания тканей заслуживает пристального внимания, тем более что в 8 случаях вся клетчатка вокруг питающей вены была тщательно иссечена [15].
Еще более впечатляют данные R.Thatte и M.Thatte (1989). У 8 пациентов с дефектами тканей нижних конечностей они успешно пересадили «венозные» островковые лоскуты на центральной ножке. Размеры комплексов тканей колебались от 10x4 до 18x6 см. Частичный
Схема 6.3.1. Схема возможных направлений движения крови в «венозном» лоскуте.
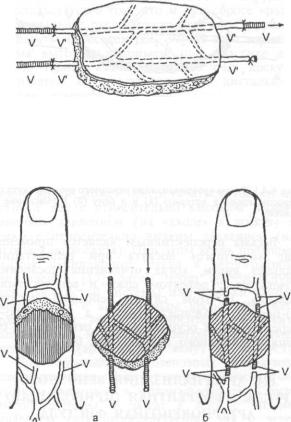
КРОВООБРАЩЕНИЕ ПРИ АТИПИЧНЫХ ВАРИАНТАХ ВКЛЮЧЕНИЯ ТКАНЕЙ В КРОВОТОК |
69 |
некроз |
дистальной |
части лоскута наступил |
|
в |
двух |
наблюдениях, |
полный некроз — только |
в |
одном [36]. |
|
|
По мнению этих же хирургов, в сохранении жизнеспособности такого лоскута может сыграть важную роль относительная устойчивость фасции и жировой ткани к острой ишемии. Авторы не исключают и возможность попеременного тока крови в двух разных направлениях, например, при перемене положения конечности по отношению к туловищу [35].
М е х а н и з м ы п и т а н и я «венозного» лоскута. Значительная частота краевых некрозов при пересадке венозных лоскутов свидетельствует о том, что питание пересаженных тканей обеспечивается на пределе допустимых для них метаболических нарушений. По данным клинических и экспериментальных исследований, при данном варианте включения тканей в кровоток удельный вес различных источников их питания существенно изменяется.
Так, если при обычной пересадке кровоснабжаемои) лоскута обмен веществ в основном обеспечивается прохождением хорошо оксигенированной крови через капиллярное русло, то при пересадке «венозного» лоскута значительно возрастает роль тех путей питания, которые в нормальных условиях являются второстепенными. К ним относятся диффузия крови через стенку венозных сосудов, возможность которой доказана [21, 23], а также диффузия из тканей воспринимающего ложа. Последнее подтверждают проведенные нами экспериментальные исследования, которые показали, что изоляция тканей лоскута от донорского ложа с помощью полимерной пленки приводит к существенному возрастанию площади некроза ткани [2].
Оценивая с клинических позиций перспек- |
|
тивы использования «венозного» лоскута, сле- |
|
дует подчеркнуть, что, несмотря на свое |
|
основное |
преимущество — возможность пере- |
садки без вмешательства на артериальных |
|
сосудах,— «венозный» лоскут в связи с низким |
|
уровнем его питания весьма чувствителен к |
|
различным |
факторам, роль которых пока еще |
точно не определена.
Жизнеспособность «венозных» лоскутов существенно возрастает при введении антигипоксантов [1]. Некоторые данные указывают на то, что положительную роль играет и увеличение перфузионного давления в вене. Все это позволяет выделить основные факторы, способные повысить жизнеспособность «венозных» лоскутов. К ним относятся:
1)хорошее развитие венозной сети лоскута;
2)его относительно небольшие размеры;
3)хорошее кровоснабжение тканей воспринимающего ложа;
4)отсутствие гематомы под лоскутом;
5)отсутствие натяжения на линии кожных швов, а также давления на ткани лоскута повязкой;
Рис. 6.3.2. Схема подключения «венозного» лоскута к двум приводящим и лишь одной отводящей венам (объяснение в тексте).
Стрелки указывают направление кровотока; V — вены воспринимающего ложа; V — вены лоскута.
Рис. 6.3.3. Схема включения «венозного» лоскута в кровоток при реплантации пальца кисти.
а — положение трансплантата до вшивания в дефект (стрелки указывают направление кровотока в соответствии с расположением венозных клапанов); б — после вшивания.
6)применение антигипоксантов;
7)повышение напряжения кислорода в крови (оксигенобаротерапия — ОБТ);
8)повышение перфузионного давления в венозном русле за счет увеличения гидростатического давления в тканях (опущенное или промежуточное положение конечности по отношению к туловищу и определенная архитектоника создаваемого с помощью микрососудистых анастомозов сосудистого русла).
Последнее может быть достигнуто путем подключения к венам лоскута двух приводящих вен и лишь одной отводящей (рис. 6.3.2).
Необходимо подчеркнуть, что клиническое освоение «венозного» лоскута только начинается. Пока еще остаются неясными такие важные вопросы, как оптимальная архитектоника венозного русла лоскута, наиболее выгодное расположение его основной питающей магистрали, ее диаметр и т. д. Однако уже сейчас клинический опыт свидетельствует о перспективности этого варианта пересадки тканей. Есть основания полагать, что наиболее жизнеспособными являются «венозные» лоскуты, взятые с ладонной поверхности предплечья в его нижней трети.
