

Вторичная структура белка
Первичная |
α-спираль |
β-структура |
структура |
|
|
Вторичная структура

β-структура
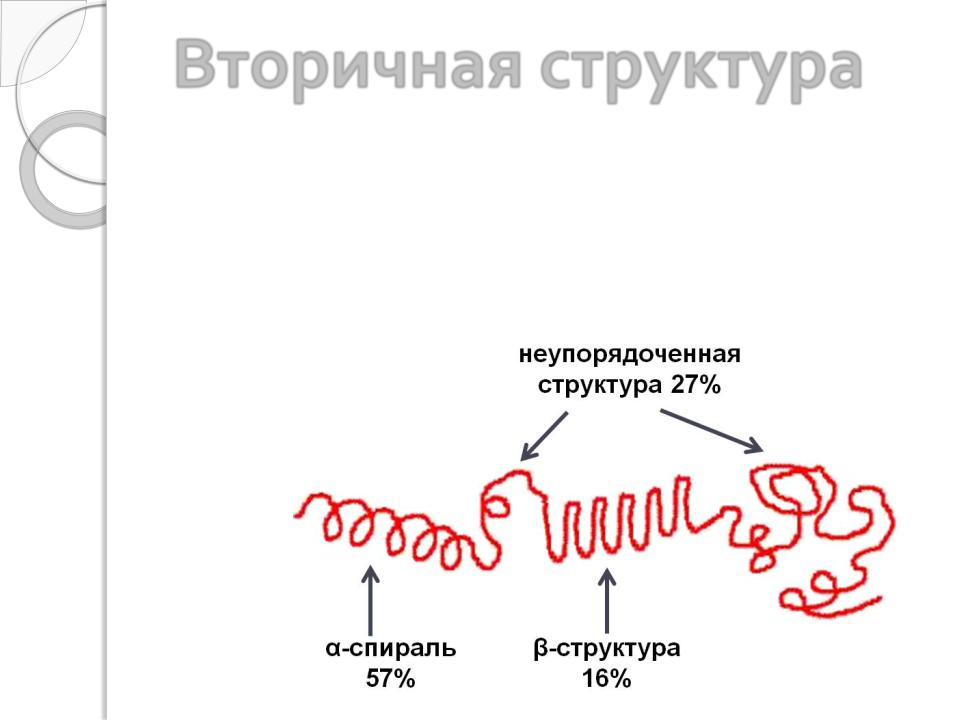
Вторичная структура
Практически во всех белках наряду с α-спиралями и (или) β- структурами присутствует также неупорядоченная (неорганизованная) структура, которая позволяет белковой молекуле сформировать пространственную – третичную – структуру . Соотношение разных типов вторичной структуры зависит от типа белка и индивидуально для каждой белковой молекулы . В среднем:

Формирование третичной структуры белка
неорганизованная неорганизованная структура структура (в местах
изгиба молекулы)

Третичная структура – пространственная ориентация полипептидной цепи (способ укладки полипептидной цепи в определённом объеме). При формировании третичной структуры гидрофильные радикалы аминокислот ориентированы наружу (к воде), а гидрофобные «спрятаны» внутри. Однако часть гидрофильных радикалов всё-таки оказывается внутри, а гидрофобные снаружи, т.е. на поверхности глобулы возникает так называемая «мозаичность» – чередование гидрофильных и гидрофобных участков

Форма белковых молекул
Глобулярные (шарообразные)
Фибриллярные (нитевидные)
фибрилла
глобула

Связи, характерные для третичной структуры
|
|
2 |
1 |
4 |
1 |
|
3
2 2
5
1 – ионные,
2 – гидрофобные,
3 – дипольдипольные, 4 – водородные,
5 – дисульфидные

Денатурация
Денатурацией называется процесс разрушения структурной организации белковой молекулы до первичной структуры под действием температуры, действием сильных кислот и щелочей, солей тяжѐлых металлов, некоторых растворителей (спирт), радиации и др. Денатурация происходит из-за разрушения слабых связей, удерживающих третичную и вторичную структуры. При денатурации изменяются физико-химические свойства белка:
-снижается растворимость белка, т.е. белок выпадает в осадок, -изменяются оптические свойства раствора,
-увеличивается вязкость раствора.
Белок теряет биологическую активность
В большинстве случаев денатурация – необратимый процесс

Доменное строение глобулярных белков
Если полипептидная цепь белка состоит из более чем 200 аминокислотных остатков, формируются домены. Домен – часть
полипептидной цепи, сходная с самостоятельным глобулярным белком. Каждый домен выполняет самостоятельную функцию в общей функции белка. Например, в межклеточном веществе присутствует
 домены фибронектина
домены фибронектина
белок фибронектин, задача которого состоит в связывании компонентов межклеточного матрикса (коллагена, эластина, протеогликанов) между собой и с клеточными структурами. Каждый домен фибронектина взаимодействует с определёнными веществами, выполняя свою функцию.

Четвертичная структура –
объединение отдельных полипептидных цепей, обладающих одинаковой (или разной) первичной, вторичной или третичной структурой, в единое структурно-функциональное макромолекулярное образование (олигомер, мультимер). Белки, имеющие четвертичную структуру, называются олигомерными, а каждая отдельная полипептидная цепь – мономером, протомером или субъединицей.
Типы связей: ионные, водородные, гидрофобные взаимодействия.
