
книги из ГПНТБ / Новиков, И. И. Теория термической обработки металлов учебник
.pdfского зародыша, уменьшается, если поверхностная энергия на границе зародыша с включением меньше, чем с материнской фа зой. Это более вероятно в том случае, когда решетка включения изоморфна решетке зародыша.
Включения могут ускорять зарождение не только непосредст венно, но и через образование дислокаций. Из-за разницы в тер мических коэффициентах расширения включений и матрицы при термической обработке вокруг включений могут возникнуть такие напряжения, что в материнской фазе генерируются дислокации, на которых может предпочтительно зарождаться новая фаза.
При затвердевании расплава образование центров кристалли зации на более тугоплавких включениях является основным меха низмом гетерогенного зарождения. При превращениях же в твер дом состоянии зарождение непосредственно на поверхности вклю
чений играет, как правило, второстепенную |
роль |
по |
сравнению |
с зарождением на разного рода дефектах |
решетки |
(границах |
|
зерен, субграницах, дислокациях), число которых |
и |
протяжен |
|
ность обычно намного больше, чем включений. |
|
|
|
5. Зарождение в микронесплошностях
На поверхности усадочных и газовых микропор, микротрещин и других несплошностей, возникающих по границам и внутри зерен при кристаллизации, пластической деформации и термичес кой обработке, а также на открытой поверхности изделия, зарож дение новой фазы может быть сильно облегчено, так как здесь отсутствует упругое сопротивление сплошной среды возникнове нию в ней кристаллов с другим удельным объемом. Эти места предпочтительного зарождения особенно эффективны, когда сла гаемое A-Fynp в формуле (25) велико. Примерами являются за рождение графита в микронесплошностях аустенита и превраще ние белого олова в серое, начинающееся с открытой поверхности образца.
* * *
Если новая фаза отличается от исходной по химическому со ставу, то росту ее зародышей на свободной поверхности способст
вует |
поверхностная |
диффузия, |
которая |
идет |
намного быстрее, |
|||
чем граничная, и тем более быстрее, |
чем объемная. Например, у |
|||||||
серебра энергия |
активации |
поверхностной |
диффузии QnoB = |
|||||
= |
10 300 кал/г-атом, в то время как Qrp—20 200 кал/г-атом. При |
|||||||
700°С коэффициент диффузии по границам зерен |
серебра Дгр= |
|||||||
= |
87 |
-10-8 см2/е, а коэффициент |
поверхностной |
диффузии Daoв= |
||||
= |
83 |
-10-5 ем2/с, т. е. в 103 раз больше. |
и |
характер |
их распределе |
|||
|
Дисперсность частиц новой фазы |
|||||||
ния по объему сплава при гетерогенном зарождении определяют ся числом и расположением мест предпочтительного зарождения. В отличие от гомогенного зарождения центры фазового превра щения при гетерогенном зарождении могут быть резко неод-
140
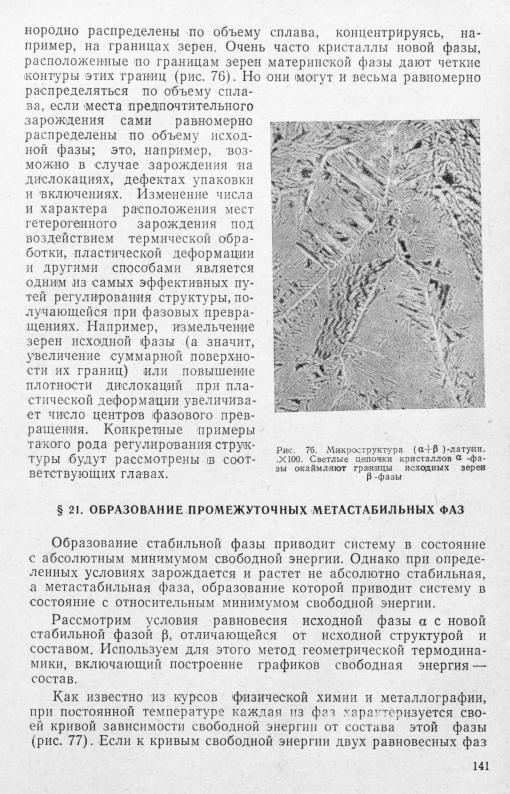
провести общую касательную, то точки касания (а и Ь) укажут составы равновесных фаз при данной температуре. В общем слу чае эти составы не отвечают точкам минимума на рассматривае мых кривых, так как условием гетерогенного равновесия в систе ме, состоящей более чем из одного компонента, является не дос тижение минимума свободной энергии каждой из фаз, а равенство
производных их свободной энергии по концентрации1: |
д F |
__ Е — |
д Fa
=-- - р . Из этого вытекает, что в точках, соответствующих соста-
ОС/
вам равновесных |
фаз, наклон |
касательных, характеризующийся |
„ д F |
, одинаков, т. |
е. через эти точки можно провести |
производной у у |
общую касательную к кривым свободной энергии равновесных фаз.
Рис. 77. Диаграмма состояния (а) |
Рис. 78. Схема к |
анализу равновесия |
а-фазы |
со |
и зависимость свободной энергии |
стабильной 0- и -метастабильными 0'- |
и 0” -фазами |
||
от состава при температуре 7 (б) |
|
|
|
|
Свободная энергия смеси фаз — всегда |
величина аддитивная |
к |
||
изображается точками на прямой, связывающей значения свобод ной энергии равновесных фаз. Следовательно, любая точка на от резке ab, например Fi (рис. 77,6), указывает свободную энергию’ смеси равновесных фаз с составами в точках а и b (поверхностная энергия межфазных границ здесь не учитывается).
Участок fa на кривой свободной энергии |
a-фазы относится к |
||
той области |
составов |
a-фазы (от А до Са), |
где она при данной |
температуре |
стабильна, |
а участок ag — где |
она метастабильна, |
В последнем случае свободная энергия a-фазы больше, чем у сме
си фаз а+(3 того же состава (например, в сплаве С0 |
F2> Fx). Ес |
ли состав a -фазы находится правее точки Са, то из |
нее должна |
1 Концентрация выражена в атомных долях. |
|
142
образовываться p-фаза до тех пор, пока состав исходной фазы не достигнет равновесного (Са). Если же состав a-фазы расположен левее точки Са и в контакте с ней находится p-фаза, то последняя будет растворяться в a-фазе до тех пор, пока не будет достигнут равновесный состав Са.
Допустим, что в какой-то системе не только существует ста бильная фаза, но и возможно в определенных условиях образова ние метастабильных фаз р' и р", свободная энергия которых выше, чем у p-фазы (рис. 78). Метастабильная фаза р' отличается от стабильной только структурой, а фаза р" и структурой, и составом.
Встабильном равновесии с p-фазой находится a-фаза состава С„.
Вметастабильном равновесии с фазами р' и р" находится а-фаза составов С' и С" соответственно. Можно сделать общий вывод,
что растворимость метастабильной фазы в другой фазе всегда вы ше растворимости стабильной фазы.
В сплаве состава С0 свободная энергия смеси фаз а + р мень ше, чем у смесей фаз а + Р / или а+ Р " (F\ < F 2< . F 3) ■Отсюда мож но сделать вывод, что снижение свободной энергии (при образова нии стабильной фазы больше, чем при образовании метастабиль ной фазы (Fa—F i)> (F i—F2) и (Е4—F i) > ( / 74—F3). Однако этот анализ не учитывает роли поверхностной энергии (на рис. 78 пред ставлен график зависимости от состава объемной свободной энер гии). Вместе с тем, как показано в § 18, поверхностная энергия может играть решающую роль на первых этапах образования кристаллов новой фазы, когда велико отношение их поверхности к объему и соответственно велик вклад поверхностной энергии в общую свободную энергию кристалла.
Значения поверхностной энергии на границах a-фазы с фазами Р, р' и р" могут очень сильно различаться. Допустим, что кристал лическая решетка стабильной p-фазы резко отличается от решет ки исходной a-фазы и поэтому когерентная граница не может возникнуть. В то же время структура метастабильных фаз р' и Р" ближе к структуре исходной a-фазы и межфазные границы а/р' и а/p" могут быть когерентными или полукогерентными. Поверх ностная энергия на таких границах намного ниже, чем на некоге рентной границе а/p. В случае, когда граница а/р' или а/p" также некогерентна, поверхностная энергия на ней все же ниже, чем на границе а/p, так как кристаллы фаз а и р 7 (или р") могут грани чить по плоскостям с более близким строением, чем кристаллы а- и р-фаз.
Если выигрыш в поверхностной энергии существенно перекроем проигрыш в объемной свободной энергии, то тогда, согласно фор муле (25), работа образования критического зародыша АЕкр мета стабильной фазы будет ниже, чем у стабильной, и скорость зарож дения -метастабильной фазы в соответствии с выражением (24) бу дет выше. В случае когерентной или полукогерентной границ метастабильных фаз для уменьшения ДFKp выигрыш в поверхностной энергии должен также перекрывать возрастание упругой энергии, связанной с такими границами.
143
Если в системе могут существовать разные метастабпльные фазы, то при данной степени переохлаждения с увеличением вре мени выдержки вначале из-за большей скорости зарождения бу дет образовываться метастабильная фаза, у которой минимальна работа образования критического зародыша. Затем появятся метастабильные фазы с большей энергией образования критического зародыша и в последнюю очередь появится стабильная фаза, так как энергия активации ее образования самая высокая и, следова тельно, скорость зарождения самая низкая.
Таким образом, последовательность образования фаз регули руется не достигаемым уровнем объемной свободной энергии, а величиной энергетического барьера при зарождении новой фазы,
который сильно зависит от поверхностной энергии на межфазной границе. Чем больше указанный барьер, т. е. больше энергия ак тивации образования критического зародыша, тем позднее обра зуется соответствующая фаза. Эта закономерность называется
«правилом ступеней».
Когда после образования фазы р" появляется относительно более стабильная фаза (Т, то около ее кристаллов в исходной a -фазе устанавливается равновесная концентрация С'. Эта кон центрация меньше предела растворимости С" ранее образовав шейся р" -фазы и поэтому фаза р" должна растворяться. Анало гично при появлении стабильной фазы р должна растворяться фаза р'. Это соответствует общему правилу: образование более стабильной фазы приводит к растворению ранее образовавшейся менее стабильной фазы, которую обычно называют промежуточ ной. В конце концов система может прийти к состоянию, характе ризующемуся абсолютным минимумом свободной энергии.
Образованию промежуточной фазы может способствовать так же концентрационный фактор. Если стабильная фаза резко отли чается по химическому составу от исходной, то для ее зарождения требуются большие флуктуации концентрации, а для ее роста не обходим сравнительно большой диффузионный массоперенос. Ес ли в этой же системе возможно существование метастабильной фазы, которая намного ближе по составу к исходной, то ее обра зование кинетически более выгодно особенно при больших пере охлаждениях, когда замедлены диффузионные процессы.
Классическим примером является образование из аустенита метастабильного цементита вместо стабильного графита. Состав аустенита (не более 2,14%'С) гораздо ближе к цементиту (6,67%'С), чем к графиту (100%С). Вполне очевидно, что вероят ность концентрационных флуктуаций, необходимых для зарожде ния цементита, несравненно больше вероятности концентрацион ных флуктуаций, необходимых для зарождения графита. Скп рость диффузионного роста кристаллов цементита также выше, чем графита. Кроме этого концентрационного фактора, зарожде нию цементита способствует и структурный фактор: цементит ближе по структуре к аустениту, чем графит, и поверхностная энергия на его границе с аустенитом должна быть ниже.
144
§ 22. К И Н Е Т И К А |
Ф А З О В Ы Х П Р Е В Р А Щ Е Н И Й |
|
Кинетика кристаллизационных процессов в твердом состоянии |
||
определяется двумя параметрами — скоростью |
зарождения цент |
|
ров превращения и линейной |
скоростью роста |
из этих центров. |
Как было показано выше, оба параметра кристаллизации зависят от степени переохлаждения или перегрева.
Кинетика фазового превращения при определенном переох лаждении или перегреве изображается кинетической кривой, ко торая показывает нарастание количества новой структурной со ставляющей во времени (рис. 79).
Кинетическую кривую для превращения, протекающего прд охлаждении, строят следующим путем. Образец нагревают до температуры выше точки фазового равновесия. |При этой темпера туре он может сколь угодно долго находиться в исходном фазовом состоянии. Затем образец быстро пе реносят в термостат с температурой ниже точки фазового равновесия, т. е.
температура термостата соответствует определенной степени переохлаждения. Термостатом может служить соляная или масляная 'ванны, а также ванна из расплавленного металла.
Образец должен быть тонким, что бы он мог быстро принять температу ру термостата. За степенью превраще ния в образцах, находящихся в тер:мостате, следят по изменению каких-ли бо свойств, например магнитных или электрических. Можно также закали вать образцы из термостата через оп ределенные промежутки времени и из мерять свойства или изучать микро структуру закаленных образцов при комнатной температуре.
Аналогичным путем строят кинети ческие кривые для превращений, про текающих при нагревании. В этом слу
чае образец с исходной температуры, которая ниже точки фазово го равновесия, быстро переносят в термостат с температурой, со ответствующей определенной степени перегрева.
Все изотермические кристаллизационные процессы характери зуются следующей кинетикой (рис. 79). Вначале объем, испытав ший превращение, растет с ускорением, а к концу превращения приращение этого объема резко замедляется. Таким образом, при постоянной температуре истинная объемная скорость превраще ния меняется в процессе самого превращения. Для каждого мо мента времени истинная объемная скорость превращения опреде ляется графически по тангенсу угла наклона касательной к кине тической кривой.
145
Низкая объемная скорость в начальный период объясняется небольшим числом образовавшихся центров превращения и малой поверхностью новой структурной составляющей. Постепенно на растает число центров, увеличиваются размеры новой составляю щей и суммарная поверхность фронта кристаллизации, поэтому объемная скорость превращения, пропорциональная площади этой поверхности, возрастает.
Однако эта скорость не может непрерывно возрастать со временем изотермической выдержки. Наступающее замедление процесса, особенно ярко выраженное к концу превращения, объясняется тем, что растущие кристаллы соприкасаются между собой и в (местах стыка рост их прекращается, т. е. поверхность фронта превращения sT уменьшается. Максимум истинной объемной скорости превраще ния соответствует точке перегиба на кинетической кривой и дос тигается примерно тогда, когда половина объема претерпела прев ращение. Теперь понятно, почему каждая степень переохлажде ния выше характеризовалась средней скоростью превращения (ем.
рис. 73).
В результате математического анализа кинетики фазовых пре вращений, выполненного А. Н. Колмогоровым и И. Л. Маркиным, получена следующая зависимость превращенного объема от вре мени превращения т при постоянных величинах с. з. ц. (п) и
.л. с. р. (с):
(29)
где К0 — начальный объем исходной фазы.
Эта формула соответствует характеру кривой на рис. 79, 1. При ее выводе предполагалось, что кристаллы новой фазы до мо мента соприкосновения одного с другим имеют сферическую форму.
В самый начальный период изотермической выдержки превра щения не наблюдается (отрезок оа на рис. 79).
Этот период называется инкубационным. Ранее предполага лось, что в инкубационный период собственно превращения не происходит, а внутри исходной фазы идет только подготовка к об разованию центров кристаллизации. Но математический анализ кинетики кристаллизации и тщательно поставленные опыты по казали, что превращение идет с самого начала изотермической выдержки. В инкубационный период количество образовавшихся новых кристаллов настолько мало, что превращение не фикси руется обычными методами исследования. Конец инкубационного периода (точка а на рис. 79) — это фиксируемое данным методом начало превращения. Чем чувствительнее метод исследования, тем раньше обнаруживается появление новой структурной состав ляющей.
Спрактической точки зрения ничтожная степень превращения
винкубационный период не принимается во внимание, поэтому вполне целесообразно говорить о конце инкубационного периода
146
как о начале превращения, |
всегда мысленно подразумевая, что к |
||||
«началу» превращения уже |
образовалось |
некоторое |
количества |
||
новой |
структурной |
составляющей. Например, начало |
эвтектоиц- |
||
Н 'ого |
превращения |
в стали |
фиксируется |
тогда, когда имеется |
|
0,5—1% перлита.
Кинетические кривые при различных степенях переохлаждения и перегрева представлены на рис. 80 и 81. В соответствии с зако-
Рие. |
81. Кинетические |
кривые при разных степенях |
перегрева: |
|||
|
|
|
Т , < Т г< Т 3< Г , < Т 5 |
|
|
|
номерностями, |
графически |
изображенными |
|
на рис. 71 и 73, вна |
||
чале с увеличением |
степени переохлаждения |
уменьшается инку |
||||
бационный период |
(oai> oa 2> o a 3 на рис. 80) |
и уменьшается вре |
||||
мя полного превращения |
(obi> ob2> o b 3) . |
Это |
объясняется тем, |
|||
что исходное фазовое состояние становится |
|
менее устойчивым. |
||||
При определенной степени переохлаждения |
достигается наимень |
|||||
ший инкубационный период (оа3). Дальнейшее увеличение пере
охлаждения |
приводит к возрастанию |
инкубационного периода |
||
(оаз<;оа4<;оа5) и увеличению времени |
полного |
превращения |
||
(ob3< o b 4< obs), так как уменьшается подвижность |
атомов. |
|||
С увеличением степени перегрева (рис. |
81) инкубационный пе |
|||
риод и время |
полного превращения |
прогрессивно |
уменьшаются |
|
147
(оа1> оа2> о а з > о а 4>оа5 |
и ob\> ob2> o b |
3'>obi >obb) , |
так как |
||
одновременно с уменьшением |
термодинамической |
устойчивости |
|||
исходного фазового состояния |
возрастает |
подвижность |
атомов |
||
(см. также рис. 74). |
|
|
|
|
|
Для решения многих |
вопросов термообработки |
не требуется |
|||
построения кинетических кривых. Достаточно знать величину ин кубационного периода и время полного превращения при разных температурах. Эти величины изображаются на диаграммах изо термического превращения. На рис. 82, а представлена диаграмма
превращения
б
Рис. 82. Диаграмма изотермического превращения, протекающего при переохлажде нии (а) и зависимость средней скорости превращения от степени переохлаждения (б). Г0 — температура фазового равновесия
изотермического превращения, которое происходит при переох лаждении. Эта диаграмма построена по кинетическим кривым, показанным на рис. 80. Отрезки на рис. 82, а, отложенные при соответствующих температурах по горизонтали от ординаты до точек а\, b1, а2, Ьъ и т. д., пропорциональны отрезкам оаи obu оа2, ob2 и т. д. на рис. 80.
Для построения диаграммы изотермического превращения со вершенно не обязательно предварительно строить кинетические кривые. Достаточно опытным путем при каждой температуре оп ределить время инкубационного периода и время полного превра щения. Для этого образец, нагретый до температуры выше Г0, быстро переносят в термостат с температурой ниже То и фиксиру ют время появления новой структурной составляющей и время исчезновения остатков исходной структуры.
Левая кривая а\ а2 а?, а4 as является кривой начала превраще ния, показывающей зависимость величины инкубационного перио да от степени переохлаждения. Правая кривая b[ b2 Ь2 Ь4 й5 является кривой конца превращения, показывающей зависимость времени полного превращения от степени переохлаждения. Обе кривые называются С-кривыми. Изгиб С-кривой соответствует максимальной скорости превращения (рис. 82,6).
148
Диаграмма изотермического превращения при перегреве пред
ставлена |
на |
рис. 83 |
(сравните с кинетическими |
кривыми на |
|
рис. 81). |
'Кривые а\ а2 аз а 4 аъ и Ьх Ь2 |
й4 Ь$ .показывают фиксируе |
|||
мые данным |
методом |
начало и конец |
превращения. |
При доста- |
|
Рис. 83. |
Диаграмма |
изотермического пре |
Рис. 84. Кривые начала превращения пе. |
||
вращения, протекающего при перегреве. |
реохлажденной фазы в изотермических уо |
||||
То — температура |
фазового равновесия |
ловиях (/) и при непрерывном |
охлажде |
||
|
|
|
|
нии (2) |
|
точно высокой температуре из-за |
большой |
подвижности |
атомов |
||
превращение протекает практически мгновенно. Поэтому |
кривые |
||||
начала |
и конца |
превращения сливаются |
и попадают |
на ось |
|
ординат. |
|
|
|
|
|
Впервые диаграмма изотермического распада аустенита в стали была построена в 1930 г. Бейном и Давенпортом. Метод изучения кинетики фазовых превращений с помощью подобных диаграмм, называемых также С-диаграммами или С-образными кривыми, оказался исключительно плодотворным в теории термической об работки. Число опубликованных диаграмм изотермических прев ращений переохлажденной фазы для сталей измеряется величиной порядка Ю3, для титановых 102, алюминиевых (построенных сов сем недавно) 102. С-диаграммы построены также для чугунов, не которых медных, урановых и других сплавов.
Широкому использованию диаграмм изотермических превраще ний способствует то, что они строятся в тех же координатах тем пература — время, в которых изображают режимы нагрева и ох лаждения при термической обработке.
С помощью С-диаграмм особенно удобно анализировать раз личные виды изотермических обработок, включающих ускоренное охлаждение и выдержку при постоянной температуре, например изотермический отжиг и изотермическую закалку (см. § 25 и 40). По С-диаграмме можно прямо определять время начала и конца превращения переохлажденной фазы при заданной температуре и в соответствии с поставленной задачей выбирать режим изотер мической обработки.
Более сложно по диаграмме изотермических превращений ана лизировать процессы фазовых превращений, протекающие при непрерывном охлаждении, а именно такие процессы и преобладают
149
