
Клиническое руководство по черепно-мозговой травме
28 Сепсис
Д. Гельмонт
28.1. Определения
Определение процесса, теперь известного как сепсис, вырабатывалось в течение последних 20 лет. В начальном периоде исследований, целью которых было описать всю последовательность событий воспалительного процесса, термины «септицемия» и «септический синдром» использовались как равнозначные, взаимозаменяющие понятия. Термин «септицемия» был определен как присутствие микроорганизмов или их токсинов в крови. Однако он не адекватно отражал весь спектр патогенных микроорганизмов — грибов, вирусов, паразитов, способных попадать в кровь и вызывать воспаление. Это также, исключало тех пациентов, результаты посевов у которых были отрицательны, но наблюдались те же воспалительные реакции (см. рис. 28-1). Использование данного термина в клинике и в медицинской литературе, все более и более добавляло путаницы и создавало трудности в интерпретации данных при их анализе [3,4]. В 1991, Американский Колледж Торакальных Врачей и Общество Реаниматологии (ACCP/SCCM) решили создать основу для лучшего понимания данного воспалительного феномена. Базой будущего исследования явилась форма установленного согласия, в которой были сделаны определения терминов, описывающих различные стадии воспалительной реакции (см. Таб. 1) [5]. Это создало общую отправную точку, которая позволила клиницистам и исследователям детальнее описывать пациентов в последующих клинических исследованиях.
С пониманием того, что воспаление может начинаться с причин, не являющихся инфекцией, то, что прежде оставалось неясным в определении сепсиса и септицемии, было выделено в термин «Синдром Системного Воспалительного Ответа
(ССВО)». Этот новый термин использовался для описания воспалительного процесса как результата сепсиса, так и неинфекционных причин. Клинические проявления воспалительного синдрома были названы ССВО критериями. Эти критерии включали в себя (но не ограничивались!) следующее: 1) гипертермия более 38°С или гипотермия менее 36°С; 2) частота сердечных сокращений более 90 ударов/мин; 3) тахипное более 20 дыханий/ мин., или РаСО2 меньше 32 mmHg; и 4) лейкоцитоз более 12,000/mm3, или лейкопения менее 4,000/ mm3; или количество нейтрофильных метамиело-цитов более 10 % [5]. Сепсис был определен как ССВО на инфекцию.
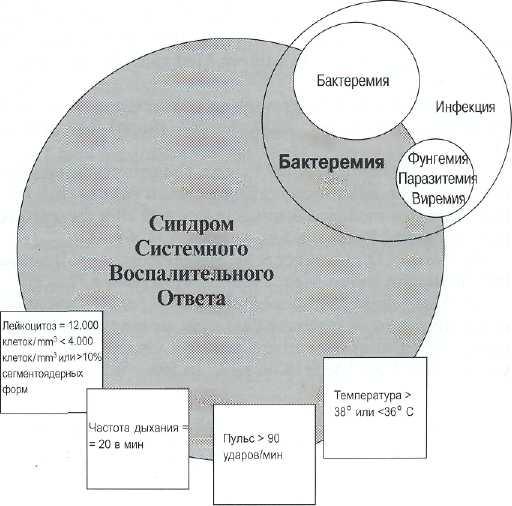
Рис. 28-1. Взаимоотношение инфекции, сепсиса, и синдрома системной воспалительной реакции (ССВО)
448
Сепсис
 Создание
нового термина ССВО подчеркнуло
фундаментальные
наблюдения, сделанные относительно
воспалительного процесса. Первое —
то, что нарушение
функций воспалительного характера
является
реакцией на основной стимул (таких как
инфекция или травма) и что поиск этой
причины является частью оценки пациента.
Второе наблюдение
— то, что воспалительная реакция
является системной, и воздействует
почти на каждый орган опосредовано
через сосудистый эндотелий, лейкоциты
и моноциты. И наконец, воспалительная
реакция
стимулирует выработку медиаторов с
широким
спектром специфических биологических
эффектов, заканчивающихся клиническими
признаками
синдрома [6] различной степени выраженности
и тяжести.
Создание
нового термина ССВО подчеркнуло
фундаментальные
наблюдения, сделанные относительно
воспалительного процесса. Первое —
то, что нарушение
функций воспалительного характера
является
реакцией на основной стимул (таких как
инфекция или травма) и что поиск этой
причины является частью оценки пациента.
Второе наблюдение
— то, что воспалительная реакция
является системной, и воздействует
почти на каждый орган опосредовано
через сосудистый эндотелий, лейкоциты
и моноциты. И наконец, воспалительная
реакция
стимулирует выработку медиаторов с
широким
спектром специфических биологических
эффектов, заканчивающихся клиническими
признаками
синдрома [6] различной степени выраженности
и тяжести.
Для описания континуума клинической и патофизиологической тяжести воспалительного процесса, были введены термины «сепсис», «тяжёлый сепсис» и «септический шок» (см. табл. 28-1). Часть объяснений правильного употребления этих новых терминов пришла из клинических исследований, таким образом каждая стадия, вероятно, будет иметь независимое прогностическое значение (например, смертность увеличивается по мере нарас-
тания тяжести сепсиса до септического шока). Термины «септический синдром» и «септицемия» рассматриваются как неоднозначные и вносящие путаницу, и поэтому, рекомендовано ими не пользоваться.
С появлением новых технологий мониторинга и лечения пациентов, стало очевидно, что причиной смерти больных в тяжелом состоянии было развитие прогрессирующей органной недостаточности. Термины типа «прогрессирующая или результирующая органная недостаточность» |7], «полиорганная недостаточность» [8] и «системная полиорганная недостаточность» [9] изначально подтолкнули к обозначению данного явления. Определения и критерии, используемые для описания этого процесса значительно отличались, что затрудняло анализ клинических исследований. ACCP/SCCM, в их форме установленного согласия в 1991 году [5J, рассмотрели проблему и ввели термин «синдром полиорганной недостаточности» (СПОН). Термин «недостаточность» имел более широкий смысл, чем просто «дисфункция», так как он отражал прогрессирующее ухудшение во времени. Данный термин также описывал состояние, в котором функция органа была нарушена настолько, что поддер-
Таблица 28-1
|
Инфекция Микробный феномен, характеризующийся воспалительным ответом на присутствие микроорганизмов или ивазию стерильной в норме ткани этими микроорганизмами. |
|
Бактериемия Наличие живых микроорганизмов в крови. Наличие вирусов, грибов, паразитов и др. в крови следует описывать в подобном же стиле (виремия, фунгемия, паразитемия и т.д.) |
|
Синдром системного Обширная воспалительная реакция с разнообразием клинических ответов. воспалительного ответа Признаки: (ССВО) Температура >38е С или < Збе С Пульс > 90 ударов/мин Частота дыхания = 20 в мин Лейкоцитоз = 12,000 клеток/ттЗ; < 4,000 cell/ттЗ, или > 10 % band forms. |
|
Сепсис Системный ответ на инфекцию. Присутствуют все клинические признаки ССВО при условии наличия инфекции. |
|
Тяжёлый сепсис Сепсис в сочетании с органной недостаточностью, гиполерфузией в результате лактоацидоза, олигоурии, или острые ментальные нарушения, или сепсис -индуцированная гипотензия, и др. |
|
Септический шок Сепсис-индуцированная гипотензия, рефрактерная к инфузионной терапии в сочетании с гипоперфузионными нарушениями или дисфункцией органов. |
|
Сепсис-индуцированная Систолическое АД < 90 mm Hg или падение сАД > 40 mm Hg от нормального гипотензия уровня, при условии отсутствия других причин снижения АД. |
449
Клиническое руководство по черепно-мозговой травме
 жание
гомеостаза становилось невозможным.
Также
были включены первичное и вторичное
подо-пределения
для дифференцировки, вызвана ли
дисфункция
органа прямым результатом четко
определённых
первичных повреждающих факторов (типа
пневмонии) или следствием реакции
организма
— вторичных повреждающих факторов
(например,
острого респираторного дистресс-синдрома
в
результате перитонита (см. табл. 28-2).
жание
гомеостаза становилось невозможным.
Также
были включены первичное и вторичное
подо-пределения
для дифференцировки, вызвана ли
дисфункция
органа прямым результатом четко
определённых
первичных повреждающих факторов (типа
пневмонии) или следствием реакции
организма
— вторичных повреждающих факторов
(например,
острого респираторного дистресс-синдрома
в
результате перитонита (см. табл. 28-2).
Таблица 28-2 Определение полиорганной недостаточости
|
Полиорганная Наличие изменения функции органе достаточ ость на у остро заболевшего пациента, до такой степени, что поддержание гомеостаза невозможно без постороннего вмешательства. Синдром полиорганной недостаточности также классифицируется на первичный и вторичный: • Первичный СПОН является результатом травмы того органа, нарушение функции которого возникает в первую очередь, и может быть напрямую с ней связано. • Вторичный СПОН — нарушение функции органа не в результате самого повреждения, а как следствие ответа макроорганизма. |
28.2. ВСТРЕЧАЕМОСТЬ
Было достаточно сложно определить реальную встречаемость сепсиса и его осложнений. Трудность заключалась в недостатке ясных и точных определений данного процесса, а также форм и способов сообщения об этом. В 1990 г. Центр по Контролю за Болезнями Соединенных Штатов (CDC) сообщил о встречаемости сепсиса в стационарах за период с 1979 по 1987 годы. Распространенность патологий за этот период, увеличилась с 73.6 до 175.9 на 100,000 человек, что составило прирост на 139 %. Однако, в результате неточности определения, использованного в этом сообщении, истинная встречаемость сепсиса была недооценена, так как в исследование не были учтены пациенты с клинической картиной сепсиса и отрицательными результатами посевов. По оценкам, в Соединенных Штатах, количество случаев сепсиса составляет приблизительно от 450,000 до 500,000
в год, и это число продолжает увеличиваться. Рост встречаемости произошёл во всех возрастных группах, хотя наибольший прирост отмечен в возрастной группе «старше 65 лет» (165 % — с 326.3 до 854.7 на 100,000). В итальянском исследовании сепсиса, сепсис, тяжёлый сепсис и септический шок составили соответственно 4.5%, 2.1% иЗ% всех госпитализаций в отделения интенсивной терапии и реанимации, а количество всех ССВО составило 52% [10].
Факторы, которые, возможна, лежали в основе увеличения встречаемости сепсиса в течение этого периода, были отнесены к следующим группам: 1) возросшее использование агрессивной химиотерапии у онкологических пациентов вместе с более частым применением иммуносупрессивных препаратов в трансплантологии, ревматологии (системная красная волчанка, ревматоидный артрит) и в лечении сосудистых заболеваний (гранулема-тоз Вегенера, синдром Гудпастур, полиартрит); 2) увеличение продолжительности жизни иммуносупрессивных пациентов, составляющих группу риска по инфекции; 3) неадекватная антибиотикотера-пия и антибиотикопрофилактика; 4) возросшее использование хронических внутрисосудистых устройств и протезов; 5) повышение квалификации врачей и их способности диагностировать сепсис.
28.3. ПАТОГЕНЕЗ
Патогенез сепсиса сложен, однако, наше понимание воспалительного каскада резко возросло за последние 2 десятилетия из-за беспрецедентного увеличения количества исследований на животных и у человека, направленных на изучение патофизиологии этого синдрома [11J. Важно помнить, что воспалительная реакция организма при инфекции не уникальна и может встречаться при других состояниях, таких как травма, панкреатит и ожоги.
28.3.1. Пусковые механизмы
Пусковым механизмом сепсиса является высвобождение грамм отрицательными бактериями эндотоксина, или ему подобного вещества (см. рис. 28-2) типа энтеротоксина, токсина-1 токсического шока, липоотеихоевои кислоты и пептидогликанов грамм положительных бактерий, вирусных частиц и грибковых антигенов. Наиболее исследованным пусковым фактором являлся эндотоксин — липополи-сахарид (LPS) который находится во внешней мембране всех грамм-отрицательных бактерий. Он
450
Сепсис

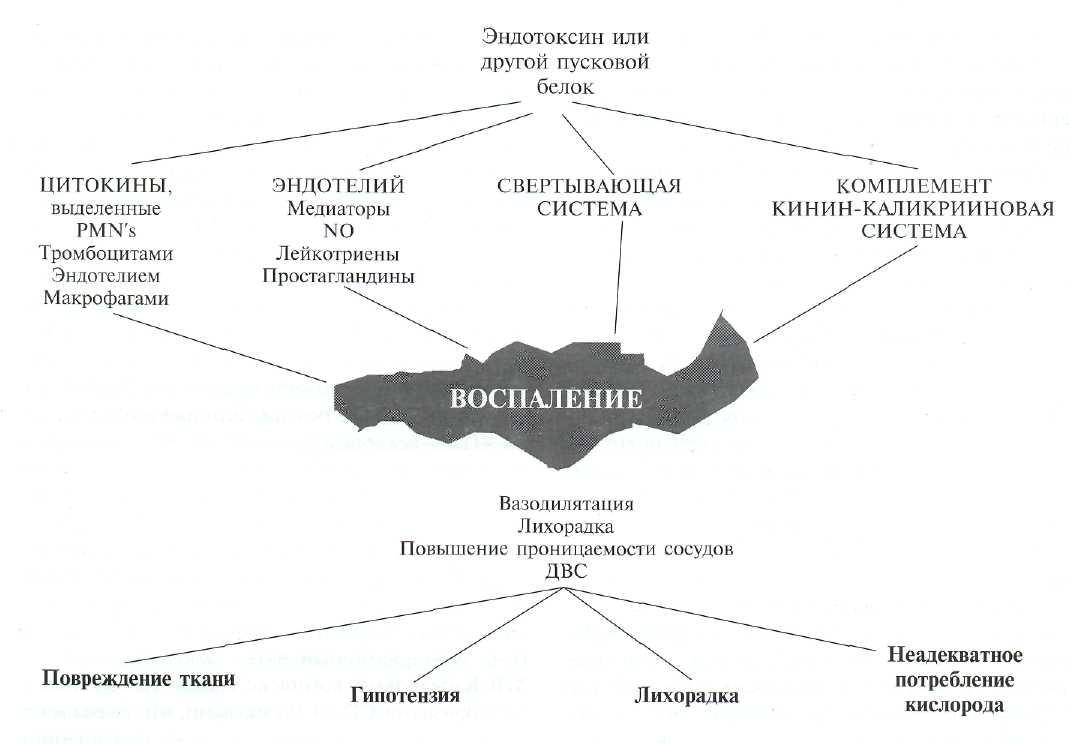
состоит из двух ядер — липидного (липид А) и полисахаридного, которые связаны с О-полисаха-ридной цепью. Эта О-полисахаридная цепь состоит из повторяющихся молекул сахара (разные у разных грамм-отрицательных бактерий).
Эндотоксин при попадании в кровь вызывает выброс эндогенных веществ, типа интерлейкинов и других полипептидов и пепидов факторов роста, как локально, так и на системном уровне. Эти эндогенные продукты вырабатываются лейкоцитами, эндотелиальными клетками, В-лимфоцитами, моноцитами/макрофагами, клетками-киллерами, фибробластами, клетками гладкой мускулатуры, эпителиальными клетками, гепатоцитами, керати-ноцитами и глиальными клетками. Эти клетки упомянуты в связи с важной ролью цитокинов в воспалении.
Цитокины являются растворимыми регулятор-ными полипептидами, которые действуют местно как связующее звено между клетками. Действие цитокинов может быть или аутоетимулирующее или опосредовано стимулирующее, оказывая аутокрин-ный или паракринный эффект на ткани. Их эф-феккт включает в себя «заправку» и активацию
фагоцитарных клеток, необходимых для индуцирования, развития и поддержания воспаления с целью устранения повреждающего фактора как причины. Цитокины являются плейотропными молекулами, способными вызывать различные эффекты в зависимости от окружающей гормональной среды. Время от времени системные эффекты цитокинов могут оказывать повреждающее влияние на макроорганизм. Повреждение макроорганизма обычно предотвращается в результате баланса между провоспалительными и противовоспалительными медиаторами. Провоспалительные медиаторы необходимы, чтобы сдержать и уничтожить инфекционные микроорганизмы. Противовоспалительные медиаторы необходимы, для ограничения воспаления в области инфекции и предотвращения повреждения макроорганизма. В случае отсутствия контроля, провоспалителъный ответ может «без разбора» повреждать нормальные ткани.
Цитокины присоединяются к определенным рецепторам на поверхности клеток-мишеней. Эти рецепторы связаны с внутриклеточным проведением сигнала и путями вторичных мессенджеров. Например, липополисахарид активирует митоген-
451
Клиническое руководство по черепно-мозговой травме
 активную
протеинкиназу (МАПК) и ядерный фактор
регуляции транскрипции кВ фактора
(ЯФРТкВ). Это,
в свою очередь, активирует специфические
гены
для выработки цитокинов или других
медиаторов
воспаления.
активную
протеинкиназу (МАПК) и ядерный фактор
регуляции транскрипции кВ фактора
(ЯФРТкВ). Это,
в свою очередь, активирует специфические
гены
для выработки цитокинов или других
медиаторов
воспаления.
Цитокины имеют различные характеристики и вызывают различные эффекты. Некоторые из этих характеристик включают: 1) индукцию производства других цитокинов 2) подавление выработки цитокинов; 3) при определённых заболеваниях, имеется характерная модель выработки цитокинов (выработка IL-4 и IL-5 при астме) 4) чёткий, «твердый» контроль выработки, поддержание баланса между провоспалительными и противовоспалительными цитокинами, для увеличения степени защиты макроорганиззма и уменьшения степени его повреждения. Эта последняя характеристика цитокинов особенно важна, иллюстрируя прекрасный баланс между про-воспалением и анти-воспалением.
Данный баланс необходим в попытке сдержать токсическую защитную реакцию макроорганизма на участке инфекции, таким образом ограничивая повреждение здоровых тканей. Бесконтрольная активация воспалительного каскада может кончится повреждением ткани и, возможно, даже гибелью макроорганизма. Поэтому, цитокины могут также классифицироваться на провоспалительные, противовоспалительный и двуэффектные. Примером подобной регуляции может служить Фактор стимулирующий гранулоциты (G-CSF), который, с одной стороны, является провоспалительным ци-токином (увеличивает производство нейтрофилов), а с другой — противовоспалительным цитокином (он уменьшает дальнейшее производство фактора некроза опухоли (TNF-a), главного провоспали-тельного цитокина). Другим примером может служить — простагландин Е2 (PGE2), который является про-воспалительным медиатором. Однако он также ингибирует выработку провоспалительных цитокинов TNF-A и IL-1 макрофагами и моноцитами.
Цитокины вырабатываются и накапливаются клетками несколькими способами. Их высвобождение зависит от типа и силы полученных стимулов. Синтез, накопление и хранение цитокинов в клетках осуществляется следующими способами: 1) синтезируется как часть комплекса, необходимого для поддержания гематопоэза (M-CSF, G-CSF, S-CF, IL-6, ЕРО); 2) пресинтезируется и запасется в эндоплазматических гранулах (GM-CSF, TGF-B, PF4, PDGF) для высвобождения только в случае соответствующего индуцирования клетки; 3) синтезируется и транспортируется к мем-
бране клетки для самостоятельного образования поверхности или включения в сложный комплекс её обязательной белковой системы (TNF-a, IL-1/3, EGF, TGF-a); 4) формируют часть внеклеточного матрикса (TGF-/3, MIP-1B, IL-8); или, 5) синтезируются как ответ-реакция на инфекционные агенты, антигены, тромбоцит активирующие факторы или комплемент (IL-1, TNF, INF-y).
В результате высвобождения бактерией, липопо-лисахарид или другое активное пусковое вещество, становятся наиболее доступным моноцитам и макрофагам, клеткам, ответственным за пуск воспалительного каскада. Липополисахарид связывается с лип о полисахарид-комплиментарным протеином, синтезированным в печени. Этот липополисахарид-но-ЛПСК-белковый комплекс связывается в свою очередь с CD14 мембранным рецептором, глюко-зилфосфо-инозитольным (Gpi) рецептором лейкоцитов макроорганизма 112]. Это соединение усиливает эффект на клетки-мишени (моноциты или макрофаги), посредством триггерного пуска систем вторичных мессенджеров, которые, в свою очередь, стимулирует выработку цитокинов TNF-a, IL-1 и IL-6. Альтернативный путь: липополисахаридно-ЛПСК-белковый комплекс может связываться с растворимыми CD-14 молекулами, что выражается в активации систем комплемента. В дополнение к выработке этих цитокинов, данное взаимодействие также ведет к производству метаболитов арахидо-новой кислоты, увеличению экспресси интегринов, активации кининовой системы и выработке оксида азота (см. ниже).
Двумя важными цитокинами в процессе запуска и поддержания воспаления являются TNF-a и IL-1. TN F-a в первую очередь вырабатывается моноцитами и макрофагами в ответ на воздействие ЛПС, или других цитокинов. TNF-a получается в результате распада под воздействием фермента металло-протеазы, высвобождающей более мелкий растворимый белок, из промолекулы — npo-TNF-a, которая находится в мембранах лейкоцитов [13]. Однако, биологическая активность TNF-a зависит от формирования гомотриметричных комплексов из 3 мономеров зрелых TNF-a молекул. Эти гомотри-метричные комплексы могут связыватся с одним из двух типов рецепторов на мембранах клетки (тип I-TN F или тип I1-TNF рецепторы (TN FR)). Тип I TNFR ответственен за модуляцию большинства из ЛПС-индуцированной активности TNF-a's. В результате активации этого рецептора, возникает усиление клинической картины сепсиса. Тип II TNFR играет важную роль в опосредованной TNF-a цитотоксич-ности [14][15].
452
Сепсис
 TNF-a
также ответственен за стимуляцию
выработки
других цитокинов раннего ответа, таких
как IL-1,
мощного фактора хемотаксиса нейтро-филов
— цитокина IL-8,
IL-6,
который стимулирует
реактивные белки острой стадии (С
реактивный
белок, ферритин), и активизирует
индуцируемую
NO-синтазу
(iNOS),
для выработки оксида азота
(см. ниже). Другие эффекты TNF-a
включают в себя активацию метаболизма
арахидоновой кислоты с выработкой
простагландинов и лейкотрие-нов,
и увеличивают образование микротромбов
в результате
триггерного воздействия на свёртывающую
систему, что приводит к диссеминированно-му
внутрисосудистому свёртыванию
(ДВС-синд-ром)
в результате активации тканевого
фактора (TF)
и фактора XII.
TNF-a
также является эндогенным
пирогеном и ответственен за катаболичес-кую
фазу сепсиса.
TNF-a
также ответственен за стимуляцию
выработки
других цитокинов раннего ответа, таких
как IL-1,
мощного фактора хемотаксиса нейтро-филов
— цитокина IL-8,
IL-6,
который стимулирует
реактивные белки острой стадии (С
реактивный
белок, ферритин), и активизирует
индуцируемую
NO-синтазу
(iNOS),
для выработки оксида азота
(см. ниже). Другие эффекты TNF-a
включают в себя активацию метаболизма
арахидоновой кислоты с выработкой
простагландинов и лейкотрие-нов,
и увеличивают образование микротромбов
в результате
триггерного воздействия на свёртывающую
систему, что приводит к диссеминированно-му
внутрисосудистому свёртыванию
(ДВС-синд-ром)
в результате активации тканевого
фактора (TF)
и фактора XII.
TNF-a
также является эндогенным
пирогеном и ответственен за катаболичес-кую
фазу сепсиса.
IL-1 обладает множеством биологических и функциональных свойств TNF-a, и эти два вещества перекрывают друг друга в своих эффектах. Имеются три различных белка в группе IL-1: IL-la, IL-1Б и IL-1 антагонист рецептора (IL-lra). И IL-1Б и IL-\а усиливают сепсис-подобный синдром при внутривенном введении. Как и TNF-a, IL-1Б вырабатывается внутри клетки в результате воздействия цистеинпротеазы IL-1 (ICE) на промолекулу — про-IL-lБ, что уменьшает биологическую активность вещества. После выработки, IL-1Б связывается с одним из двух типов рецепторов, тип I и тип II рецепторы передачи сигналов (IL-1R). Тип I рецептор передачи сигналов (IL-1R) вызывает биологические эффекты этого интерлейкина. Тип II 1L-1R рецептора служит как «рецептор приманка», который комплиментарно связывает IL-1Б, и, таким образом, блокирует воспалительные эффекты этого цитокина. Работа IL-IRm тип 11 IL-lRpeuenTO-ров синергична, и проявляется в блоке провоспа-лительных эффектов IL-1Б на клетки-мишени. Некоторые из противовоспалительных эффектов глю-кокортикоидов опосредованы влиянием на тип II IL-1R рецепторы, таким образом работая как физиологический регулятор ЛПС-вызванного воспалительного ответа. Другим примером того, как про-воспалительные эффекты цитокинов сбалансированы противовоспалительными эффектами того же самого или другого цитокина может служить попытка ограничить воспалительную реакцию в области инфицирования.
Как и TNF-a, IL-1Б является мощным индуктором вторичных медиаторов сепсиса. Однако в течение воспалительного процесса он стимулирует не только их выработку, но свою собственную. IL-1Б
также стимулирует выработку других важных веществ, таких как IL-8 и хемотактического протеина-1 моноцитов (МСР-1), которые являются мощным хемоаттрактантами нейтрофилов и моноцитов (табл. 28-3). Про-воспалительная деятельность продолжает вести процесс воспаления посредством: 1) увеличения выработки и секреции IL-2, который стимулирует быстрое увеличение количества Т-лимфоцитов; 2) увеличения выработки IL-6; и, 3) стимулирования выработки факторов формирования гранулоцитов и активирования свертывающего каскада внешними путями.
Таблица 28-3 Хемотаксические факторы воспаления

Источник: Bcllingan, G. Inflammatory cell activation in sepsis. British Medical Bulletin (1999) vol 55 (1): 21.
Коллаген 1 типа и фибронектин протеолиттические фрагменты являются специфическими хемоатрактанта-ми макрофагов
Подобно TNF-a, IL-1 также стимулирует выработку метаболитов арахидоновой кислоты и опосредует экспрессию интегринов на лейкоциты и паренхиматозные клетки, что является важным шагом в цикле полиморфноядерных лекоцитов. IL-1 также стимулирует выработку окисида азота. Другие известные эффекты IL-1 включают в себя: индукцию гипертермии, сна, анорексии и выброс нейропептидов в мозге.
28.3.2. Эффекты на сосудистый эндотелий и кровь
Перед тем, как пытаться понять какое влияние оказывается на сосудистый эндотелий и кровь, и какое участие они принимают в сепсисе, сначала
453
Клиническое руководство по черепно-мозговой травме
 необходимо
представить то, что происходит в
мик-роциркуляторном
русле в зоне ограниченного очага
инфекции.
Воспалительная реакция макроорганизма
на инфекцию является нормальной. В
попытке борьбы
и локализации инфекции, первично
моноциты
и макрофаги высвобождают цитокины
(TNF-a,
IL-1)
приводя в готовность окружающие клетки,
включая сосудистый эндотелий на участке
развивающейся инфекции. Хемотаксическая
передача
сигналов (IL-8,
С-5а, лейкотриен LTB2,
и бактериально
выработанные факторы, такие как
М-формил-Ь-метионил-фенилаланин)
активизирует
лейкоциты в окружающих тканях и в крови,
привлекая
их к участку инфекции.
необходимо
представить то, что происходит в
мик-роциркуляторном
русле в зоне ограниченного очага
инфекции.
Воспалительная реакция макроорганизма
на инфекцию является нормальной. В
попытке борьбы
и локализации инфекции, первично
моноциты
и макрофаги высвобождают цитокины
(TNF-a,
IL-1)
приводя в готовность окружающие клетки,
включая сосудистый эндотелий на участке
развивающейся инфекции. Хемотаксическая
передача
сигналов (IL-8,
С-5а, лейкотриен LTB2,
и бактериально
выработанные факторы, такие как
М-формил-Ь-метионил-фенилаланин)
активизирует
лейкоциты в окружающих тканях и в крови,
привлекая
их к участку инфекции.
Перемещение лейкоцитов к участку инфекции не происходит ни случайно, ни хаотически. Оно является хорошо управляемым процессом, который скоординирован передачей сигналов местно выработанными провоспалительными медиаторами и сосудистым эндотелием. После передачи сигналов, описанных выше, переформирования или активизации сосудистого эндотелия и лейкоцитов, происходит перемещение клеток к инфицированной области. Это осуществляется посредством активации, выработки и секреции эндотелием веществ, которые, в свою очередь, вносят вклад в усиление и управление воспалительного каскада.
По. прибытии «незаправленных» нейтрофилов в очаг инфекции или в место травмы по микро-циркуляторному руслу, они встречаются цитоки-нами и другими воспалительными веществами, которыми «заправляются» и активируют ПЯЛ. Эта активация приводит к изменениям физических характеристик лейкоцитов, увеличивая их способность к адгезии на эндотелии и проникновению в участок инфекции (главным образом через посткапиллярную венулу). К тому же, активация придаёт нейтрофилам больше устойчивости к деформации и наращивает способность к адгезии к эн-дотелиальным клеткам, увеличивая активацию мембран при помощи белков типа МАС-1, фактора адгезии лейкоцитов (LAF) и молекул адгезии лейкоцитов (LECAM). Эти физические изменения лейкоцитов изменяют микроциркуляцию, увеличивая время прохождения крови через капилляры. Движение по микроциркуляторному руслу дополнительно местно замедляется прокоагу-лянтной и протромботической средой, полученной высвобождением эндотелиалъными клетками таких веществ, как тромбопластин, фактор инги-биции активатора плазминогена (PAI-1) и фактор активации тромбоцитов (PAF). Эти изменения вносят свой вклад в формирование микротромбов
и как следствие в недостаточность кровоснабжения, которая встречается в микроциркуляторном русле во время сепсиса.
После миграции «заправленных» лейкоцитов по микроциркуляторному руслу, три фактора облегчают их перемещение к очагам воздействия. Повышенное «качение» лейкоцитов по поверхности эндотелия. Это сопровождается устойчивым припаи-ванием к его поверхности и, наконец, прохождением гематотканевого барьера. Тропность к сосудистой стенке облегчена экспрессией поверхностных обязательных клеточных белков эндотелия [16]. К ним относят селектины и интегрины. Функция их заключается в «заманивании» лейкоцитов во время прохождения через капилляры инфицированного участка. Некоторые из селектинов и интегри-нов включают L-селектин, Е-селектин, Р- селек-тин, внутриклеточные адгезивные молекулы (ICAM), эндотелий-лейкоцит адгезивные молекулы (ELAM), сосудистые адгезивные молекулы (VCAM) и грануло-ассоциированные мембранные белки (GMP-140). JCAM-1 представляет собой важный интегрин, который связывается с МАС-1 (CD11B/CD18) протеинов поверхности нейтрофилов и жестко прикрепляет лейкоциты к эндотелию. При экспериментальном блокировании ICAM-1 или MAC-1, смертельно-опасные эффекты ЛПС остаются без ответа, тем самым подчёркивая важность этих белков в механизме воспаления. Цитокины IL-1, TNF-/? и растворимый Е-селектин регулируют экспрессию ICAM-1 при сепсисе.
После присоединения ПЯЛ и стадии её трансформации, она на уровне посткапиллярной вену-лы диапедезом проходит эндотелиальный барьер через промежутки, возникшие в результате повреждения сосудистого эндотелия такими веществами, как эндотоксин, TNF-a, тромбоцит-ак-тивирующий фактор (PAF), лейкотриен-В4 и тромбоксан А2, и попадает в интерстиций. Лейкоцит также повреждает сосудистый эндотелий, вызывая локальную травму ткани, после присоединения к его участку. Эта травма вызвана потерей зернистости энд о плазматических лизосом с выбросом их содержимого, которое включают в себя свободные кислородные радикалы, лизосо-мальные ферменты и протеазы.
В интерстициуме ПЯЛ переносятся к участку инфекции по хемотаксическому градиенту, созданному хемокинами. Этот градиент направляет лейкоциты к участку повреждения, где находятся фагоциты и происходит очищение очага повреждения. Затем происходит фагоцитоз, подкреплённый присутствием опсонизирующих белков системы
454
Сепсис

комплемента
и иммуноглобулинов. По окончании
лейкоцитом
процесса фагоцитоза, происходит слияние
фаговакуоли с внутриклеточными
гранулами,
что приводит к увеличению внутриклеточной
утилизации
кислорода, известного как дыхательный
пакет. Дыхательные пакеты подвергают
патоген
влиянию токсических миелопероксидаз,
свободных
радикалов кислорода (суперокись-анион,
пероксид
водорода), лизосомальных гидролаз,
протеаз
(эластазы, коллагеназы, нейтральные
про-теазы,
активатор плазминогена) содержащихся
в лизосомах.
Эти вещества облегчают уничтожение
бактерий,
и, в случае отсутствия регулирующего
механизма,
повреждают ткани макроорганизма. Другие
вещества, такие как антимикробный
пептид,
находящиеся в азурофильных гранулах
нейт-рофилов
(протеин, увеличивающий бактерицидную
проницаемость) стимулируют уничтожение
и
опсонизацию бактерий.
Необходимо понимать, что в микросреде участка инфекции положительные эффекты воспаления «перевешивают» отрицательные. Воспаление увеличивает «обороноспособность» макроорганизма хозяина и вносит вклад в «перемоделирование» ткани и восстановление функции.
Лейкоциты являются не единственными компонентами крови, на которые оказывается воздействие во время системного воспаления. Выпуск цитокинов и ЛПС в кровоток вызывает активацию и вывод из строя почти каждого компонента крови. На тромбоциты, системы плазматических белков (комплемент и свёртываемость) и эритроциты также или оказывается воздействие, или они активно участвуют в воспалительном каскаде. Большинство эффектов отмечается на микроциркулярном уровне.
Вовлечение тромбоцитов в каскад сепсиса также повреждает эндотелий, стимулируя вазоконст-рикцию и дальнейшее активирование лейкоцитов. Тромбоциты активируются тромбоцит активирующим фактором (PAF). PAF является провоспали-тельным цитокином и активирует TNF-a и IL-1/5, таким образом увеличивая воспалительный каскад. Это приводит к выбросу тканевого фактора, таким образом усиливается адгезивность и активность лейкоцитов, а также стимулируется выработка и секреция оксида азота, что приводит к вазодиля-тации. К другим эффектам PAF относятся: усиление аггрегации тромбоцитов и развитие легочной артериальной гипертензии в результате выброса простагландина.
Поддержание гомеостаза на микроциркулярном уровне во время сепсиса затруднено не только био-
химическими и физическими изменениями, воздействующими на кровеносные микрососуды, как было описано выше, но также и изменениями реологических свойств эритроцитов. Способность эритроцита в норме изменять свою форму при прохождении по капиллярам меньшего размера, частично потеряна. Эта способность эритроцитов к изменению формы, являющаяся важным фактором в поддержании адекватного кровообращения при низком перфузионном давлении [17][18], утрачивается в результате присутствия эндотоксина и медиаторов, выброшенных активными лейкоцитами. Увеличение ригидности эритроцитов приводит к застою и обструкции нормального кровотока на капиллярном уровне, приводя к неоднородной перфузии с окончательным уменьшением снабжения тканей кислородом. Это приводит к гипоксичеко-му повреждению ткани, и, в конце концов, к дисфункции органа.
Воспаление и сепсис также воздействуют и на другую систему крови, называемую контактной системой. Эта система состоит из белков и регуля-торных серин-протеаз и включает в себя свёртывающую, комплемент- и кинин-каликрииновую системы. Каждая система вносит свой вклад в нарушения, возникающие при сепсисе со значительным клиническим воздействием типа гипотензии и ДВС.
Свёртывающая система, играющая важную роль в механизме сепсиса, подвергается воздействию воспаления. На начальных этапах сепсиса происходит активация свёртывающей системы, выражающаяся увеличением выработки тромбина и фибрина, что, в конечном счете, приводит к ДВС. Воспаление активирует каскад коагуляции главным образом внешними путями. Общеизвестно, что in vitro, внутренний каскад коагуляции начинается с превращения фактора XII в XI 1а. Этот процесс может быть активизирован эндотоксином, побочными бактериальными продуктами или контактом с сосудистым коллагеном. Однако, in vivo, участие фактора XII не является обязательным для активации процесса коагуляции (20). Внешний путь является главным процессом коагуляции, при в диссе-минированном внутрисосудистом свёртывании, в результате сепсиса. Стадия инициации зависит от активации тканевым фактором (TF). Тканевой фактор формирует комплекс с фактором VII. Образовавшийся комплекс (TF-фактор VII) ведет к активации факторов IX и X, что, в свою очередь, активирует общей путь свёртывания с образованием тромбина и формированием фибрина. Активации TF эндотоксином противодействует специфи-
455
Клиническое руководство по черепно-мозговой травме
 ческий
ингибитор тканевого фактора (TFPI).
Истощение
TFPI
усиливает эндотоксин-индуцирован-ный
ДВС. В нормальных условиях, свёртыванию
противостоит
противосвертывающий антитромбин III
(ATIII),
протеин С, протеин S,
но их количество
и активность заметно снижены при сепсисе
с ДВС.
ческий
ингибитор тканевого фактора (TFPI).
Истощение
TFPI
усиливает эндотоксин-индуцирован-ный
ДВС. В нормальных условиях, свёртыванию
противостоит
противосвертывающий антитромбин III
(ATIII),
протеин С, протеин S,
но их количество
и активность заметно снижены при сепсисе
с ДВС.
Фактор XII в vivo играет важную роль в сепсисе и не связан с коагуляцией. Фактор XII ответственен за активацию кини-каликреиновой системы, которая ответственна за выработку брадикинина и активацию классического пути комплемента. Бра-дикинин вызывает глубокую гипотензию при сепсисе в результате системной вазодилятации. Эффект вазодилятации возникает в результате активации и выброса NO эндотелиальными клетками (эффекты NO см. ниже). Распад брадикинина зависит от активности ангиотензин-преобразовываю-щего фермента (АСЕ), расщепляющего его на неактивные части [19]. Резкое снижение активности АСЕ было отмечен у пациентов с септическим шо-ком[20].
Сепсис также воздействует и на противосвёр-тывающую систему, которая отвечает за поддержание гомеостаза крови. Активность ATIII, анти-тромбинового протеина, снижена. Это обусловлено увеличенным потреблением белка под воздействием сывороточных ферментов, что уменьшает период его полураспада. Эластазы, высвобождаемые нейтрофилами, увеличивают степень инактивации АТШ, этот процесс, как это ни парадоксально стимулируется гепарином, который в нормальных условиях усиливает активность АТШ; таким образом чётко препятствуя свёртываемости. Количество пригодного АТШ остается низкой, несмотря на увеличенную его выработку печенью. Уменьшение уровня АТШ является чётким прогностическим признаком летального исхода сепсиса.
Активация системы комплемента выражается в активации нейтрофилов и далее вносит свой вклад в сосудистые нарушения. Система комплемента активируется в течении сепсиса классическими и альтернативными путями. Считается, что анафилотоксины СЗа и С 5а играют важную роль в аггрегации и активации лейкоцитов, увеличении секвестрации в микроциркуляторном русле, особенно малого круга кровообращения. С 5а и терминальный комплекс комплемента С 5Ь-С9 стимулируют выработку тканевого фактора ткани (TF) в моноцитах и эндотелии, таким образом вызывая и поддерживая развитие ДВС. Комплемент также вносит свой вклад в индуцированную
сепсисом гипотензию выработкой простагланди-нов и цитокинов.
28.3.3. Окись азота
Окись азота (NO) является важным медиатором воспаления при сепсисе. Окись азота это газ малого молекулярного веса, способный проникать через клеточную мембрану. Источником окиси азота является L-аргинин. Данная аминокислота под воздействием фермента оксидазотсинтетазы (NOS), находящейся в эндотелиальных клетках, макрофагах, купферовских клетках и гепатоцитах [21], трансформируется в NO и L-цитрулин. В норме NO должна регулировать сосудистый тонус и действовать как ингибитор скопления тромбоцитов и аггрегации лейкоцитов. Окись азота в значительной степени ответственна за метаболические и гемодинамические изменения при сепсисе. Она представлена двумя формами: составная N0 (cNO) и индуцированная NO (iNOS). CNO в здоровом организме вырабатывается при помощи кальций-зависимой N0 синтетазы (cNOS). iNO вырабатывается при помощи кальций-независимой NO синтетазы (iNOS) и этот процесс индуцируется воспалительными медиаторами типа IL-lb, TNF-a и PAR
Сепсис-индуцированная гипотензия в значительной степени вызвана выработкой NO клетками гладкой мускулатуры и эндотелия сосудов. Индукция iNOS последовательно приводит к чрезмерной NO-вызванной вазодилятации и, как следствие, повреждению ткани. Игибирование выработки NO блокированием NO-синтетазы с L-аргинин аналогами или блокированием гуани-латциклазы, внутриклеточных мессенджеров N0 приводит к уменьшению степени гипотензии при сепсисе [22].
Несмотря на то, что NO является депрессором миокарда, угнетение NO-синтетазы не улучшает функциональное состояние сердца у человека [23 24]. Период полураспада NO in vivo мал из-за лёгкой окисляемости кислородом с формированием нитрита и нитрата, которые являются устойчивыми окончательными продуктами NO синтеза. Также с лёгкостью происходит реакция соединения с гемоглобином, с формированием метгемог-лобина.
LPS, спровоцированная выработка NO, также вносит вклад в уменьшение утилизации кислорода тканями, встречающейся при сепсисе и септическом шоке, несмотря на увеличение доставляемого его количества к ним. Химически это проявляется
456
Сепсис
особенностями
анаэробного метаболизма, который ведет
к лактоацидозу [25].
28.3.4. Утилизация кислорода
и важная роль желудочно-кишечного тракта
Распределние кровотока при сепсисе зависит как от местных, так и от центральных факторов. Центральная регуляция кровотока главным образом происходит симпатическими вазоконстрикторами, а местная перфузия крови регулируется выработкой вазоактивных веществ эндотелием и наполнением капилляров. Эти механизмы гарантируют достаточную оксигенацию всех органов. При адекватной перфузии поглощение кислорода тканями происходит независимо от доставляемого его количества (за исключением случаев снижения содержания ниже критического уровня). Изменения перфузии сопутствуют увеличению экстракции кислорода. При сепсисе эти компенсаторные механизмы не всегда срабатывают, и их недостаточность ведет к дисфункции органа.
В нормальных условиях аэробный метаболизм определяется скорее такими факторами, как доступные и способные к окислению субстраты, гормональная среда, физические затраты, чем наличием кислорода. Однако при сепсисе аэробный метаболизм не может быть полностью адекватным, так как на поглощение кислорода воздействуют другие факторы, не связанные с его доставкой. Таким образом увеличенние доставки, вызванное гипердинамическими изменениями в результате сепсиса, не гарантирует адекватную утилизацию кислорода.
Считалось, что сниженное потребление кислорода возникает в результате интерстициального отека, вызванного потерей целостности сосудистого эндотелия, а внутритканевой отек препятствует доставке кислорода в клетки. Однако, как выяснилось, недостаточная доставка кислорода к клеткам при сепсисе, является более сложным механизмом, чем просто увеличение расстояния до клеток. Застой крови, анемия и гипоксия, вызванная уменьшенным количеством доступного кислорода, низкий местный уровень РО2,— всё вносит свой вклад в пониженную утилизацию кислорода. Состояние микроциркуляторного русла, вызванное закупоркой капилляров и нарушениями в результате воздействия вазоактивных цитокинов и N0, вызывают недостаточность перфузии в органах. Другая форма гипоксии, встречающаяся при сепсисе —
цитотоксическая — была выявлена несколько раньше [26]. Эта форма гипоксии означает неадекватную выработку АТФ, несмотря на нормальный или даже выше нормального уровня кислородный потенциал в митохондриях клеток. Цитотоксическая гипоксия возникает в результате снижения утилизации субстратов, таких как пируват в митохондриальном цикле Кребса (ТСА) трикарбоновых кислот. Уменьшение использования пирувата вызвано угнетением пируват-дегидрогеназного комплекса, необходимого для формирования Ацетил-СоА. Это также сопровождается нарушениями транспорта электронов и разрушением окислительно-восстановительных систем. В результате возникает снижение выработки АТФ [27]. Это явление встречается несмотря на нормальное или даже супранормальное количество доступного кислорода [28], т.е., при сепсисе, производство АТФ заметно снижено, и зависит от цикла гликолиза с образованием в конце его из пирувата молочной кислоты.
Возникновение гипоксии в слизистой оболочке кишечника при сепсисе особенно опасно [29]. Желудочно-кишечный трактат является метаболически активным органом, и получает приблизительно 20—30 % сердечного выброса крови. Огромное количество этого объёма (приблизительно 90 %) направлено к слизистой оболочке и под-слизистому слою. Поддержание целостности барьера слизистой оболочки предотвращает трансэпителиальную миграцию микроорганизмов или эндотоксина из просвета кишечника. При сепсисе эти микроорганизмы или их токсины, обладают потенциалом для попадания в кровеносное русло, с дальнейшим увеличением воспалительной реакции, если не происходит их деактивация защитными средствами макроорганизма (лимфоид-ная ткань, брыжеечные лимфатические узлы и купферовские клетки печени).
Желудочно-кишечный тракт очень чувствителен к снижению перфузии. Основной причиной потери целостности слизистой оболочки является её ишемия. Ишемия этого органа при сепсисе непосредственно связана с системной гипотензией, перераспределением кровотока в капиллярах и сладжем, вызванных активацией эритроцитов и лейкоцитов. Дифференцированное регулирование выработки N0 вдоль ворсинок слизистой оболочки кишки, также играет важную роль в сепсис-индуцированном повреждении энтероцитов [30]. Цитопатическая гипоксия и повреждение свободными радикалами кислорода, по-видимому, является конечной стадией повреждения ворсинчатого эпителия.
457
Клиническое руководство по черепно-мозговой травме
