
- •Физико-химические процессы в гидросфере Учебное пособие
- •Физико-химические процессы в гидросфере
- •1. Аномальные свойства воды и состав природных вод
- •Примеры решения задач
- •2. Способы классификации природных вод
- •Примеры решения задач
- •3. Основные процессы формирования химического состава природных вод
- •3.1. Процессы растворения газов в природных водах
- •3.2. Процессы растворения твердых веществ в природных водах
- •3.3. Жесткость природных вод
- •Примеры решения задач
- •4. Кислотно-основное равновесие в природных водоемах
- •4.1. Карбонатная система и рН атмосферных осадков
- •4.2. Растворимость карбонатов и рН подземных и поверхностных природных вод
- •4.3. Карбонатное равновесие в океане
- •4.4. Щелочность природных вод
- •4.5. Процессы закисления поверхностных водоемов
- •Примеры решения задач
- •5. Окислительно-восстановительные процессы в гидросфере
- •2.5.1. Окислительно-восстановительное равновесие
- •5.2. Взаимосвязь между окислительно-восстановительными и кислотно-основными характеристиками природных вод
- •5.3. Редокс-буферность природных вод
- •5.4. Особенности окислительно-восстановительных процессов в озерах
- •5.5. Особенности окислительно-восстановительных процессов в океане
- •5.6. Особенности окислительно-восстановительных процессов в подземных водах
- •5.7. Окислительно-восстановительные условия и миграция элементов
- •Примеры решения задач
- •Контрольные вопросы
- •Модуль № 2. Физико-химические процессы в гидросфере
- •Задачи ко второму учебному модулю
- •Ответы на задачи для самостоятельного решения
- •Литература
- •Приложение
- •Оглавление
Примеры решения задач
Пример 4. К какому классу вод по минерализации следует отнести природные воды, состав которых соответствует среднему составу речной воды. При оценке принять:
а) другие примеси в воде отсутствуют; б) плотность речной воды равна 1000 г/л; в) при экспериментальном определении минерализации все гидрокарбонат-ионы перейдут в карбонат-ионы, а все остальные ионы образуют безводные соли, устойчивые при 105°С.
Решение. По
условию задачи состав природной воды
соответствует среднему составу воды в
реках. Содержание примесей в этой воде,
как видно из таблицы 2, составляет
(млн–1):
Са2+
– 20; Na+
– 5,8; Mg2+
– 3,4; К+
– 2,1; HCO![]() – 35; SO
– 35; SO![]() –
12; Сl–
– 5,7.
–
12; Сl–
– 5,7.
Значение минерализации природных вод определяется в г/л, поэтому необходимо выразить концентрации анионов и катионов в этих единицах. Поскольку плотность воды по условию задачи равна 1000 г/л, концентрации примесей, выраженные в млн–1, численно равны концентрациям, выраженным в мг/л. Поэтому, чтобы получить содержание примесей в г/л, достаточно умножить значение их содержания в млн–1 на 10–3:
Сi(г/л) = 10–3 . Сi(млн–1).
Содержание
примесей в природной воде, выраженное
в г/л, составит:
Са2+
– 2,0 .
10-2;
Na+
– 5,8 .
10-3;
Mg2+
– 3,4 .
10-3;
К+
– 2,1 .
10-3;
HCO![]() – 3,5 .
10-2;
SO
– 3,5 .
10-2;
SO![]() – 1,2 .
10-2;
Сl–
– 5,7 . 10-3.
– 1,2 .
10-2;
Сl–
– 5,7 . 10-3.
По условию задачи
при определении минерализации ионы
HCO![]() полностью перейдут в ионы CO
полностью перейдут в ионы CO![]() .
Процесс разложения может быть представлен
следующим уравнением реакции, известным
из курса общей и неорганической химии:
.
Процесс разложения может быть представлен
следующим уравнением реакции, известным
из курса общей и неорганической химии:
2HCO![]()
CO
CO![]() + Н2О
+ СО2
+ Н2О
+ СО2
Образующиеся в этом процессе молекулы воды и диоксида углерода не вносят вклада в минерализацию, поскольку при 105°С переходят в газовую фазу.
Концентрацию
образующихся ионов CO![]() можно определить по уравнению
можно определить по уравнению
[CO![]() ]
= [HCO
]
= [HCO![]() ] .
] .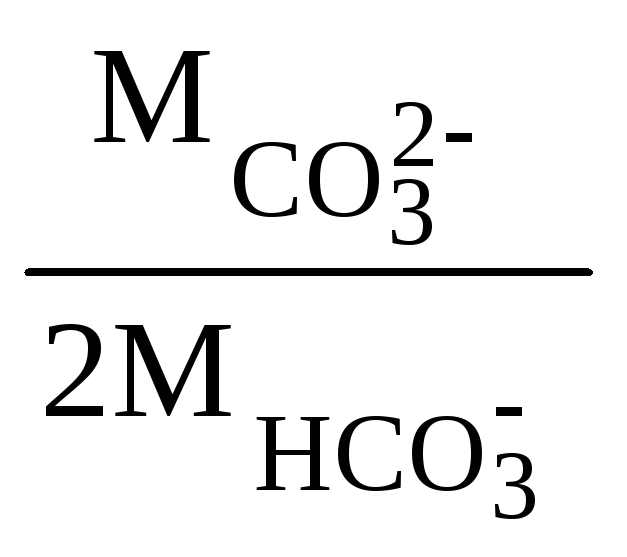 ,
,
где [CO![]() ]
и [HCO
]
и [HCO![]() ]
– концентрации карбонат- и гидрокарбонат-ионов
(г/л) соответственно;
]
– концентрации карбонат- и гидрокарбонат-ионов
(г/л) соответственно;
![]() и
и
![]() –
молярные массы карбонат- и гидрокарбонат-ионов
(г/моль).
–
молярные массы карбонат- и гидрокарбонат-ионов
(г/моль).
Концентрация ионов
CO![]() ,
образующихся при определении минерализации
воды, может составить:
,
образующихся при определении минерализации
воды, может составить:
[CO![]() ]
= 3,5 .
10–2
.
60/(2 .
61) = 1,7 .
10–2
(г/л).
]
= 3,5 .
10–2
.
60/(2 .
61) = 1,7 .
10–2
(г/л).
Поскольку по
условию задачи все ионы, кроме HCO![]() ,
образуют безводные соли, устойчивые
при 105°С, а гидрокарбонат-ионы переходят
в ионы CO
,
образуют безводные соли, устойчивые
при 105°С, а гидрокарбонат-ионы переходят
в ионы CO![]() и также образуют соли, значение
минерализации можно определить по сумме
концентраций ионов CO
и также образуют соли, значение
минерализации можно определить по сумме
концентраций ионов CO![]() и остальных ионов, присутствующих в
исходной воде:
и остальных ионов, присутствующих в
исходной воде:
М
= [CO![]() ]
+ [Са2+]
+ [Na+]
+ [Mg2+]
+ [K+]+
[SO
]
+ [Са2+]
+ [Na+]
+ [Mg2+]
+ [K+]+
[SO![]() ]
+ [Cl–];
]
+ [Cl–];
М = 1,7 . 10–2 + 2,0 . 10–2 + 5,8 . 10–3 + 3,4 . 10–3 + 2,1 . 10–3 +
+ 1,2 . 10–2 + 5,7 . 10–3 = 6,6 . 10–2 (г/л).
Поскольку полученное значение минерализации меньше 0,2 г/л, природные воды, отвечающие среднему составу речной воды, следует отнести к ультрапресным водам (таблица 3).
Ответ: природные воды, отвечающие среднему составу речной воды, следует отнести к ультрапресным водам.
Пример 5. Охарактеризуйте морскую воду в соответствии с классификацией, разработанной О.А. Алекиным.
Решение. Преобладающим анионом в морской воде является анион хлора, поскольку его концентрация, выраженная в ммоль-экв./л, намного превосходит концентрации других анионов (Пример 2). Поэтому морские воды следует отнести к классу хлоридных вод.
Преобладающим катионом в морской воде является катион натрия (Пример 2), поэтому эти воды следует отнести к группе натриевых вод.
Для определения типа воды просуммируем концентрации катионов кальция и магния в морской воде, выраженные в ммоль-экв./л, и сравним сумму с концентрацией гидрокарбонат-иона:
CCa2+
+ CMg2+
= 10,0 + 45,3 =
55,3 ммоль-экв./л > СHCO![]() =
=
= 2,3 ммоль-экв./л.
Следовательно,
морская вода не относится к первому
типу вод. Сравним суммарную концентрацию
анионов НСО![]() иSO
иSO![]() с суммарной концентрацией катионов
кальция и магния в морской воде:
с суммарной концентрацией катионов
кальция и магния в морской воде:
C
HCO![]() +C
SO
+C
SO![]() = 2,3 + 27,6 = 29,9 ммоль-экв./л < ССа2+
+ CMg2+
=
= 2,3 + 27,6 = 29,9 ммоль-экв./л < ССа2+
+ CMg2+
=
= 55.3 ммоль-экв./л.
Следовательно, морская вода не относится и ко второму типу вод.
Сравним концентрации ионов хлора и натрия, выраженные в ммоль-экв./л:
CCl– = 534,6 ммоль-экв./л > СNa+ = 459,1 ммоль-экв./л.
Следовательно, морскую воду следует отнести к третьему типу вод.
Ответ: по классификации О.А. Алекина морскую воду следует отнести к классу хлоридных вод натриевой группы третьего типа.
