
- •Физико-химические процессы в гидросфере Учебное пособие
- •Физико-химические процессы в гидросфере
- •1. Аномальные свойства воды и состав природных вод
- •Примеры решения задач
- •2. Способы классификации природных вод
- •Примеры решения задач
- •3. Основные процессы формирования химического состава природных вод
- •3.1. Процессы растворения газов в природных водах
- •3.2. Процессы растворения твердых веществ в природных водах
- •3.3. Жесткость природных вод
- •Примеры решения задач
- •4. Кислотно-основное равновесие в природных водоемах
- •4.1. Карбонатная система и рН атмосферных осадков
- •4.2. Растворимость карбонатов и рН подземных и поверхностных природных вод
- •4.3. Карбонатное равновесие в океане
- •4.4. Щелочность природных вод
- •4.5. Процессы закисления поверхностных водоемов
- •Примеры решения задач
- •5. Окислительно-восстановительные процессы в гидросфере
- •2.5.1. Окислительно-восстановительное равновесие
- •5.2. Взаимосвязь между окислительно-восстановительными и кислотно-основными характеристиками природных вод
- •5.3. Редокс-буферность природных вод
- •5.4. Особенности окислительно-восстановительных процессов в озерах
- •5.5. Особенности окислительно-восстановительных процессов в океане
- •5.6. Особенности окислительно-восстановительных процессов в подземных водах
- •5.7. Окислительно-восстановительные условия и миграция элементов
- •Примеры решения задач
- •Контрольные вопросы
- •Модуль № 2. Физико-химические процессы в гидросфере
- •Задачи ко второму учебному модулю
- •Ответы на задачи для самостоятельного решения
- •Литература
- •Приложение
- •Оглавление
Модуль № 2. Физико-химические процессы в гидросфере
Строение гидросферы. Гидрологический цикл. Состав, основные показатели качества и процессы формирования природных вод.
Карбонатные системы в природных водах и концентрация ионов водорода. Уравнение баланса зарядов в карбонатной системе. Угольная кислота и рН раствора. Растворимость карбонатных пород. Влияние примесей на растворимость кальзита. Щелочность природных вод. Закисление водоемов. Алюминий в природных водах. Окислительно-восстановительные процессы в водоемах. Температурный профиль пресноводных водоемов. Эвтрофирование природных вод. Диаграмма рЕ – рН для модельных и природных систем. Процессы гидролиза в природных водах и их значение. Процессы комплексообразования в гидросфере. Природные и систематические комплексообразователи. Детергенты (СПАВ) в водоемах. Тяжелые металлы в природных водах. Пестициды в природных водах. Хлорированные и полихлорированные углеводороды в природных водах. Антропогенное воздействие на Мировой океан: приоритетные загрязнители; основные источники воздействия; влияние антропогенных загрязнений на морские экосистемы; формы миграции и основные процессы трансформации основных загрязняющих веществ; экологический резерв Мирового океана и прогноз его состояния. Основные механизмы саморегуляции в гидросфере. Роль живого вещества.
Задачи ко второму учебному модулю
Задача № 1. Оцените максимально возможную концентрация растворенного О2 в воде при 25оС, если константа Генри равна 2 . 10–8 моль/л. Полученную величину сравните с нормируемой для природных вод и укажите причины в различии полученных значений.
Задача № 2. Оцените величину рН атмосферных осадков при растворении в них атмосферного СО2. Влиянием других кислых газов пренебречь. В оценках принять константу диссоциации угольной кислоты:
Н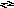 2СО3
Н+
+ НСО3–.
2СО3
Н+
+ НСО3–.
З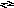 адача
№ 3. Оцените
рН дождей в г. Иваново, где основной
вклад в закисление атмосферной влаги
(уменьшение рН) дает диоксид серы. Средняя
концентрация диоксида серы в приземном
слое воздуха составляет 30 мкг/м3,
константа Генри равна 5,4 моль/(л
.
атм), а константа скорости диссоциации
(Н2SО3
Н+
+ НSО3–)
составляет 2,7 .
10–2
моль/л.
Выполните
аналогичные расчеты для г. Череповца,
где средняя концентрация SO2
достигает 1 мг/м3.
Рассчитайте парциальные индексы
загрязнения атмосферы в двух городах
и сделайте соответствующие выводы.
адача
№ 3. Оцените
рН дождей в г. Иваново, где основной
вклад в закисление атмосферной влаги
(уменьшение рН) дает диоксид серы. Средняя
концентрация диоксида серы в приземном
слое воздуха составляет 30 мкг/м3,
константа Генри равна 5,4 моль/(л
.
атм), а константа скорости диссоциации
(Н2SО3
Н+
+ НSО3–)
составляет 2,7 .
10–2
моль/л.
Выполните
аналогичные расчеты для г. Череповца,
где средняя концентрация SO2
достигает 1 мг/м3.
Рассчитайте парциальные индексы
загрязнения атмосферы в двух городах
и сделайте соответствующие выводы.
Задача № 4. Оцените концентрацию карбонат-иона при растворении атмосферного СО2 в природных водах при температуре 25оС. В оценках принять: константа Генри КГ = 3,4 . 10–7 моль/ л . Па; К1 = 4,5 . 10–7 моль/л; К2 = 4,7 . 10–7 моль/л; рН = 10.
Задача № 5. Рассчитайте концентрацию бикарбонат-иона при растворении атмосферного СО2 в природных подах при 20оС. В качестве справочных данных принять: количество СО2 в атмосфере составляет 0,0343% (объемных), константа Генри КГ = 3,4 . 10–7 моль/ л . Па; К1 = 4,5 . 10–7 моль/л; К2 = 4,7 . 10–7 моль/л; рН = 7.
Задача № 6. Оцените, какой объем воды условно потеряет кислород, если в замкнутый водоем в результате аварии попало 100 кг бензола. Константа Генри равна 1,26 . 10–8 моль/л . Па.
Задача № 7. Что произойдет с популяцией парка в замкнутом водоеме, если в последний произошел залповый выброс фенола в количестве 20 кг? Равновесная концентрация растворенного в воде О2 до выброса составляла 10 мг О2/л. Объем водоема 10000 м2.
Задача № 8. Оцените последствия для популяции рыб замкнутого водоема, если в последний начали сбрасывать сточные воды крахмалопаточного завода. В сточных водах содержится 60 мг/л сахаров (С12Н22О11). Мощность сброса за контрольный период составила 1000 м3. Равновесная концентрация О2 в водоеме до сброса сточных вод – 9 мг/л, объем водоема – 10000 м3.
Задача № 9. Оцените максимально возможное количество биомассы, которое может быть получено при фотосинтезе в случае отсутствия поступления в водоем других углеродсодержащих соединений, в том число и СО2, если в процессе фотосинтеза величина рН среды изменилась с 7 до 10 единиц. В оценках принять: при рН = 7, щелочность 1 мг-экв/л, а при рН = 10 щелочность – 4 мк-экв/л, К1 = 4,47 . 10–7 моль/л; К2 = 4,68 . 10–11 моль/л; рН = 10.
Задача № 10.
Постройте диаграмму
![]() –
рН для железа, если его среднегодовая
концентрация в водоеме составляет 0,1
мг/л, а основные равновесия записываются
следующим образом:
–
рН для железа, если его среднегодовая
концентрация в водоеме составляет 0,1
мг/л, а основные равновесия записываются
следующим образом:
1) Fe3+
+
![]()
Fe2+,
Fe2+,
![]() =
13;
=
13;
2) Fe(OH)2 (тв) Fe2+ + 2OH–, k2 = 2 . 10–15;
3) Fe(OH)3 (тв) Fe3+ + 3OH–, k3 = 6 . 10–38;
4) Fe(OH)3
(тв)
+
![]()
Fe(OH)2
(тв)
+ OH–,
Fe(OH)2
(тв)
+ OH–,
![]() = –9,48.
= –9,48.
Оцените основные формы нахождения соединений железа в поверхностных и придонных слоях воды, если средняя глубина водоема составляет 12 м.
Задача № 11. Определите основную форму нахождения Al в поверхностных слоях воды водоема при значении рН = 5 и рассчитайте его содержание в этой форме, если образование растворимых форм алюминия в природных водах ограничить следующими реакциями:
1) Al(OH)3 + 3H+ Al3+ + 3H2O, k1 = 5,1 . 109;
2) Al(OH)3 + H+ Al(OH)2+ + H2O, k2 = 4 . 101;
3) Al(OH)3 + H2O Al(OH)4– + H+, k3 = 1 . 10–14.
Задача № 12. Оцените величину рН дождей в промышленном районе, где основной вклад в закисление атмосферной влаги дает SO2. Парциальное давление SO2 в атмосфере равно 5 . 10–9 Па, константа Генри равна 5,4 моль/л . атм, а константа скорости диссоциации сернистой кислоты – 2,7 . 10–2 моль/л.
Задача № 13. Что произойдет с популяцией карпа в замкнутом водоеме, если в последний произошел залповый сброс фенолов в количестве 25 кг. Равновесная концентрация растворенного кислорода в воде до сброса составляла 8 мг O2/л, объем водоема – 10000 м3. Оцените максимальный уровень загрязнения воды в водоеме.
Задача № 14. Средние концентрации неорганических соединений азота и фосфора в озере Вазель Южского района ивановской области в 1996 г. составили, г/м3: 1) аммоний солевой – 1,21; 2) нитрит – 0,12; 3) азот нитратов – 2,0; 4) фосфаты (в пересчете на Р) – 0,235. Содержание хлороформа в этот же период времени колебалось в пределах 34-60 мг. Средняя глубина озера равна 1 м. Рассчитанная средняя плотность потоков из донных отложений неорганического азота и фосфора составляет, соответственно, 1,5 и 0,7 г/м2 . год. Во-первых, обоснуйте оптимальное соотношение азота и фосфора в природных водах, это значение сравните с экспериментальными и сделайте соответствующие выводы. Во-вторых, рассчитайте время оборота азота и фосфора в системе вода – донные отложения и сделайте выводы о развитии процессов эвтрофирования. В-третьих, оцените категорию трофического состояния озера Вазаль.
Задача № 15. Определите форму нахождения соединений железа в воде, если последняя характеризуется следующими показателями: рН = 7, ре = 10 (концентрация железа в воде 10–4 моль/л).
Задача № 16. Оцените максимальную концентрацию 2,3,7,8-тетрахлорбензопарадиоксина (ТХДД) в воде, если его содержание в атмосферном воздухе составляет около 0,13 мг/м3, константа генри равна 0,2 моль/л . Па. Оцените возможные каналы выведения ТХДД из природных вод.
