
- •Физико-химические процессы в гидросфере Учебное пособие
- •Физико-химические процессы в гидросфере
- •1. Аномальные свойства воды и состав природных вод
- •Примеры решения задач
- •2. Способы классификации природных вод
- •Примеры решения задач
- •3. Основные процессы формирования химического состава природных вод
- •3.1. Процессы растворения газов в природных водах
- •3.2. Процессы растворения твердых веществ в природных водах
- •3.3. Жесткость природных вод
- •Примеры решения задач
- •4. Кислотно-основное равновесие в природных водоемах
- •4.1. Карбонатная система и рН атмосферных осадков
- •4.2. Растворимость карбонатов и рН подземных и поверхностных природных вод
- •4.3. Карбонатное равновесие в океане
- •4.4. Щелочность природных вод
- •4.5. Процессы закисления поверхностных водоемов
- •Примеры решения задач
- •5. Окислительно-восстановительные процессы в гидросфере
- •2.5.1. Окислительно-восстановительное равновесие
- •5.2. Взаимосвязь между окислительно-восстановительными и кислотно-основными характеристиками природных вод
- •5.3. Редокс-буферность природных вод
- •5.4. Особенности окислительно-восстановительных процессов в озерах
- •5.5. Особенности окислительно-восстановительных процессов в океане
- •5.6. Особенности окислительно-восстановительных процессов в подземных водах
- •5.7. Окислительно-восстановительные условия и миграция элементов
- •Примеры решения задач
- •Контрольные вопросы
- •Модуль № 2. Физико-химические процессы в гидросфере
- •Задачи ко второму учебному модулю
- •Ответы на задачи для самостоятельного решения
- •Литература
- •Приложение
- •Оглавление
4.5. Процессы закисления поверхностных водоемов
Выпадение атмосферных осадков с повышенным содержанием ионов водорода по отношению к равновесному может привести к серьезным изменениям в состоянии поверхностных водных систем озера и пруда. Можно условно выделить три стадии процесса их закисления.
В нормальном водоеме, несмотря на поступление кислых осадков, рН практически не меняется. Гидрокарбонат-ионы, присутствующие в поверхностных водоемах, успевают полностью нейтрализовать поступающие ионы Н+:
Н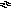 СО
СО![]() +
Н+
Н2О
+ СО2.
(56)
+
Н+
Н2О
+ СО2.
(56)
Так продолжается до тех мор, пока общая щелочность воды в водоеме не упадет примерно в 10 раз, до величины менее 0,1 ммоль/л. Это может произойти, например, при нарушении контакта данной воды с карбонатными породами. Такой водоем находится на первой стадии закисления. В этом случае в период наиболее интенсивного поступления кислых вод в водоем (осень – обильные дожди – и особенно весна – таяние снега) возможны значительные отклонения в величине рН поверхностных водоемов. Эти отклонения не носят ярко выраженного характера, и с прекращением интенсивного поступления кислых осадков водоем переходит в обычное состояние: рН поднимается до первоначальных значений. Необходимо отметить, однако, что даже эти кратковременные изменения чрезвычайно опасны для водных экосистем, поскольку их сроки совпадают с периодами размножения отдельных видов водных организмов. В этом случае изменение рН может привести к нарушению репродуктивных функций отдельных организмов или нарушить процесс воспроизводства для определенных популяций. На первом этапе закисления, например, могут погибнуть все земноводные организмы, икра и молодь, которые особенно чувствительны к изменениям рН.
На второй стадии закисления водоема рН воды обычно не поднимается выше 5,5 в течение всего года (отсутствует контакт с карбонатными породами); о таких водоемах обычно говорят как об умеренно кислых. На этой стадии закисления происходят значительные изменения в видовом составе живых организмов (рисунок 3).
На третьей стадии закисления рН водоемов стабилизируется на значениях рН < 5 (обычно рН 4,5), даже если атмосферные осадки имеют более высокие значения рН. Это связано с присутствием гумусовых веществ и соединений алюминия в водоемах и почвенном слое. Гумусовые соединения в основном представлены в водоемах растворами слабых органических кислот, имеющими рН < 5. Связывая или выделяя ионы Н+, эти кислоты стабилизируют значение рН в водоеме. Этому способствуют и соединения алюминия, практически всегда присутствующие в почве. При растворении или осаждении соединений алюминия также происходит связывание или выделение ионов водорода.
Как известно, ионы алюминия обладают высокой токсичностью по отношению ко многим видам водных живых организмов и человеку. Поэтому их поведение в процессах закисления необходимо рассмотреть более подробно.

Рис. 3. Влияние рН водоема на степень развития популяций водных организмов
Одним из
распространенных соединений алюминия
является гиббсит – А1(ОН)3.
При растворении гиббсита в растворе
могут присутствовать различные ионы,
из которых наиболее важными являются
Al3+,
Al(OH)![]() и А1(ОН)
и А1(ОН)![]() .
Каждый из них преобладает в определенных
интервалах рН, поэтому растворимость
гиббсита зависит от рН. При низких
значениях рН (рН < 4,5) в растворах
преобладают ионы А13+,
и процесс растворения можно представить
уравнением:
.
Каждый из них преобладает в определенных
интервалах рН, поэтому растворимость
гиббсита зависит от рН. При низких
значениях рН (рН < 4,5) в растворах
преобладают ионы А13+,
и процесс растворения можно представить
уравнением:
А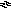 1(ОН)3
+ 3Н+
А13+
+ 3Н2О
(57)
1(ОН)3
+ 3Н+
А13+
+ 3Н2О
(57)
Константа равновесия этого процесса имеет вид:
![]() (58)
(58)
При рН 5,6 в растворе
преобладают ионы А1(ОН)![]() ,
и уравнение процесса растворения
гиббсита может быть представлено как
,
и уравнение процесса растворения
гиббсита может быть представлено как
А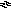 1(ОН)3
+ Н+
А1(ОН)
1(ОН)3
+ Н+
А1(ОН)![]() + Н2О
(59)
+ Н2О
(59)
Константа равновесия в этом случае имеет вид:
![]()
![]()
![]() (60)
(60)
При более высоких
значениях рН (рН > 7) в растворе
преобладают ионы А1(ОН)![]() ,
и уравнение процесса может быть записано
в виде:
,
и уравнение процесса может быть записано
в виде:
А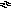 1(ОН)3
+ Н2О
А1(ОН)
1(ОН)3
+ Н2О
А1(ОН)![]() + Н+
(61)
+ Н+
(61)
Константу равновесия этого процесса можно рассчитать по уравнению:
![]() (62)
(62)
Суммарная активность форм растворенного алюминия (aAl)cyм равна сумме активностей основных ионов:
![]() (63)
(63)
Выражая активность ионов через значения соответствующих констант и активность ионов водорода, получим:
![]() (64)
(64)
Помимо рассмотренных выше ионов в растворах, равновесных с гиббситом, существует также ион А1(ОН)2+, но его концентрация не достигает значений, которые могли бы оказать заметное влияние на растворение А1(ОН)3–.
В разбавленных растворах, которые обычно представляют собой пресноводные поверхностные водоемы, с определенной степенью приближения можно принять коэффициенты активности ионов Аl3+ равными единице. Проведенные при этом допущении расчеты показывают, что при рН 6 концентрация ионов А13+ в растворе будет составлять всего 1.4 . 10–4 мг/л. С увеличением кислотности до значений рН 5 концентрация А13+ возрастет в 1000 раз и составит 0,14 мг/л, а при уменьшении рН до 4 в растворе будет присутствовать уже около 140 мг/л ионов А13+.
Изменение видового состава водных экологических систем (рисунок 3) при закислении водоемов во многом связано именно с увеличением содержания ионов А13+ в растворе, которые, переходя в нерастворимые соединения в организме рыб (наиболее часто в жабрах), являются причиной их гибели.
Следует отметить, что при уменьшении рН воды природного водоема (особенно при переходе в третью стадию закисления) резко возрастает содержание в воде и других примесей, в частности ионов тяжелых металлов, что, как и в случае с алюминием, может ускорить процесс гибели экосистемы.
