
- •Физико-химические процессы в гидросфере Учебное пособие
- •Физико-химические процессы в гидросфере
- •1. Аномальные свойства воды и состав природных вод
- •Примеры решения задач
- •2. Способы классификации природных вод
- •Примеры решения задач
- •3. Основные процессы формирования химического состава природных вод
- •3.1. Процессы растворения газов в природных водах
- •3.2. Процессы растворения твердых веществ в природных водах
- •3.3. Жесткость природных вод
- •Примеры решения задач
- •4. Кислотно-основное равновесие в природных водоемах
- •4.1. Карбонатная система и рН атмосферных осадков
- •4.2. Растворимость карбонатов и рН подземных и поверхностных природных вод
- •4.3. Карбонатное равновесие в океане
- •4.4. Щелочность природных вод
- •4.5. Процессы закисления поверхностных водоемов
- •Примеры решения задач
- •5. Окислительно-восстановительные процессы в гидросфере
- •2.5.1. Окислительно-восстановительное равновесие
- •5.2. Взаимосвязь между окислительно-восстановительными и кислотно-основными характеристиками природных вод
- •5.3. Редокс-буферность природных вод
- •5.4. Особенности окислительно-восстановительных процессов в озерах
- •5.5. Особенности окислительно-восстановительных процессов в океане
- •5.6. Особенности окислительно-восстановительных процессов в подземных водах
- •5.7. Окислительно-восстановительные условия и миграция элементов
- •Примеры решения задач
- •Контрольные вопросы
- •Модуль № 2. Физико-химические процессы в гидросфере
- •Задачи ко второму учебному модулю
- •Ответы на задачи для самостоятельного решения
- •Литература
- •Приложение
- •Оглавление
5.2. Взаимосвязь между окислительно-восстановительными и кислотно-основными характеристиками природных вод
Перенос электрона в редокс-процессе сопровождается переносом протона, обусловливая тем самым для реакций, протекающих в водном растворе, жесткую взаимосвязь между окислительно-восстановитель-ным и кислотно-основным равновесием. Например, если ион Fe(II) отдает электрон, то выделяются три иона водорода, что приводит в конечном результате к образованию труднорастворимого гидроксида железа (III) и увеличению концентрации ионов водорода в растворе:
[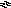 Fe(H2O)6]2+
Fe(OH)3
+ 3Н2О
+ 3Н+
+
Fe(H2O)6]2+
Fe(OH)3
+ 3Н2О
+ 3Н+
+
![]() (78)
(78)
Протеканием этой реакции объясняется кислый характер шахтных вод и образование характерного осадка «ржавчины» в местах выхода на поверхность подземных вод, содержащих ионы двухвалентного железа.
Величина
окислительно-восстановительного
потенциала реакций, протекающих с
участием ионов водорода или гидроксила,
зависит от рН раствора. Одной из форм
представления таких зависимостей
являются диаграммы
![]() –
рН или диаграммыEh
– рН. Диаграммы
эти идентичны, за исключением шкалы оси
ординат, масштаб которой изменяется в
соответствии с уравнением (75). При
температуре 298 К Eh
= 0,0591
–
рН или диаграммыEh
– рН. Диаграммы
эти идентичны, за исключением шкалы оси
ординат, масштаб которой изменяется в
соответствии с уравнением (75). При
температуре 298 К Eh
= 0,0591
![]() .
Недостаток использованияEh
в качестве
переменной состоит в том, что наклоны
границ различных полей устойчивости
зависят от температуры, чего удается
избежать в случае, когда переменной
является
.
Недостаток использованияEh
в качестве
переменной состоит в том, что наклоны
границ различных полей устойчивости
зависят от температуры, чего удается
избежать в случае, когда переменной
является
![]() .
.
Рассмотрим принципы
построения диаграммы
![]() –
рН на примере окислительно-восстановительных
реакций, определяющих пределы существования
или, как принято говорить, устойчивости
воды.
–
рН на примере окислительно-восстановительных
реакций, определяющих пределы существования
или, как принято говорить, устойчивости
воды.
Вода может окисляться
2Н2О
О2
+ 4Н+
+ 4![]() (79)
(79)
либо восстанавливаться:
2Н2О
+ 2![]()
H2
+ 2OH–
(80)
H2
+ 2OH–
(80)
Реакции (79) и (80)
определяют пределы изменения
![]() в воде. Совершенно очевидно, что рН
оказываетвлияние
на характеристики
обеих реакций.
в воде. Совершенно очевидно, что рН
оказываетвлияние
на характеристики
обеих реакций.
Перепишем уравнение (79) в виде:
![]() O2
+ H+
+
O2
+ H+
+![]()
![]() Н2О
(81)
Н2О
(81)
Константу равновесия этой реакции можно представить уравнением:
![]() (82)
(82)
В качестве граничных условий при описании пределов устойчивости воды обычно принимают давление кислорода 101 кПа (1 атм), при этом Р(кисл) = 1. Активность воды также можно принять равной единице. В этом случае уравнение (82) можно представить в виде:
![]() = 1/(Кан+)
(83)
= 1/(Кан+)
(83)
Прологарифмировав
уравнение (2.83), умножим его левую и правую
части на минус единицу; заменив выражения
отрицательных логарифмов активности
электронов и ионов водорода на
![]() и рН, получим:
и рН, получим:
![]() =lgK
– pH
(84)
=lgK
– pH
(84)
Величину логарифма константы равновесия этой реакции легко найти из значения энергии Гиббса образования молекул воды, поскольку G образования кислорода, ионов водорода и электронов по термодинамическим конвенциям принимаются равными нулю, поэтому
lg
К
=![]() (85)
(85)
Отсюда зависимость
![]() от рН при парциальном давлении кислорода,
равном 1 атм, будет иметь вид:
от рН при парциальном давлении кислорода,
равном 1 атм, будет иметь вид:
![]() = 20,8 – рН.
(86)
= 20,8 – рН.
(86)
В общем случае получим:
![]() =20,8+
=20,8+![]() –pH.
(87)
–pH.
(87)
Уравнение (87)
определяет окислительную границу
устойчивости воды. При заданном
значении рН для воды, находящейся в
равновесии с атмосферным кислородом,
(![]() )0
не может быть более положительным, чем
величина, определяемая уравнением (87).
)0
не может быть более положительным, чем
величина, определяемая уравнением (87).
Путем аналогичных
рассуждений можно получить зависимость
![]() –
рН для восстановительной границы
устойчивости воды:
–
рН для восстановительной границы
устойчивости воды:
![]() (88)
(88)
![]()
![]() ;
(89)
;
(89)
![]() (90)
(90)
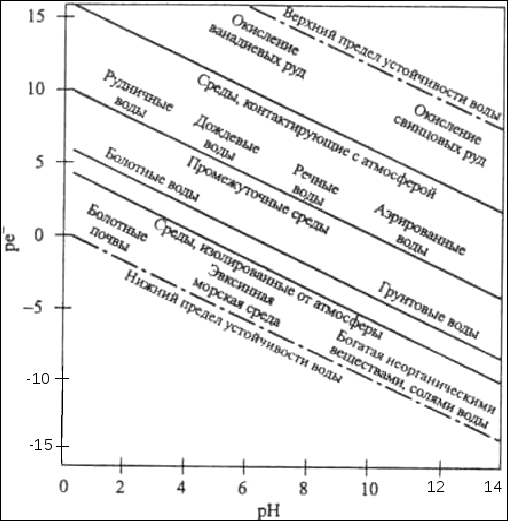
Рис. 4. Зависимость окислительно-восстановительного потенциала
(для различных природных вод) и пределов устойчивости воды от рН
Поскольку G реакции (88) равно нулю, то и значение логарифма константы равновесия этой реакции равно нулю. Поэтому при граничных условиях, когда парциальное давление водорода равно 1 атм, получаем уравнение:
![]() = –рН.
(91)
= –рН.
(91)
Природные воды обычно находятся в контакте с воздухом, в котором парциальные давления кислорода и водорода меньше 1 атм, поэтому их окислительно-восстановительные потенциалы будут находиться в интервале значений, определяемых уравнениями (86) и (91).
На рисунке 4
представлены зависимости величины
![]() от
рН для различных природных вод, имеющих
большое распространение. Однако следует
отметить, что в отсутствие катализаторов
разложение воды протекает очень
медленно. Поэтому вода может иметь
текущие значения
от
рН для различных природных вод, имеющих
большое распространение. Однако следует
отметить, что в отсутствие катализаторов
разложение воды протекает очень
медленно. Поэтому вода может иметь
текущие значения![]() более положительные, чем окислительный
предел (например, при растворении хлора
в воде), или более отрицательные, чем
восстановительный предел, описывающие
равновесную ситуацию.
более положительные, чем окислительный
предел (например, при растворении хлора
в воде), или более отрицательные, чем
восстановительный предел, описывающие
равновесную ситуацию.
Диаграммы
![]() –
рН(Eh
– рН)
являются удобным способом изобра-жения
областей устойчивости окисленных и
восстановленных форм определенных
окислительно-восстановительных систем.
Каждый отрезок прямой на диаграмме
отвечает зависимости
–
рН(Eh
– рН)
являются удобным способом изобра-жения
областей устойчивости окисленных и
восстановленных форм определенных
окислительно-восстановительных систем.
Каждый отрезок прямой на диаграмме
отвечает зависимости
![]() от
рН для определенной реакции. Если
величина
от
рН для определенной реакции. Если
величина![]() не
зависит от рН, отрезки параллельны оси
абсцисс. Вертикально расположенные
отрезки не связаны с протеканием
окислительно-восстановительных реакций,
обычно они определяют границы областей
фазовых переходов. В областях, где
значение
не
зависит от рН, отрезки параллельны оси
абсцисс. Вертикально расположенные
отрезки не связаны с протеканием
окислительно-восстановительных реакций,
обычно они определяют границы областей
фазовых переходов. В областях, где
значение![]() определяется величиной рН, отрезки
расположены наклонно. Тангенс угла
наклона определяется отношением
количества ионов водорода и электронов,
принимающих участие в данной реакции.
Следует отметить, что диаграммы
определяется величиной рН, отрезки
расположены наклонно. Тангенс угла
наклона определяется отношением
количества ионов водорода и электронов,
принимающих участие в данной реакции.
Следует отметить, что диаграммы![]() –
рН иEh
– рН
строятся при определенных значениях
концентраций реагирующих компонентов
и изменение концентраций приводит к
изменению границ соответствующих
областей.
–
рН иEh
– рН
строятся при определенных значениях
концентраций реагирующих компонентов
и изменение концентраций приводит к
изменению границ соответствующих
областей.
Как уже отмечалось
выше, в реальных природных водах
окислительно-восстановительные процессы
протекают при участии бактерий. В каждой
из окислительно-восстановительных
реакций участвует свой тип бактерий, и
реакции протекают в строгой
последовательности. Раньше протекают
реакции, обеспечивающие бактериям
наибольшую энергию, т. е. те реакции, для
которых в данных условиях
окислительно-восстановительный потенциал
имеет наибольшее значение. Поэтому
при построении обобщающих
![]() –
рН иEh
– рН диаграмм рассматриваются все
возможные для данной системы
окислительно-восстановительные процессы,
но на диаграмму в конечном итоге
наносятся лишь те, которые отвечают
более высоким редокс-уровням. Частный
случай построения и демонстрация
возможности использования диаграмм
–
рН иEh
– рН диаграмм рассматриваются все
возможные для данной системы
окислительно-восстановительные процессы,
но на диаграмму в конечном итоге
наносятся лишь те, которые отвечают
более высоким редокс-уровням. Частный
случай построения и демонстрация
возможности использования диаграмм
![]() –
рН для определения областей существования
отдельных компонентов системыFe
—
О
—
Н2О
рассмотрены в Примере 20.
–
рН для определения областей существования
отдельных компонентов системыFe
—
О
—
Н2О
рассмотрены в Примере 20.
