
- •Физико-химические процессы в гидросфере Учебное пособие
- •Физико-химические процессы в гидросфере
- •1. Аномальные свойства воды и состав природных вод
- •Примеры решения задач
- •2. Способы классификации природных вод
- •Примеры решения задач
- •3. Основные процессы формирования химического состава природных вод
- •3.1. Процессы растворения газов в природных водах
- •3.2. Процессы растворения твердых веществ в природных водах
- •3.3. Жесткость природных вод
- •Примеры решения задач
- •4. Кислотно-основное равновесие в природных водоемах
- •4.1. Карбонатная система и рН атмосферных осадков
- •4.2. Растворимость карбонатов и рН подземных и поверхностных природных вод
- •4.3. Карбонатное равновесие в океане
- •4.4. Щелочность природных вод
- •4.5. Процессы закисления поверхностных водоемов
- •Примеры решения задач
- •5. Окислительно-восстановительные процессы в гидросфере
- •2.5.1. Окислительно-восстановительное равновесие
- •5.2. Взаимосвязь между окислительно-восстановительными и кислотно-основными характеристиками природных вод
- •5.3. Редокс-буферность природных вод
- •5.4. Особенности окислительно-восстановительных процессов в озерах
- •5.5. Особенности окислительно-восстановительных процессов в океане
- •5.6. Особенности окислительно-восстановительных процессов в подземных водах
- •5.7. Окислительно-восстановительные условия и миграция элементов
- •Примеры решения задач
- •Контрольные вопросы
- •Модуль № 2. Физико-химические процессы в гидросфере
- •Задачи ко второму учебному модулю
- •Ответы на задачи для самостоятельного решения
- •Литература
- •Приложение
- •Оглавление
4.4. Щелочность природных вод
Одной из важнейших особенностей большинства природных вод является способность нейтрализовать ионы водорода. Эта способность называется щелочностью воды и определяется экспериментально при титровании пробы воды сильной кислотой, обычно НС1, в присутствии фенолфталеина (рН перехода окраски – 8,3) и затем метилоранжа (рН перехода окраски – 4,5).
Основными
компонентами, ответственными за процессы
связывания ионов водорода, в большинстве
природных вод являются ионы НСО![]() ,
СО
,
СО![]() и ОН–.
Другие ионы, источниками которых могут
служить органические кислоты, фосфаты,
бораты и т.
д., вносят лишь незначительный вклад
в процессы нейтрализации ионов водорода
и начинают играть определенную роль
лишь после связывания гидрокарбонат-ионов.
и ОН–.
Другие ионы, источниками которых могут
служить органические кислоты, фосфаты,
бораты и т.
д., вносят лишь незначительный вклад
в процессы нейтрализации ионов водорода
и начинают играть определенную роль
лишь после связывания гидрокарбонат-ионов.
Основные химические реакции, протекающие в водоеме при нейтрализации ионов водорода, можно представить следующими уравнениями:
Н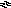 СО
СО![]() +
H+
H2O
+ CO2
(50)
+
H+
H2O
+ CO2
(50)
С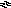 О
О![]() + H+
НСО
+ H+
НСО![]() (51)
(51)
О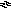 Н–
+
H+
H2O
(52)
Н–
+
H+
H2O
(52)
При экспериментальном
определении щелочности на первом этапе
(до рН перехода 8,3) связываются все ионы
гидроксила, и практически все ионы
карбоната переходят в НСО![]() (рисунок 2). Израсходованное при этом
количество кислоты соответствует
карбонатнойщелочности
воды. В
дальнейшем при титровании пробы (до рН
перехода 4.5) связываются практически
все гидрокарбонат-ионы (рисунок 2).
Поэтому суммарный расход кислоты
(израсходованной до рН 4,5) эквивалентен
содержанию ионов НСО
(рисунок 2). Израсходованное при этом
количество кислоты соответствует
карбонатнойщелочности
воды. В
дальнейшем при титровании пробы (до рН
перехода 4.5) связываются практически
все гидрокарбонат-ионы (рисунок 2).
Поэтому суммарный расход кислоты
(израсходованной до рН 4,5) эквивалентен
содержанию ионов НСО![]() ,
2СО
,
2СО![]() и
ОН–
и представляет общую
щелочность
воды. Таким
образом, численное значение щелочности
можно определить как сумму концентраций
ионов НСО
и
ОН–
и представляет общую
щелочность
воды. Таким
образом, численное значение щелочности
можно определить как сумму концентраций
ионов НСО![]() ,
ОН–
и удвоенной концентрации ионов СО
,
ОН–
и удвоенной концентрации ионов СО![]() :
:
Щ = [НСО![]() ]
+ 2[СО
]
+ 2[СО![]() ]
+ [ ОН–]
(53)
]
+ [ ОН–]
(53)
где Щ – общая щелочность воды, моль/л.
Если рН водной пробы еще до титрования ниже 4,5, то о такой воде говорят как о воде с нулевой щелочностью.
Необходимо четко представлять себе разницу между основностью и щелочностью раствора. Основность раствора характеризует лишь концентрацию ионов гидроксила в данный момент времени. Щелочность же показывает как бы резервную емкость воды, способность нейтрализовать определенное количество ионов водорода.
Так, например, раствор, содержащий 0,001 моль/л NaOH, будет иметь рН 11 и общую щелочность, равную концентрации ОН-ионов: Щ = 0,001 моль/л. В то же время раствор, содержащий 0,1 моль/л NaНСО3 будет иметь более низкое значение рН (рН 8,3), но его щелочность, которая будет определяться в основном концентрацией гидрокарбонат-ионов, будет в 100 раз больше, чем у раствора NaOH с концентрацией 0,001 моль/л.
Величина щелочности природных под имеет большое значение и с точки зрения фотосинтеза, протекающего в водоемах. В упрощенном виде процесс фотосинтеза может быть представлен следующим образом:
СО2(p-p)
+
H2O![]() (54)
(54)
НСО![]() +
H2O
+
H2O![]() (55)
(55)
Следовательно,
при связывании
углерода и
синтезе органических соединений
в случае
отсутствия дополнительного
поступления диоксида
углерода
возрастает рН
раствора, а
количество синтезируемых органических
соединений
зависит от содержания
СО2
и НСО![]() врастворе, или
от его щелочности.
врастворе, или
от его щелочности.
Иногда и природных водоемах в связи с бурным протеканием процессов фотосинтеза и недостаточной скоростью поступления диоксида углерода рН поднимается до 10 и выше. Такие высокие значения рН, как и закисление, отрицательно сказываются на развитии водных экосистем.
Поскольку, как
отмечалось
выше, для поверхностных
водоемом, находящихся в
равновесии с карбонатом кальция
(кальцитом) и
диоксидом углерода, содержащимся
п атмосферном воздухе, рН воды
должен составлять
7,3-8,4, значение
щелочности в этих водоемах
будут определяться лишь концентрацией
гидрокарбонат-ионов (распределительная
диаграмма на рисунке
2). Концентрация
НСО![]() -ионовв таких
водоемах, >
а
следовательно, и
щелочность будут равны примерно
1 ммоль/л.
-ионовв таких
водоемах, >
а
следовательно, и
щелочность будут равны примерно
1 ммоль/л.
Следует отметить, что при отсутствии процессов растворения или осаждения щелочность воды остается неизменной. При изменении рН среды происходят лишь взаимные трансформации компонентов карбонатной системы. Поэтому щелочность часто называют «консервативной величиной».
