При нагревании выше 120 °С циклические молекулы превращаются в полимерные цепи Sm.
Процесс протекает заметно при ~160 °С, вязкость η резко увеличивается от 6,5·10–3 Па·с (155 °С) до 93,3 Па·с (187 °С).
При 187 °С расплав практически нетекуч.
При нагревании выше 187 °С цепи разрываются, укорачиваются, и жидкость вновь становится подвижной.
Пластическую (стеклообразную) серу получают при резком охлаждении расплавленной серы (например, выливанием расплава серы с температурой ~ 200 °С в холодную воду).
При комнатной температуре стеклообразный сплав пластичен и постепенно кристаллизуется.
|
|
|
|
|
|
|
|
|
|
Среднее содержание селена в земной коре 1,4·10–5 % по мас- |
|
|
Селен Se |
|
|
|
|
се, в воде морей и океанов 4·10–3 мг/л. |
|
|
|
|
|
|
|
|
|
|
|
|
|
Помимо самородного селена известно более 50 минералов (например, берцелианит Cu2Se, науманнит Ag2Se, халькоменит
CuSeO3·2Н2О).
Извлекают селен в основном из медных, пиритных, свинцовых, никелевых и других руд, где он находится в рассеянном состоянии.
Содержание селена в пирите, галените, висмутине и других сульфидах, а также в вулканической сере достигает нескольких процентов.


 Существует ряд модификаций селена.
Существует ряд модификаций селена. 


Наиболее стабилен серый селен (γ-Se, «металлический» селен) с гексагональной кристаллической решеткой. Его получают из других форм при их длительном нагревании, медленном охлаждении расплава, конденсацией паров и т.д. Структура γ-Se состоит из параллельных спиральных цепей.
Три метастабильные моноклинные модификации красного селена подобно сере содержат кольцевые молекулы Se8 в форме короны.
Быстрым охлаждением расплава получают стекловидный черный селен – хрупкое вещество со стеклянным блеском от красно-коричневого до голубовато-черного цвета, которое, как и жидкий селен, состоит из плоских зигзагообразных цепочечных молекул.
|
|
|
|
|
|
|
Теллур Те |
|
|
Теллур относится к редким рассеянным элементам, |
|
|
|
|
|
его содержание в земной коре составляет около |
|
|
|
|
|
|
|
|
|
|
|
10–7 % по массе. |
|
|
|
|
|
|
|
Помимо редких включений самородного теллура известно около 100 минералов, содержащих теллур: алтаит (РbТе), гессит (Ag2Te), сильванит (AuAgTe4), калаверит (АuТе2), тетрадимит (Bi2Te2S), сульфидные минералы – халькопирит, галенит, пирит, пентландит и другие (в виде изоморфной примеси).
Теллур извлекают в основном из медных, свинцовых, пиритных руд, где он находится в рассеянном состоянии (известны золототеллуровые месторождения с собственно теллуровой минерализацией, не имеющие существенного значения).
Структура кристаллического теллура подобно селену состоит из параллельно расположенных спиральных цепочек.
Расплав теллура не образует стекла при тех же условиях охлаждения, что сера и селен.
18.1.Система S–As
Впределах области стеклообразования (от чистой серы до ~45 ат. % As) образуется два химических соединения:
Структурными единицами в As2S5 являются искаженные тетраэдры, в которых три мостиковые одинарные связи As–S и одна немостиковая двойная связь As=S.
As2S5 |
кристаллизуется под давлением, |
плавится инконгруэнтно |
As2S3 |
минерал аурипигмент желтого цвета, |
плавится при ~315 °С |
В As2S3 структурными единицами являются пирамиды AsS3/2 с атомом мышьяка в вершине и тремя мостиковыми связями, где мостиком являются атомы серы.
153
Изотермы вязкости расплавов системы S–As
Вязкость стекол и температуры стеклования существенно возрастают с ростом содержания мышьяка.
На кривых отчетливо виден максимум, соответствующий составу соединения As2S3.
18.2. Система Sе–As
В области стеклообразования (от чистого селена до 61 ат. % As) образуется два химических соединения:
As2Sе3 |
кристаллизуется |
конгруэнтно, |
плавится при ~370 °С |
AsSе |
кристаллизуется |
конгруэнтно, |
|
плавится при ~295 °С |
Структурные единицы соединений построены аналогично таковым в соединениях мышьяка с серой.
Изокомы сплавов системы Se–As
Изокомы возрастают при увеличении концентрации мышьяка (как и в системе с серой, при составе соединений имеются максимумы, которые при малых вязкостях сливаются в один широкий).
18.3. Система Sе–Ge
|
|
|
|
|
|
|
В области стеклообразования (от чистого |
селена до |
|
GeSe2 |
+ L |
|
25 ат. % Ge) образуется эвтектика: |
|
|
|
|
|
|
|
|
Структура стекол состоит из цепочек и колец, образованных селеном, а также из тетраэдров GeSe4/2.
Температуры стеклования и вязкость существенно увеличиваются с ростом содержания германия.
Изокомы сплавов системы Se–Ge
18.4. Особенности структуры халькогенидных стекол двойных систем
Структурные единицы в халькогенидных системах похожи на структурные единицы оксидных систем.
Халькогениды германия
и GeS2) являются аналогами кремнезема SiO2, в котором каждая структурная единица соединена с соседними через четыре мостиковые связи.
Цепочечная или полимерная структура халькогенов, в которой каждый атом связан с соседними двумя мостиковыми связями.
Халькогениды мышьяка по структуре аналогичны борному ангидриду, в котором каждая структурная единица связана с соседними через три мостиковые связи.
Изменение структуры каркаса в халькогенидных системах происходит не так, как в оксидных системах.
Структурные единицы с разным числом мостиковых связей образуются без участия модификаторов.
Анализ дифракции рентгеновских лучей показал изменение структуры ближнего порядка в кристаллическом и стеклообразном состояниях халькогенидов.
Соеди- |
Плотность, г/см3 |
Валентные углы, |
Координационные |
Tg,◦C |
нение |
|
|
градусы |
числа |
|
Cтекло |
Кристалл |
As |
S, Se,Te |
As |
S, Se,Te |
|
As2S3 |
3,17 |
3,4 |
104,6±3,0 |
110±14 |
3,4 |
2,0 |
175 |
(2,94 |
|
|
|
|
|
в стекле) |
|
|
As2Se3 |
4,6 |
4,8–5,21 |
98,0±5,0 |
88,0±2,4 |
3,1 |
2,0 |
170 |
|
|
|
|
|
|
|
|
|
|
|
|
|
4,5 |
3,0 |
|
As2Te3 |
5,35 |
6,24 |
92,5±4,5 |
90,0±4,0 |
(3,9 |
(2,6 |
140 |
|
|
|
|
|
в стекле) |
в стекле) |
|
Длины связей при переходе кристалл – стекло практически не меняются, но изменение валентного угла и координационного числа свидетельствует об изменении характера межатомной связи.
Халькогениды мышьяка являются полупроводниками, для которых ширина оптической запрещенной зоны зависит от атомной массы халькогена.
Атом As использует для связи с атомами халькогена в основном sp2-гибридные орбитали с примесью р-состояний.
Атомы Se и Te связываются с атомами As посредством практически чистых р-орбиталей (угол связи
~90°).
При увеличении атомной массы халькогена (при переходе от серы к теллуру) связи атома мышьяка приобретают все больший р-характер – явление «металлизации связей», из-за которого уменьшается и способность расплавов к образованию стекол.
Металлизация связей, выражающаяся в увеличении вклада р-состояний, приводит к уменьшению ширины запрещенной зоны (в тонких слоях стекло на основе As2S3 имеет на просвет темно-красный оттенок, а уже As2Se3 совершенно непрозрачно в видимом диапазоне).
Cоеди- |
Ширина запрещенной |
нение |
зоны при 300 К, эВ |
Кристалл |
Стекло |
As2S3 |
2,56 |
2,0 |
As2Se3 |
1,7 |
1,5 |
As2Te3 |
0,48 |
0,62 |
Лекция 19. ХАЛЬКОГЕНИДНЫЕ СТЕКЛА (продолжение)
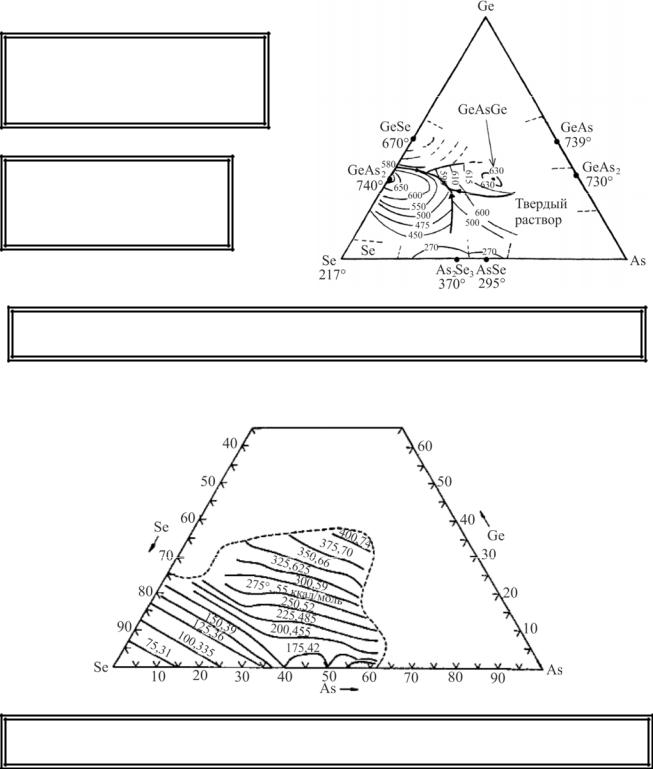
19.1.Система As–Ge–Se
Вобласти стеклообразования
образуется тройное соединение AsGeSe (плавится конгруэнтно при 635 °С).
Структурный каркас стекол образуется структурными единицами GeSe4/2, AsSe3/2, As2Se4/2.
В системе существуют тройные эвтектики, которые минимизируют склонность стекол к кристаллизации.
Изокомы системы As–Ge–Se (для вязкости 1013 Па)
Температуры стеклования увеличиваются с ростом содержания Ge и достигают максимума при составе, соответствующем соединению AsGeSe.
Частичное замещение германия оловом или свинцом уменьшает области стеклообразования, стягивая их к селену (металлизация связей).
Замещение мышьяка сурьмой или фосфором, а селена серой значительно увеличивает области образования стекол.
В состав халькогенидных стекол также входят щелочные металлы, таллий, серебро и некоторые другие.
Эти элементы образуют сульфиды, аналогичные оксидам (например, Tl2S, Na2S), и их роль в структуре такая же, как роль щелочных металлов в силикатных системах.
В халькогенидных системах образуются немостиковые атомы S–, около которых находятся катионы (например, AsS2/2S–Na+).
Галогены Cl, Br и J могут входить в состав халькогенидных стекол в значительных количествах (например, системы As–S–Cl, As–S–Br, As–S–J и аналогичные системы с германием).
В структурных единицах галоген присоединяется непосредственно к мышьяку, остальные связи мышьяка с серой остаются мостиковыми.
Образующаяся цепочечная структура имеет низкую температуру стеклования, так как связи между цепочками обеспечиваются слабым вандерваальсовым взаимодействием (например, для стекла, содержащего 19 ат. % As, 34 ат. % S, 47 ат. % Br, Тg ниже –60 °С).
Эта группа материалов используется в качестве оптических клеев, прозрачных в ИКобласти, для склейки оптических деталей, изготовленных из халькогенидных стекол.













 Существует ряд модификаций селена.
Существует ряд модификаций селена. 

