
Химия окружающей среды учебное пособие
..pdfЩелочность природных вод
Одной из важнейших особенностей большинства природных вод является способность нейтрализовать ионы водорода. Эта способность воды называется щелочностью и определяется экспериментально при титровании пробы воды сильной кислотой, обычно HCl, в присутствии фенолфталеина (рН перехода окраски = 8,3) и затем метилоранжа (рН перехода окраски = 4,5).
Основными компонентами, ответственными за процессы связывания ионов водорода, в большинстве природных вод
являются ионы HCO3 , CO32 , ОН–. Другие ионы, источника-
ми которых могут служить органические кислоты, фосфаты, бораты и т.д., вносят лишь незначительный вклад в процессы нейтрализации ионов водорода и начинают играть определенную роль лишь после связывания гидрокарбонат-ионов. Основные химические реакции, протекающие в водоеме при нейтрализации ионов водорода, можно представить следующими уравнениями:
HCO3 + Н+ Н2О + СО2 |
(6.6) |
CO32 + Н+ HCO3 |
(6.7) |
ОН– + Н+ Н2О |
(6.8) |
При экспериментальном определении щелочности на первом этапе (до рН 8,3) связываются все ионы гидроксила,
и практически все ионы карбоната переходят в HCO3 . Из-
расходованное при этом количество кислоты соответствует
карбонатной щелочности воды. В дальнейшем при титрова-
нии пробы (до рН 4,5) связываются практически все гидро- карбонат-ионы. Поэтому суммарный расход кислоты (израсходованной до рН 4,5) эквивалентен содержанию ионов
HCO3 , 2 CO32 и ОН– и представляет общую щелочность во-
121
ды. Таким образом, численное значение щелочности можно определить как сумму концентраций ионов HCO3 , ОН– и удвоенной концентрации ионов CO32 :
|
|
+ 2 |
|
2 |
– |
(6.9) |
Щ = HCO3 |
CO3 |
+[ОН ], |
||||
где Щ – общая щелочность воды, моль/л.
Если рН пробы воды еще до титрования ниже 4,5, то о такой воде говорят как о воде с нулевой щелочностью.
Необходимо четко представлять себе разницу между ос-
новностью и щелочностью раствора. Основность раствора характеризует концентрацию ионов гидроксила в данный момент времени. Щелочность же показывает резервную емкость воды, способность нейтрализовать определенное количество ионов водорода. Так, например, раствор, содержащий 0,001 моль/л NaOH, будет иметь рН11 и общую щелочность, равную концентрации ОН-ионов: Щ = 0,001 моль/л. В то же время раствор, содержащий 0,1 моль/л NaHCO3, будет иметь более низкое значение рН (8,3), но его щелочность, которая будет определяться в основном концентрацией гидрокарбо- нат-ионов, будет в 100 раз больше, чем у раствора NaOH с концентрацией 0,001 моль/л. Величина щелочности природных вод имеет большое значение с точки зрения фотосинтеза, протекающего в водоемах [39]. В упрощенном виде уравнения фотосинтеза могут быть представлены следующим образом:
СО2(г) + Н2О СН2О + О2 |
(6.10) |
|
hv |
+ ОН– |
(6.11) |
HCO3 + Н2О СН2О + О2 |
||
Следовательно, при связывании углерода и синтезе органических соединений в случае отсутствия дополнительного поступления диоксида углерода возрастает рН раствора, а количество синтезируемых органических соединений зави-
122
сит от содержания СО2, HCO3 в растворе и от щелочности
воды.
Иногда в природных водоемах в связи с бурным протеканием процессов фотосинтеза и недостаточной скоростью поступления диоксида углерода рН поднимается до 10 и выше. Такие высокие значения рН, как и закисление, отрицательно сказываются на развитии водных экосистем.
Для поверхностных водоемов, находящихся в равновесии с карбонатом кальция (кальцитом) и диоксидом углерода, содержащимся в атмосферном воздухе, рН воды должен составлять 7,3–8,4, значение щелочности в этих водоемах будут определяться лишь концентрацией гидрокарбонат-ионов.
Концентрация HCO3 -ионов в таких водоемах, а следова-
тельно, и щелочность будут равны примерно 1 ммоль/л.
К числу процессов, приводящих к повышению щелочности природных вод, также относятся:
– гидролиз природных солей, образованных сильными основаниями и слабыми кислотами. Все главные катионы, находящиеся в воде (К+, Nа+, Са2+), соответствуют сильным основаниям. Их соли с анионами слабых кислот гидролизуются с образованием гидроксид-ионов:
2СаСО3 + 2Н2О Са(НСО3)2 + Са(ОН)2 |
(6.12) |
CO32 + Н2О HCO3 + ОН– |
(6.13) |
– процессы фотосинтеза в освещенных водоемах. Организмы, для существования которых необходима щелочная среда (рН > 8) для получения углерода в виде СО2 должны расщеплять другие компоненты карбонатной системы:
HCO3 СО2 раств + ОН–раств |
(6.14) |
В результате рН природных вод может увеличиваться до
8,5÷10,5.
123
Следует отметить, что при отсутствии процессов растворения или осаждения щелочность воды остается неизменной. При изменении рН среды происходят лишь взаимные трансформации компонентов карбонатной системы. Поэтому щелочность часто называют консервативной величиной.
6.1. Процессы закисления поверхностных водоемов
Выпадение атмосферных осадков с повышенным содержанием ионов водорода по отношению к равновесному может привести к серьезным изменениям в состоянии поверхностных водных систем озера и пруда. Можно условно выделить три стадии процесса их закисления.
В природном водоеме, несмотря на поступление кислых осадков, рН практически не меняется. Гидрокарбонат-ионы, присутствующие в поверхностных водоемах, успевают полностью нейтрализовать поступающие ионы Н+:
HCO3 + Н+ = Н2О +СО2 |
(6.15) |
Так продолжается до тех пор, пока общая щелочность воды в водоеме не упадет примерно в 10 раз, до величины менее 0,1 ммоль/л. Это может произойти, например, при нарушении контакта данной воды с карбонатными породами. Такой водоем находится на первой стадии закисления. В этом случае в период наиболее интенсивного поступления кислых вод в водоем (осень – обильные дожди, весна – таяние снега) возможны значительные отклонения величины рН поверхностных водоемов. Эти отклонения не носят ярко выраженного характера. И с прекращением интенсивного поступления кислых осадков водоем переходит в обычное состояние: рН поднимается до первоначальных значений. Необходимо отметить, однако, что даже эти кратковременные изменения чрезвычайно опасны для водных систем. Поскольку их сроки совпадают с периодами размножения от-
124
дельных видов водных организмов. В этом случае изменение рН может привести к нарушению репродуктивных функций отдельных организмов или нарушить процесс воспроизводства для определенных популяций. На первом этапе закисления, например, могут погибнуть все земноводные организмы, икра и молодь, которые особенно чувствительны к изменениям рН.
На второй стадии закисления водоема рН воды обычно не поднимается выше 5,5 в течение всего года (отсутствует контакт с карбонатными породами); о таких водоемах обычно говорят как об умеренно кислых. На этой стадии закисления происходят значительные изменения в видовом составе живых организмов.
На третьей стадии закисления рН водоемов стабилизируется на значениях рН < 5 (обычно рН 4,5), даже если атмосферные осадки имеют более высокие значения рН. Это связано с присутствием гумусовых веществ и соединений алюминия в водоемах и почвенном слое. Гумусовые соединения
восновном представлены в водоемах растворами слабых ор-
ганических кислот, имеющими рН < 5. Связывая или выделяя ионы Н+, эти кислоты стабилизируют значение рН в водоеме. Этому способствуют и соединения алюминия, практически всегда присутствующие в почве. При растворении или осаждении соединений алюминия также происходит связывание или выделение ионов водорода.
Как известно, ионы алюминия обладают высокой токсичностью по отношению ко многим видам водных живых организмов и человеку. Поэтому их поведение в процессах закисления необходимо рассмотреть более подробно.
Одним из распространенных соединений алюминия является гиббсит – Al(OH)3. При распространении гиббсита
врастворе могут присутствовать различные ионы, из кото-
рых наиболее важными являются Al+3, Al(OH)2 и Al(OH)4 . Каждый из них преобладает в определенных интервалах рН,
125
поэтому растворимость гиббсита зависит от рН. При низких значениях рН (рН < 4,5) в растворах преобладают ионы Al3+, и процесс растворения можно представить уравнением
Al(OH)3 + 3Н+ = Al3+ + 3Н2О |
(6.16) |
||
Константа равновесия этого процесса имеет вид |
|
||
K 3 a |
3 |
a3 |
(6.17) |
Al |
Al |
Н |
|
При рН = 5,6 в растворе преобладают ионы |
Al(OH)2 |
||
и уравнение процесса растворения гиббсита может быть представлено как
Al(OH)3 + Н+ = Al(OH)2 + Н2О |
(6.18) |
Константа равновесия в этом случае имеет вид |
|
KAl(OH)2+ aAl(OH)2+ aH+ |
(6.19) |
При более высоких значениях рН (рН > 7) в растворе преобладают ионы Al(OH)4 и уравнение процесса может быть записано в виде
Al(OH)3 + Н2О = Al(OH)4 + Н+ |
(6.20) |
Константу равновесия этого процесса можно рассчитать по уравнению
KAl OH |
aAl OH |
aH |
(6.21) |
4 |
4 |
|
|
Суммарная активность форм растворенного алюминия (аAl)сум равна сумме активностей основных ионов:
aAl сум aAl 3 |
aAl(OH)2 aAl(OH)4 |
(6.22) |
Выражая активность ионов через значения соответствующих констант и активность ионов водорода, получим
126
aAl |
сум |
K |
Al |
+3 |
a3 |
K |
+ a |
H |
K |
a 1 (6.23) |
|
|
|
|
H |
|
Al(OH)2 |
|
Al(OH)4 |
H |
|||
Помимо рассмотренных выше ионов в растворах, равновесных с гиббситом, существует также ион Al(OH)2+, но его концентрация не достигает значений, которые могли бы оказать заметное влияние на растворение Al(OH)3.
В разбавленных растворах, которые обычно представляют собой пресноводные поверхностные водоемы, с определенной степенью приближения можно принять коэффициенты активности ионов Al3+, равными единице. Проведенные расчеты показывают, что при рН = 6 концентрация ионов алюминия Al3+ в растворе будет составлять всего 1,4·10–4 мг/л. С увеличением кислотности до значений рН = 5 концентрация алюминия Al3+ возрастает в 1000 раз и составит 0,14 мг/л, а при уменьшении рН до 4 в растворе будет присутствовать уже около 140 мг/л ионов алюминия Al3+.
Изменение видового состава водных экологических систем при закислении водоемов во многом связано именно с увеличением содержания ионов Al3+ в растворе, которые, переходя в нерастворимые соединения в организме рыб (наиболее часто в жабрах), являются причиной их гибели.
Следует отметить, что при уменьшении рН воды природного водоема (особенно при переходе в третью стадию закисления) резко возрастает содержание в воде и других примесей, в частности ионов тяжелых металлов, что, как и в случае с алюминием, может ускорить процесс гибели экосистемы.
6.2. Круговорот углерода в океане
На протяжении геологической истории Земли углерод, выделявшийся из мантии в виде газообразных продуктов, а также находившийся в первичной атмосфере, накапливался в земной коре преимущественно в виде карбонатных отложений морского происхождения (1,3·1016 т), крис-
127
таллических пород (1016 т), каменного угля и нефти (3,4·1015 т). Эти отложения являются подлинными «кладовыми» углерода, медленно расходующими и пополняющими свои запасы. Их пополнение в большей части идет через океан [40].
В океане происходит непрерывный обмен углерода в форме СО2 между раствором и живым органическим веществом. В зависимости от концентрации растворенного СО2 меняются соотношения между компонентами карбонатной системы. Главная часть углерода океана заключена в растворенных карбонатах и гидрокарбонатах, представляющих собой основу мощной буферной системы океана.
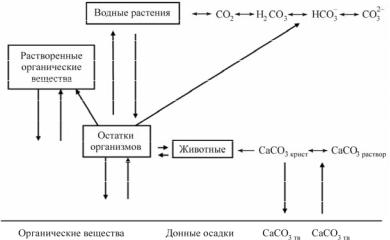
Круговорот углерода в океане схематически изображен на рис. 6.1.
Рис. 6.1. Круговорот углерода в водных системах [38]
Одновременно протекает обмен углерода в форме органических и неорганических соединений между водной массой океана и его донными осадками. Здесь преобладает осаждение карбоната кальция.
128
При фотосинтезе также идет процесс поглощения двуокиси углерода и выделения водными организмами.
Они представляют собой одну из фаз общего круговорота углерода в литосфере. При дифференцировании по отдельным формам сумма углерода в океане складывается из следующих величин: живое органическое вещество 0,03·1012 т, неживое органическое вещество 10·1012 т.
СО2 + H2CO3 = 0,8·1012 т,
HCO3 + CO32 = 114,7·1012 т.
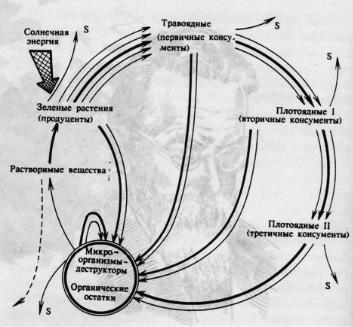
Различают три круговорота углерода, действующих одновременно и взаимосвязанно:
1. Биологический круговорот протекает по схеме, изображенной на рис. 6.2.
Рис. 6.2. Биологический круговорот углерода [38]
Этот круговорот по интенсивности превосходит все остальные. Протекая на суше и в океане, в последнем более тесно связан с производными угольной кислоты.
129
2. Большой геологический круговорот протекает медленно. Этот круговорот, продолжая биологический, охватывает всю литосферу по схеме, изображенной на рис. 6.3.
Рис. 6.3. Большой геологический круговорот [38]
3. Биолого-технический круговорот сходен с первым, но включает еще органогенные отложения прежних геологических эпох (нефть, каменный уголь), которые посредством деятельности человека все более вовлекаются в природный круговорот по следующей схеме (рис. 6.4).
130
