
Химия окружающей среды учебное пособие
..pdfдля решения задачи необходимо составить произведения активностей в различных природных водах:
для первой воды
(ПА)1 = а1(Са2+)а1 SO24 = 10–3 · 10–1,5 = 10–4,5 (моль/л)2;
для второй воды
(ПА)2 = а2(Cа2+) а2 SO24 = 10–2,8 · 10–2 = 104,8 (моль/л)2.
Поскольку (ПА)2 < (ПА)1, т.е. (10–4,8 < 10–4,5), вторая природная вода более агрессивна по отношению к гипсу.
Ответ: вторая вода более агрессивна по отношению к гипсу.
ПРИМЕР 5.3. Какой процесс – растворение или осаждение гипса – будет происходить при его контакте с природной водой, в которой активности катионов кальция и анионов
SO24 составляют 10–4 и 10–2 моль/л соответственно? Темпе-
ратура и давление соответствуют стандартным значениям. Решение. Процесс растворения гипса, как было сказано,
можно описать уравнением реакции CaSO4 · 2H2O ↔ Ca2+ +
+ SO24 + 2H2O.
Направление процесса (осаждение или растворение) можно определить по значению показателя степени неравновесности:
= (ПА)прод/ Kравн.
Произведение активностей продуктов процесса растворения гипса в данном случае следует принять равным произведению активностей соответствующих ионов в природной воде, поскольку для этой воды и необходимо определить степень неравновесности. Произведение активностей
(ПА)прод aСа2 aSO24- = 10–4 · 10–2 = 10–6 (моль/л)2.
111
Значения константы равновесия реакции растворения гипса можно определить из термодинамических данных по уравнению
lg Kр0еакц = – Gр0еакц /(2,3RT0).
Значение Gр0еакц определим из выражения
G0 |
|
= ΣΔG0 |
– ΣΔG0 . |
|
реакц |
прод |
|
реакц |
|
Gр0еакц = |
Gобр0 (Са2+) + |
Gобр0 SO42 + |
||
+ 2 G0 |
(Н2О) – G0 |
|
(СаSO4 · 2H2O). |
|
обр |
|
обр |
|
|
Подставив значения энергии Гиббса образования ионов и соединений в стандартных условиях (табл. 5 приложения) в данное уравнение, получим
Gр0еакц = (–552,70) + (–743,99) + 2(–237,23) – (–1799,8) =
= 28,65 (кДж/моль) = 28,65 · 103 (Дж/моль).
Логарифм константы равновесия
lg Kр0еакц = –28, 65 · 10 3/ (2, 3 · 8, 31 · 298, 3) = –5, 0.
Константа равновесия процесса растворения гипса
Kр0еакц = 9,4 · 10–6.
Значение показателя неравновесности составит:
Ө = 10–6 / (9,4 · 10–6) = 0,1.
Поскольку Ө < 1, раствор ненасыщен относительно гипса и идёт процесс его растворения.
Ответ: будет происходить растворение гипса.
112

ПРИМЕР 5.4. Какой из минералов, не содержащих примесей, гипс (CaSO4 · 2H2O) или ангидрид (СаSO4), более устойчив в водном растворе:
а) при стандартных условиях; б) при нормальном атмосферном давлении и температу-
ре 90 °С?
Решение. Относительную устойчивость минералов можно определить по величине показателя неустойчивости:
I lg ПА прод 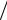 0 ПА реаг .
0 ПА реаг .
K
Чем большее значение имеет показатель неустойчивости, тем менее устойчиво данное соединение в растворе.
Представим процесс растворения данных минералов в виде уравнений реакций:
CaSO4 · 2H2O Ca2+ + SO24 + 2H2O,
CaSO4 Ca2+ + SO24
Следует обратить внимание на то, что в обоих случаях
впроцессе растворения образуются одни и те же ионы. Поэтому для одной и той же воды, относительно которой будет рассматриваться устойчивость минералов, величина (ПА)прод
вобоих случаях будет постоянной.
Поскольку по условию задачи минералы не содержат примесей, (ПА)реаг в обоих случаях равны единице.
Таким образом, показатель устойчивости будет тем больше, чем больше константа равновесия реакции, и для ответа на вопрос задачи необходимо сравнить значения констант равновесия процессов растворения гипса и ангидрита.
Поскольку константы равновесия процессов растворения зависят от температуры и давления, рассмотрим устойчивость минералов в различных условиях.
113
Процесс растворения протекает при стандартных условиях. В этом случае константы равновесия могут быть определены из уравнения:
lg Kр0еакц = – Gр0еакц / (2,3 RT°).
Для процесса растворения гипса значение константы равновесия при стандартных условиях составляет:
Kр0еакц = 9,4 · 10–6.
Для процесса растворения ангидрита имеем
Gр0еакц = ΣΔGпрод0 – ΣΔGр0еаг ;
Gр0еакц = Gобр0 (Са2+) + Gобр0 SO24 – Gобр0 (СаSO4).
Подставив значения энергии Гиббса образования ионов и соединений в стандартных условиях (табл. 5 приложения) в данное уравнение, получим
Gр0еакц = (–552,70) + (–743,99) – (–1323,90) =
= 27,21 (кДж/моль) = 27,21 · 103 (Дж/моль).
Логарифм константы равновесия процесса растворения ангидрита можно представить как
lg Kр0еакц = –27,21 · 103 / (2,3 · 8,31 · 298) = –4,77.
Константа равновесия процесса растворения ангидрита:
Kр0еакц = 1,68 · 10–5.
Поскольку константа равновесия процесса растворения гипса меньше, чем ангидрита, гипс более устойчив в водном растворе при стандартных условиях.
Процесс растворения протекает при нормальном давлении и температуре 90 °С. Для определения констант равнове-
114

сия процессов растворения гипса и ангидрита воспользуемся уравнением, связывающим константы равновесия, определённые при различных температурах процесса:
lg К1/ К0 = Нреакц (1/Т0 – 1/Т1)/2,3R.
Значения энтальпии реакции можно определить по уравнению
Нреакц = ΣΔНпрод0 |
– ΣΔНр0еаг . |
|
Для процесса растворения гипса имеем |
|
|
Нр0еакц = Нобр0 (Са2+) + Нобр0 |
SO42 + 2 |
Нобр0 (Н2О) – |
–Нобр0 (СаSO4 · 2 Н2О).
Подставив значения энтальпии образования ионов и соединений в стандартных условиях (см. табл. 6 приложения)
вданное уравнение, получим
Нр0еакц = (–542,7) + (–909,3) + 2(–285,8) – (–2027,7) =
= 4,1(кДж/моль) = 4,1 · 103 (Дж/моль).
Логарифм отношения констант равновесия процессов растворения гипса при температуре 363 К (90 °С) и температуре при стандартных условиях (298 К) можно представить так:
lg K K 0 |
4,1 103 1 298 |
1 363 0,13 . |
1 |
2,3 |
8,31 |
|
Отношение констант равновесия процессов растворения гипса при температурах 363 К и 298 К
K1 / K0 = 1,35.
Константа равновесия процесса растворения гипса при температуре 363,3 К вычисляется следующим образом:
115

K1 = 1,35 К° = 1,35 · 3,6 · 10–4 = 4,86 · 10–4.
Проведём аналогичные расчёты для процесса растворения ангидрита:
Нр0еакц = Нобр0 (Са2+) + Нобр0 SO24 – Нобр0 (СаSO4).
Подставив значения энтальпии образования ионов и соединений в стандартных условиях (см. табл. 6 приложения)
вданное уравнение, получим
Нр0еакц = (–542,7) + (–909,3) – (–1436,3) = –15,7 (кДж/моль) =
=–15,7 · 103 (Дж/моль);
lg K K 0 |
15,7 103 1 298 |
1 363 0,49 |
1 |
2,3 |
8,31 |
|
K1 / K° = 0,32;
K1 = 0,32 K0 = 0,32 · 1,68 · 10–5 = 5,37 · 10–6.
Таким образом, при 90 °С константа равновесия процесса растворения ангидрита меньше, чем константа равновесия гипса при этой температуре:
5,37 · 10–6 < 4,86 · 10–4,
поэтому в этих условиях ангидрит более устойчив, чем гипс. Ответ: при стандартных условиях гипс более устойчив, чем ангидрит, а при температуре 90 °С и нормальном атмо-
сферном давлении ангидрит становится более устойчивым.
ПРИМЕР 5.5. Определите значение общей и карбонатной жёсткости для среднего состава речной воды. Ответ дайте в молях на литр, немецких, французских и американских градусах жёсткости. К какой группе вод по величине жёсткости следует отнести эти воды? Принять плотность воды равной 1 кг/л.
116
Решение. Величину общей жёсткости воды можно определить, зная концентрацию ионов кальция и магния в воде, выраженную в мг/л. Поскольку по условию задачи плотность воды равна 1 кг/л, значения концентрации, выраженные
в млн–1 и мг/л, равны между собой и составляют [Ca2+] = = 20,0 мг/л и [Mg2+] = 3,4 мг/л.
Общая жёсткость воды вычисляется как
Ж= [Ca2+]/20,04 + [Mg2+]/12,16 м3 =
=20,0/20,04 + 3,4/12,16 = 1,3 (моль/м3).
Воды с таким значением общей жёсткости следует отнести к группе очень мягких вод.
Значение карбонатной жёсткости определяется количеством ионов кальция и магния, связанных с карбонат- и гид- рокарбонат-ионами. Поскольку в воде, отвечающей среднему составу речной воды, отсутствуют карбонат-ионы, значение карбонатной жёсткости может быть определено по концентрации гидрокарбонат-ионов (в мг/л):
Жкарб = HCO3 /(Mƒ) (моль/м3),
где ƒ – фактор эквивалентности, равный единице для гидро- карбонат-иона; М – молярная масса гидрокарбонат-иона
(М = 61 г/моль).
Карбонатная жёсткость, равная значению концентрации
гидрокарбонат-иона, Жкарб = 35/(61 · 1) = 0,57 (моль/м3). Значение жёсткости, выраженной в немецких, француз-
ских или американских градусах жёсткости, выраженную в моль/л, и соотношение между одним моль/л и соответствующим градусом жёсткости вычисляется следующим образом:
Ж (национальный градус жёсткости) = Ж(моль/м3) Кi,
где Кi – коэффициент соотношения между национальными градусами жёсткости и одним моль/м 3 воды.
117
Для воды, отвечающей среднему составу речной воды, получим:
Ж= 1,28 · 2,804 = 3,6 немецких градусов жёсткости;
Ж= 1,28 · 5,005 = 6,4 французских градусов жёсткости;
Ж= 1,28 · 50,050 = 64 американских градусов жёсткости. Ответ: вода, отвечающая среднему составу речной во-
ды, имеет общую жёсткость, равную 1,3 моль/м3, что соответствует 3,6 немецких градусов жёсткости; 6,4 французских градусов жёсткости; 64 американских градусов жёсткости.
Карбонатная жёсткость этой воды Жкарб = 0,57 моль/м3. Эту воду следует отнести к группе очень мягких вод.
Глава 6
ФАКТОРЫ ФОРМИРОВАНИЯ КИСЛОТНО-ОСНОВНЫХ СВОЙСТВ ПРИРОДНЫХ ВОД
Реакция природной водной среды в естественных уровнях изменяется в широком диапазоне значения рН. Этот фактор является очень важным, если учесть, что показатель реакции среды – один из важнейших классификационных признаков природных вод [38].
Большинство природных вод имеет величину рН в пределах от 5 до 8,5; для подземных вод этот показатель еще шире.
Чтобы понять, почему природные воды имеют столь широкий диапазон значения рН, рассмотрим идеальный случай: чистая природная вода находится в равновесии с углекислым газом (СО2), присутствующим в атмосферном воздухе. Парциальное давление атмосферного диоксида углерода составляет 10–7÷10–8,5 Па, константа диссоциации угольной кислоты по первой ступени равна 4,8·10–7.
118
При этих условиях рН воды составляет 5,63 (это рН «чистого» дождя). Именно эту величину рН принимают за отправную точку при оценке кислотности природных вод.
Однако в реальности содержание форм угольной кислоты в водах зависит не только от растворенного СО2, но и от концентрации различных карбонатов. Карбонаты широко присутствуют как в донных отложениях водных источников, так и на поверхности материков (мел, мрамор, доломит).
СаСО3 – труднорастворимая соль (ПР СаСО3 = 3,9·10–9), поэтому соли угольной кислоты в природных водоемах могут переходить в раствор и существовать в нем только при наличии растворённого углекислого газа:
СаСО3 + СО2 + Н2О Са2+ + 2 HCO3 |
(6.1) |
|
Образующаяся кислая соль – гидрокарбонат кальция – |
||
растворима в воде, и поэтому ионы HCO3 |
включаются в об- |
|
щую систему карбонатных равновесий, |
существующую |
|
в природных водах, и оказывают влияние на рН воды. Процесс диссоциации доломита можно представить уравнением:
СаМg(СО3)2 Са2+ + Мg2+ +2 CO32 |
(6.2) |
Появление карбонат-ионов приводит к повышению рН воды до 7,3÷8,4.
В природных водах одновременно могут протекать процессы, приводящие и к уменьшению, и к увеличению водородного показателя.
К числу процессов, приводящих к подкислению природных вод в естественных условиях, следует отнести:
–растворение в воде различных органических кислот
сконстантами диссоциации, близкими к константе диссоциации угольной кислоты. В первую очередь сюда относятся гуминовые кислоты, содержащиеся в перегное лесной подстилки, которые обогащают воды лесной зоны ионами водорода и определяют слабокислую реакцию воды;
119
– гидролиз природных солей, например FeSO4, Fe2(SO4)3, Al2(SO4)3, которые образуются при бактериальном окислении соответствующих сульфидов.
Рассмотрим в качестве примера гидролиз сульфата железа:
2FeSO4 + 2H2O H2SO4 + (FeOH)2SO4 |
(6.3) |
2Fe2+ + 2H2O 2FeOH+ + 2H+ |
(6.4) |
Образующиеся в результате реакции гидролиза ионы водорода обуславливают подкисление водной среды и растворение карбонатных пород.
СаСО3 + 2Н+ = Са2+ + СО2↑ + Н2О |
(6.5) |
естественное подкисление атмосферных осадков под воздействием оксидов серы и азота, а также летучих органических соединений в концентрациях, характерных для континентальных воздушных масс.
Расчет реакции среды для системы: Н2О – СО2(0,034 %) –
– SО2(5·10–7 %) дает значение рН = 4,6.
Как видно, присутствие оксида серы (IV) существенно влияет на степень кислотности осадков. Это связано с его большей по сравнению с СО2 растворимостью в воде и большей силой соответствующей кислоты:
Кд Н2СО3 = 4,8·10–7 КдН2SО4 = 2,7·10–2
Действие оксидов серы может быть еще эффективнее
врезультате их более глубокого окисления в капле до Н2SО4
вприсутствии катализаторов (Fe2+, Mn2+).
Наряду с факторами, приводящими к понижению рН природных вод, действуют факторы, вызывающие повышение основности вод.
120
