
Физикохимия металлургических систем и процессов. Щетинин А.А., Сушко Т.И
.pdfИз графика (рис.4.6) построенного по таблицам 4.3 и
4.4вытекает:
1)давление диссоциации Fe3O4 возрастает с
температурой интенсивнее, чем FeO, т.к.[ Н2 |
] > [ Н1 ]; |
|
|||||||||||
2) |
при |
|
570o С, |
кривая |
1 |
и 2 пересекаются, |
|||||||
РО (FeO) =РО (Fe O ) , |
следовательно |
|
окислы |
Fe3O4 |
и |
||||||||
2 |
2 |
3 |
4 |
|
|
|
|
|
|
|
|
|
|
FeO равнопрочны; |
|
|
|
|
|
|
|
|
|
||||
3) |
при Т>570o С, |
Р |
(FeO) |
<Р |
О |
(Fe O ) |
, и низший окисел |
||||||
|
|
|
|
|
О |
|
|
|
|
||||
|
|
|
|
|
2 |
|
|
2 |
3 |
4 |
|
|
|
прочнее, чем Fe3O4 , а при Т<570o - наоборот.
Для реакции (4) тепловой эффект и другие термодинамические параметры имеют среднее значение между аналогичными величинами у превращений (1) и (2). Поэтому кривая 4-4 располагается между линиями 1-1 и 2-2.
С помощью рис.4.6 можно установить области температур и давлений кислорода, в которых устойчивы различные конденсированные фазы в системе Fe-O. При этом
будем иметь в виду, что поле выше |
равновесной кривой |
||||||
РО |
(Т) принадлежит системам, в которых идёт окисление, а |
||||||
|
2 |
|
|
|
|
|
|
ниже – идёт диссоциация. |
|
|
|
|
|
|
|
|
В области I выше равновесной кривой 3 парциальное |
||||||
давление кислорода в газовой фазе |
РО |
(ф) |
|
больше давление |
|||
|
|
|
2 |
|
|
|
|
диссоциации высшего окисла |
РО |
(Fe |
O ) |
и значительно |
|||
|
|
2 |
|
2 |
|
3 |
|
больше, чем у остальных; реакция (3), а тем более (1) и (2) должны идти в сторону окисления. Если поместить в указанную область условий железо и окислы FeO и Fe3O4 ,
то все они в конечном счёте окисляются до Fe2O3. Таким образом, область I – поле устойчивости Fe2O3.
101
|
|
В области |
II РО |
(Fe |
O ) >РО |
(ф) >РО |
(Fe O |
) |
>РО |
(FeO) |
и |
||||||||||
|
|
|
|
|
|
|
2 |
2 |
|
3 |
|
2 |
|
|
2 |
3 |
4 |
|
2 |
|
|
реакция 3 |
идёт |
в |
сторону диссоциации Fe2O3 |
Fe3O4 , а |
|||||||||||||||||
реакция (2) в сторону окисления |
|
FeO |
Fe3O4 , т.е. |
в |
|||||||||||||||||
сторону образования того же окисла |
Fe3O4 . Железо в такой |
||||||||||||||||||||
атмосфере |
будет |
окислятся |
|
до |
FeO и |
дальше |
до Fe3O4 . |
||||||||||||||
Следовательно, в поле II устойчива магнитная окись Fe3O4 . |
|
||||||||||||||||||||
|
|
В области III |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
РО (Fe O ) >РО (Fe O ) |
>РО |
(ф) >РО |
(Fe |
O |
) >РО (FeO) . |
|
|
|
|
|
|||||||||||
2 |
2 |
3 |
2 |
3 |
4 |
2 |
|
|
2 |
3 |
4 |
|
|
2 |
|
|
|
|
|
|
|
|
|
Здесь реакции (3) и (2) идут в направлении |
|||||||||||||||||||
диссоциации Fe2O3 Fe3O4 |
FeO , а (1) и (4) – в сторону |
||||||||||||||||||||
окисления |
Fe FeO и |
Fe Fe3O4 . |
Другими словами, |
||||||||||||||||||
железо может окислиться как до закиси, так и до магнитной окиси. Но в области III последняя неустойчива и по реакции
(2) должна диссоциировать Fe3O4 FeO . Т.е. единственно устойчивой фазой в области III является закись FeO .
В области IV стабильно металлическое железо.
При Т>570o С на диаграмме отсутствуют участки, где
бы непосредственно соприкасались между собой поля устойчивости железа (IV) иFe3O4 (II). Следовательно, реакция
(4), в которой участвуют эти фазы, здесь невозможна. Аналогичными рассуждениями можно выяснить, что
при Т<570o С в полях IVа и IVб устойчиво железо и в полях
IIа и IIб – магнитная окись, т.е. здесь равновесно сосуществуют фазы Fe и Fe3O4 , и реакция (4) идёт.
Таким образом, реально возможным превращениям отвечают сплошные линии, образующие “вилку” и разграничивающие поля устойчивости фаз: Fe,FeO ,Fe3O4 .
102
В некоторых случаях диссоциация может идти с
отщеплением железа. |
Например |
при Т<570o С |
возможна |
||||
реакция 4FeO |
Fe |
O |
4(Т) |
+Fe |
(Т ) |
; H o =–48070 |
Дж. Т.к. |
(Т ) |
3 |
|
|
298 |
|
||
все участники превращения – |
твёрдые тела, реакция идёт |
||||||
медленно. |
|
|
|
|
|
|
|
Рассмотренные закономерности справедливы и в отношении окислов других металлов. Для ряда систем:
(Cu Cu2O CuO ), (Si SiO SiO2 ),
(Cr CrO Cr2O3 ) на диаграммеР T наблюдается
О2
аналогичная “вилка”
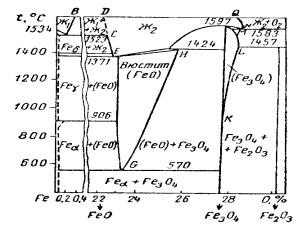
4.6. Диаграмма состояния железо-кислород
Диаграмма состояния системы Fe-О выражает условия существования различных окисных фаз в твердом и жидком состоянии в присутствии равновесного кислорода (рис.4.7). В зависимости от температуры и общего содержания кислорода изменяются природа окисных фаз и границы их существования.
Рис. 4.7. Диаграмма состояния фаз в системе Fe-O 103
Вертикальные линии близко соответствуют составам магнетита Fe3O4 и гематита Fe2O3 . При повышенных температурах возможно дополнительное растворение кислорода в Fe3O4 до предела, определяемого линиями K.L
и LM. На диаграмме отсутствует вертикальная линия, отмечающая существование чистой закиси железа FeO. Вместо нее имеется целая область для вюстита - твердого раствора кислорода в закиси железа (FeO).
Вакантные места решетки вюстита могут заполняться при дополнительном окислении ионами кислорода и трехвалентного железа. Вюстит оказывается раствором переменной концентрации. В отличие от закиси железа, его состав можно представить общей формулой FeOx , где х<1.
Предельные составы и значения х определяются граничными кривыми. Одна из них GH выражает предельное содержание кислорода в вюстите, которое заметным образом возрастает при повышении температуры. Линяя EG отмечает минимально возможное содержание кислорода или максимальное содержание железа. Положение этой границы практически не изменяется с температурой. Нижней границей существования
вюстита является температура 560-570o С, ниже которой
закисьжелеза не может существовать даже в растворе. Имеется также небольшая область твердого раствора
кислорода в железе различной модификации. Эти растворы переменной концентрации кислорода условно, не в масштабе, ограничиваются пунктирными линиями вблизи начала координат.
По имеющимся данным, небольшая величина растворимости кислорода изменяется при переходе железа из одной кристаллической формы в другую и несколько уменьшается с понижением температуры. Растворимость кислорода в δ-железе достигает величины около 0,005%
104
(мас.), а в γ-железе оказывается несколько ниже. Превращение γ-железа в ά-железо сопровождается увеличением растворимости кислорода в твердом металле. При 900o С
предельное содержание кислорода в ά-железе приближается к 0.03% и уменьшается с понижением температуры. Об этом можно судить по уравнению растворимости:
ℓg[%O ] = - |
3500 |
+1,46. |
(4.25) |
|
|||
2 |
Т |
|
|
|
|
|
Растворимость кислорода в твердом железе находится в зависимости от наличия других примесей. Она становится крайне малой для железа высокой чистоты, например, после неоднократной зоннойочистки.
Температура плавления железа несколько понижается под влиянием растворенного кислорода, содержание которого достигает 0,16%. Повышение температуры существенно увеличивает предельное содержание кислорода в жидком железе в соответствии с положением кривой АВ. Последняя ограничивает область однородного раствора кислорода в жидком железе Ж1 переменной концентрации. Соседняя область расслаивания выражает условия равновесного существования жидкого железа, предельно насыщенного кислородом Ж1, и шлакового расплава Ж2 с минимальным содержанием кислорода, по составу близкого к FeO.
Температура плавления вюстита и превращения его в шлаковый расплав повышается с 1370 до 1420o С по
мере увеличения содержания в нём кислорода. Более высокой температуре плавления магнитной окиси железа
1597o С соответствует отчетливый максимум на кривой ликвидуса. Как вюстит, так и Fe3O4 при плавлении образуют однородный расплав окислов Ж2 с переменным содержанием общего кислорода. Область существования такого шлакового расплава, с одной стороны,
105
ограничивается составами жидкого вюстита CD с предельно низким содержанием кислорода и с другой стороны, очерчивается линией NQ максимально возможного содержания кислорода в жидком шлаке в присутствии газообразного кислорода под давлением 1 ат. Этот предел достигается при нагревании Fe2O3 , eё диссоциации с образованием растворов, плавлении твердой фазы при 1580o C с выделением шлакового расплава, более бедного
кислородом, чем Fe2O3 (линия NQ).
Наряду с отмеченными однородными растворами переменной концентрации кислорода на диаграмме выявляются области существования двух конденсированных фаз, находящихся в равновесии с газообразным кислородом:
1) твердые растворы кислорода в железе различной модификации и вюстит с предельно низким содержанием кислорода или с максимальным содержанием железа
Fe (FeO)Fe ; |
Fe |
(FeO)Fe. |
2) твердый раствор кислорода в ά-железе и |
||
магнетит (ниже 560—570°С) |
|
|
Fe Fe3O4. |
|
|
3)вюстит с предельно высоким |
содержанием |
|
кислорода и магнетит |
|
|
(FeO)o Fe3O4.
4) магнетит и гематит
Fe3O4 Fe2O3.
При повышенных температурах имеются также области равновесного сосуществования твердой и жидкой фаз.
Таким образом, из диаграммы состояния Fe — О выявляется действительная природа окисных фаз железа и формы их существования при определенных условиях.
106
4.7. Закономерности превращения сульфидов металлов
Сернистые соединения металлов являются источником серы, которую с наибольшей тщательностью удаляют при выплавке металлов и сплавов. Возможности удаления серы из металлов в значительной мере связано с термодинамической прочностью сульфидов. Для реакции диссоциации и образования сульфидов справедливы те же общие закономерности, которые характерны для карбонатов и окислов. Полное завершение эндотермической реакции разложения сульфида
2МеS=2Me+S2 |
(4.26) |
характеризуется равновесным давлением двухатомной серы в газовой фазе. Оно принимается за давление диссоциации сульфида и может служить мерой его прочности. Состояние серы в газовой фазе в виде молекул S2 подтверждено при
высоких температурах (700-12000 С). Вблизи точки кипения серы (444,50 С) следует считаться с наличием более крупных образований (S4 , S6 , S8 ), а при высоких температурах – с
переходом серы в атомарное состояние.
При наличии чистых конденсированных фаз система (4.26) моновариантна, и давление диссоциации зависит только от температуры Ps2 =f(T). При образовании растворов
система становится двухвариантной и |
Ps2 =f(T,N), где N – |
||||||||
мольная |
доля |
компонента |
в |
растворе. |
Для |
||||
термодинамических |
расчётов |
с |
целью |
определения |
|||||
зависимости Ps |
2 |
(Т) и Go |
проще и доступнее использовать |
||||||
|
|
|
Т |
|
|
|
|
|
|
двучленные |
выражения |
типа |
(2.6) |
(Приложение). |
|||||
Термодинамические свойства сульфидов оценивают как по величине (Ps2)Р так и GТo :
107

GТo = - RT nPs2
По аналогии с кислородным потенциалом в системах с реагирующей серой удобно использовать потенциал серы S ,
численно равный изменению изобарного потенциала образования данного сульфида в стандартных условиях
|
S |
= Go |
(4.27) |
|
|
|
Т |
|
|
Для сравнительной оценки свойств сульфидов |
||||
сопоставляют температурные функции Go , |
отнесённые к |
|||
молю серы S2 (рис.4.8) |
|
|
Т |
|
|
|
|
|
|
G, кдж |
|
|
|
|
0 |
|
|
|
|
200 |
|
|
|
|
400 |
|
|
|
|
600 |
|
|
|
|
800 |
|
|
|
|
1000 |
|
|
|
t C |
400 |
800 |
1200 1600 |
||
Рис. 4.8. Температурные функции Go образования
сульфидов:
■ и □ -точка плавления металла и сульфида; - точка кипения (возгонки) металла
Чем прочнее сульфид элемента, тем ниже располагается практически прямые зависимости GТo (Т) и
тем ниже для них серный потенциал S .
108
Положение линии GТo (Т) изменяется под влиянием фазовых переходов и образования растворов. При фазовом превращении металла, и особенно в точке кипения, наблюдается излом кривой вверх. В этом же направлении в сторону больших положительных значений GТo смещается вся линия под влиянием растворения и понижения концентрации реагирующего металла. Фазовый переход сульфида и понижение его концентрации в растворе оказывают упрочняющее действие.
Любая заданная |
точка на диаграммном поле вне |
||||
кривой |
свидетельствует |
отличие |
серного |
потенциала |
|
газовой |
фазы |
от |
потенциала, |
данного |
сульфида |
S(ГФ) |
S(МеS) . |
При этом возможно |
поглощение серы из |
||
газовой фазы ( S(ГФ) S(МеS) ) или её удаление при изменении
знака данного неравенства.
Потенциал серы в газовой фазе можно оценить по известным реакциям, в которых участвует сера. Для
восстановительной атмосферы, содержащей водород: |
|
||||||||||||||
|
H2 S2 |
2H2S , |
(4.28) |
||||||||||||
|
кр |
P2H |
2 |
S |
|
, |
|
|
|
(4.29) |
|||||
|
|
|
|
|
|
|
|
|
|
|
|||||
|
P2 |
P |
|
|
|
|
|
|
|||||||
|
|
|
H2 |
|
S2 |
|
|
|
|
||||||
S(H S) |
=RT n S |
=RT n ( |
PH2S |
)2 -RT n . |
(4.30) |
||||||||||
|
|
||||||||||||||
2 |
|
2 |
|
|
|
|
|
|
|
PH2 |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Для окислительной атмосферы |
|
||||||||||||||
|
|
2O2 S2 |
|
|
2SO2 , |
(4.31) |
|||||||||
|
|
Kр |
|
P |
2SO |
|
. |
(4.32) |
|||||||
|
|
|
|
|
|
|
|
2 |
|||||||
|
|
P2 |
|
|
|
|
|||||||||
|
|
|
|
|
|
|
P |
|
|
|
|
||||
|
|
|
|
|
O |
|
|
|
|
S |
2 |
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
||
109

S(SO2 ) =RT n PS2 |
=RT n ( |
PSO2 |
)2 RT n к . |
(4.33) |
|
||||
|
|
PO2 |
|
|
В системе Fe-S при металлургических температурах известны высший сульфид Fe2S (пирит) и низший сульфид FeS (пирротин).
Их образование можно выразить уравнениями:
2FeS(T ) S2(Г) 2FeS2(T ) , |
(4.34) |
||
2Fe(T) S2(Г) 2FeS(T ) . |
(4.35) |
||
Количественные характеристики реакции образования |
|||
пирита можно представить выражениями |
|
||
Go = - 362340+376,15 Т Дж , |
(4.36) |
||
Т |
|
||
g PS2 =- |
18950 |
19,67 . |
(4.37) |
|
|||
|
Т |
|
|
Видно, что высший сульфид железа |
является при |
||
Т>1000К непрочным соединением и может легко диссоциировать.
Для FeS при температурах 500-1200К имеем
Go = -300700+105,116 Т, |
|
Т |
|
1gP = - 15698 5,49. |
|
S2 |
Т |
|
|
Следовательно, низший сульфид обладает высокой прочностью.
В более строгих термодинамических расчётах следует учитывать различное состояние твёрдых фаз ( Fe , Fe , и др.)
и соответствующие им термодинамические характеристики. На рис.4.9 приведена диаграмма состояния Fe-S.
110
