
Учебное пособие 800320
.pdf
горения к стационарному режиму и наоборот. Процесс в данной области не связан, таким образом, с тепловым воспламенением, при котором самоускорение обусловлено ростом температуры.
В пламени горящего водорода обнаружены в значительных количествах химически активные частицы – атомы водорода Н и кислорода О ; свободные радикалы ОН , НО 2 .
На процесс горения влияют размеры реакционного сосуда и природа материала стенок сосуда, различные примеси при их определённых концентрациях.
Указанные особенности объясняются действием цепного механизма по которому протекает большое количество газофазных процессов. Основные положения цепного механизма газовых реакций, сформулированные академиком Н.Н. Семёновым, сводятся к следующему.
Цепные реакции протекают через ряд промежуточных превращений. Реакции с их участием требуют небольшой энергии активации и обеспечивают выигрыш энергии.
Активные частицы не только вступают в реакцию (гибнут), но и непрерывно регенерируются. При этом возможны три типа элементарных взаимодействий (рис 2.9) – начало цепи, реакция продолжения цепи, реакция разветвления цепи.
продукт
а.ч.
а.ч. а.ч. а.ч.
а.ч.
 а.ч. а.ч.
а.ч. а.ч.  а.ч.
а.ч. 
а.ч.
продукт
Рис. 2.9. Схема цепной реакции
51
В первом случае в элементарном акте из обычных молекул образуются две активные частицы, например:
Н2 О2 h 2OH .
Во втором случае взамен одной прореагировавшей частицы возникает лишь одна новая. Например:
Н2 ОН Н2О Н .
Такие реакции называют реакциями продолжения цепей, а совокупность таких превращений - простой цепью. В третьем случае исчезновение одной активной частицы ведёт к образованию двух – трёх новых. Одна из них продолжает цепь, а остальные дают начало новым цепям. Например, О2 + Н = ОН + О . Это реакция разветвления. Цепь, состоящая из нескольких простых цепей, называется разветвлённой.
Наряду с разветвлением цепей существуют противодействующие процессы, иначе все реакции заканчивались бы взрывом. Реакционные цепи обрываются в результате гибели активных частиц за счёт их рекомбинации (воссоединения) в нормальные молекулы. Эти реакции сопровождаются выделением большой энергии, которая первоначально сосредотачивается в молекулах продуктов реакций
Н + Н = Н 2
О+ О = О 2
Врезультате образуются неустойчивые,
возбужденные молекулы H2* и O2*, которые приобретают устойчивость и превращаются в обычные молекулы только в том случае, если до распада успевают потерять избыточную энергию либо при столкновении с обычными молекулами в объеме сосуда (возникает гомогенный обрыв цепи), либо при столкновении со стенками сосуда или частицами конденсированной фазы (гетерогенный обрыв). Развитие процесса возможно при условии, что скорость образования частиц выше скорости их гибели. Иначе реакция имеет
52
стационарный характер и либо не идет вовсе, либо протекает медленно.
Существование пределов давления реакций горения объясняется изменением соотношения скоростей возникновения и гибели частиц при различных условиях.
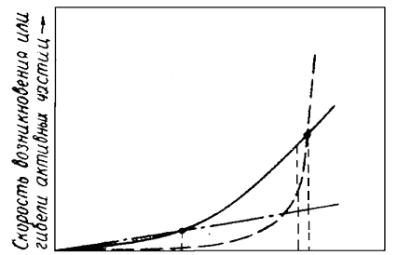
Скорость наиболее вероятной бимолекулярной реакции развития цепи путем столкновения активной молекулы с валентнонасыщенной молекулой можно записать:
2 k2Pобщ2 ,
где 2 - скорость разветвления цепей, k2 - константа скорости второго порядка (рис. 2.10).
|
v3 |
|
|
v2 |
|
|
n |
|
т |
v1 |
|
|
|
|
Р/ P1 |
Р2 Р// |
Р |
Общеедавлениесмеси |
|
|
Рис. 2.10. Соотношение кривых v1(P), v2(P) и v3(P) для реакции горения водорода
53
Двойные |
соударения активных частиц (типа |
|
H H H ) в объеме реактора не приводят к их гибели, |
||
т.к. образующиеся возбужденные молекулы Н2 |
нестабильны |
|
и распадаются |
еще до встречи с другими |
частицами |
(H Н H ).
Если же происходит тройное соударение двух активных частиц с обычными молекулами М, то последние, воспринимая избыток энергии, стабилизируют молекулы продуктов реакции:
H H M H2 M H2 M .
Следовательно, гибель активных частиц в объеме (гомогенный обрыв) протекает по реакции третьего порядка, скорость которой:
3 k3P 3
Это – кубическая парабола (рис. 2.10).
Гетерогенный обрыв цепей происходит за счет рекомбинации радикалов на твердых поверхностях (стенках) сосуда, которые отводят избыток выделяющейся энергии и стабилизируют возбужденные молекулы. Количество активных центров, захватываемых в единицу времени единицей поверхности, пропорционально частоте их ударов стенку сосуда, а следовательно, и общему давлению:
1 k1P .
Соотношение между скоростями показано на рис. 2.10.
Видно, |
что кривая |
2 |
пересекает прямую 1 при более |
||
низком давлении P |
(т. m), чем кривую 3 (т. n) - |
P . |
|||
Между P и |
P располагается |
интервал |
давлений |
||
P1 P2 , |
в пределах которого 2 1 3 , |
и здесь создаются |
|||
условия |
для размножения частиц и воспламенения. |
|
|||
С |
уменьшением |
давления ниже |
P1 число тройных |
||
соударений сокращается, и скорость гибели частиц в объеме становится несущественной. Решающая роль здесь
54
принадлежит гетерогенному обрыву цепей 2 1 , и режим становится стационарным, реакция протекает с ничтожной скоростью.
При повышении давления до P2 P , 2 1 3 .
Здесь 3 уже больше 1. Процесс также переходит в
стационарный режим, но реакция развивается с ощутимой скоростью, нарастающей с повышением давления.
Таким образом, нижний предел давления обусловлен гетерогенным обрывом цепей. Поэтому причины, затрудняющие достижение активными частицами стенок сосуда, способствуют развитию реакции и приводят к расширению полуострова воспламенения за счет снижения P1 . К таким причинам относятся: увеличение диаметра реакционного сосуда, введение инертного газа, который затрудняет диффузию активных частиц к стенкам сосуда и т.п. Верхний предел определяется преимущественно гомогенным обрывом цепей, поэтому размеры и материал сосуда не влияют на величину P2 . Введение инертного газа затрудняет воспламенение, т.к. его молекулы увеличивают вероятность тройных соударений.
Третий предел давления имеет тепловую природу. При достаточно больших давлениях и следовательно, большой массе реагентов в единице объема вначале даже медленной реакции выделяется столько тепла, что в экспериментах уже невозможно обеспечить изотермические условия. Тепловое равновесие нарушается, и наступает воспламенение.
Горение водорода и окиси углерода протекает по цепному механизму. В случае горения H2 цепи начинаются с возникновения радикалов гидроксида:
H2 O2 2OH .
55

Далее происходят реакции:
OH H2 H2O H.
H O2 OH O ,
O H2 OH H.
Особенность реакции горения CO состоит в том, что ее скорость существенно зависит от содержания в системе водорода и водяных паров. Тщательно осушенная смесь CO O2 не воспламеняется. Поэтому, по всей видимости, первичной активной частицей является радикал гидроксила:
OH CO CO2 H,
H O2 OH O .
CO O CO2 , и цепь выглядит следующим образом:
CO2 |
|
|
CO2 |
|
O |
||||
|
|
|
|
|
H |
|
|||
|
|
|
OH |
|
CO |
H O2 |
|||
OH CO |
|
|
|
|
|||||
|
|
|
|
OH |
CO |
CO2 |
|
||
H |
|
O2 |
|
|
|
||||
|
O H2 |
|
|
H |
|
||||
|
|
|
|
|
OH |
|
|||
H O2 O
O
Контрольные вопросы
1.Приведите примеры газофазных металлургических
систем.
2.Проведите качественный термодинамический анализ горения окиси углерода.
56
3.Как проводится качественный термодинамический анализ газовых систем? На какие вопросы он отвечает?
4.Получите с помощью Приложения уравнения температурной зависимости константы равновесия реакции горения СО.
5.Как по графику gKp(T) определить направление
процесса в газовой системе в заданных условиях?
6.Как проводится расчёт равновесного состояния газовой фазы?
7.В чём заключаются сходство, а в чём различия
реакции горения СО и Н2 ?
8.Что такое кислородный потенциал газовой среды?
9.С помощью выражения для кислородного потенциала проведите анализ окислительновосстановительных свойств газовых систем СО О2 и Н2 О2 .
10.Проведите анализ реакции водяного газа.
11.Как проводится расчёт равновесного состав газовой фазы в реакции водяного газа?
12.Как проводится термодинамический анализ сложных газовых систем?
13.Что такое температура воспламенения газовой атмосферы? Как она определяется?
14.От каких факторов зависит температура воспламенения?
15.Кинетические закономерности реакции горения
воздуха.
16.Сформулируйте основные положения цепного механизма газофазных реакций.
17.Проверьте анализ соответствия положений цепного механизма с экспериментальными данными кинетики горения.
57
3. ПРОЦЕССЫ ВЗАИМОДЕЙСТВИЯ ТВЕРДОГО УГЛЕРОДА С ГАЗОВОЙ ФАЗОЙ
Как известно, углерод может существовать в нескольких аллотропных формах – алмаз, графит и фуллерит. Для твердого углерода характерно также состояние с неупорядоченной структурой, называемое часто аморфным углеродом: кокс, сажа, древесный уголь, активированный уголь и т.д. Однако прямые рентгеноструктурные исследования показывают, что аморфный углерод в ближнем порядке обнаруживает структуру графита, и поэтому может рассматриваться как высокодисперсный графит.
При обычных температурах различные формы углерода химически инертны, однако при нагревании углерод взаимодействует со многими элементами и соединениями, обладая сильными восстановительными свойствами. В металлургических процессах углерод играет исключительно важную роль, выполняя функции источника тепла, восстановителя различных элементов из их соединений, активного компонента многих сплавов. Наибольшее значение для этих процессов имеет модификация аморфного углерода, поэтому в металлургических справочниках чаще всего приводятся термодинамические характеристики именно этой модификации.
Содержание углерода в металлургических системах существенным образом влияет на состояние и состав фаз. Определяющую роль углерода особенно проявляется в формировании состава и свойств газовых атмосфер, чему и посвящен настоящий раздел.
3.1. Взаимодействие углерода с углекислым газом
При сжигании углерода в кислороде (воздухе) может происходить реакция газификации углерода
58
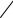
C(T ) CO2(Г) 2CO(Г) , |
(3.1) |
которая развивается при наличии в системах избытка углерода. Она протекает с поглощением тепла, стандартное изменение энтальпии H2980 172,13кДж моль . При этом объем системы увеличивается, т.к. увеличивается число молей газообразных компонентов, а удельный объем твердой фазы мал по сравнению с удельным объемом газов. В соответствии с принципом Ле-Шателье равновесие данного эндотермического процесса смещается вправо при повышении температуры и понижении давления в системе. Число степеней свободы i k 2 2 2 2 2, и это – температура и давление.
Константа равновесия в общем случае записывается
|
|
К |
|
|
|
|
|
Р2 |
|
|
|
|
|
||
|
|
р |
|
|
|
|
|
СО |
|
, |
|
|
(3.2) |
||
|
|
|
Р |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
а |
|
|
|||||
|
|
|
|
|
|
|
|
СО |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
а в случае использования чистого углерода (ac 1) |
|
||||||||||||||
|
|
К |
|
|
|
|
Р2 |
|
|
|
|
|
|||
|
|
р |
|
|
|
|
СО |
. |
|
|
|
|
(3.3) |
||
|
|
|
Р |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
СО |
|
|
|
|
|
|||
Для данной реакции |
|
|
2 |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
||||||
|
G0 |
172130 177,45T , |
|
||||||||||||
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1gКр |
|
G0 |
|
|
8916 |
9,113 . |
(3.4) |
|||||||
|
|
|
Т |
|
|
|
|
||||||||
|
RT |
|
|
Т |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||
Значение lgKp |
приведены в табл. 3.1 |
|
|||||||||||||
Как и следовало ожидать из принципа Ле-Шателье, с |
|||||||||||||||
повышением |
температуры |
|
|
K p |
растет. Вблизи |
1000 К |
|||||||||
( 7000C) K p |
1, что |
|
указывает на обратимость реакции. |
||||||||||||
При T 1500К , реакция |
протекает необратимо в |
сторону |
|||||||||||||
образования CO, а при T 500К - в сторону распада CO. Все
59

три возможных случая играют важную роль в металлургических системах.
Таблица 3.1
Значения lgKp |
реакции (3.1)при различных температурах |
||||||
T, K |
500 |
|
1000 |
1500 |
2000 |
2500 |
3000 |
|
|
|
|
|
|
|
|
lgKp |
-8,7 |
|
0,2 |
3,19 |
4,65 |
5,56 |
6,16 |
|
|
|
|
|
|
|
|
Для нахождения равновесного состава газа используем закон Дальтона и выразим общее давление P через PCO и
PCO2 : |
|
|
|
|
|
|
|
|
|
|
|
|
|
P PCO |
|
PCO , |
|
|
|
(3.5) |
|||||
|
|
|
|
|
|
|
2 |
|
|
|
|
|
Из уравнений (3.3) и (3.5) получаем квадратное |
||||||||||||
уравнение |
|
|
|
|
|
|
|
|
|
|
|
|
P |
2 K |
p |
P |
K |
p |
P 0, |
(3.6) |
|||||
CO |
|
|
|
|
CO2 |
|
|
|
|
|
||
решение которого позволяет найти PCO |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
||
PCO |
|
Kp |
|
|
|
Kp |
2 |
Kp P , |
(3.7) |
|||
|
|
|
|
|
|
|
||||||
|
2 |
|
|
4 |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|||
а PCO2 находим из (3.5).
Обычно реакция газификации притекает в присутствии азота, входящего в состав воздуха. При этом система становится трехвариантной, и кроме P и T необходимо знать параметр, отражающий состав воздуха
P
k N2 , (3.8)
PO2
60
