
Учебное пособие 800320
.pdf
небольшим перемещением ионов. |
Таблица |
5.2 |
|||||||||
|
|
|
|
|
|||||||
|
Характеристика кристаллических структур в |
|
|
||||||||
|
|
системе железо-кислород |
|
|
|
|
|
|
|
||
Наименование |
Кристалл- |
Параметр |
|
Отношение |
|
|
|||||
фазы |
лическая |
решетки |
|
параметров |
|
|
|||||
|
|
система |
о |
|
аj : аα ∙Fe |
|
|
||||
|
|
|
аi , А |
|
|
|
|
|
|
|
|
1. |
α- Fе |
Кубическая |
2,91 |
|
1 |
|
|
|
|
|
|
2. |
Закисная |
То же |
~4,30 |
|
1,48≈ |
|
|
|
|
|
|
2 |
|
|
|
||||||||
3. |
Fe3O4 |
То же |
8,41 |
|
2,89≈ |
|
|
=2 |
|
|
|
|
8 |
2 |
|
||||||||
4. |
γ-Fe2O3 |
То же |
8,32 |
|
2,86≈ |
|
|
=2 |
|
|
|
|
|
8 |
2 |
|
|||||||
5. |
α-Fe2O3 |
Ромбоэдри- |
5,42 |
|
|
|
|
|
|
|
|
|
|
ческая |
|
|
|
|
|
|
|
|
|
Поясним сказанное на примере превращения α-Fе в вюстит (рис. 5.9).
.
Рис. 5.9. Схема перестройки кристаличесской решеткиFe в решетку закиси железа:
а) элементарная ячейка решеткe Fe; б) диагональная плоскость этой ячейки;
в) грань элементарной ячейки решетки FeO. (стрелками показаны мета внедрения ионов кислорода в решетк железа).
141

При окислении железа ионы кислорода внедряются в середины сторон прямоугольника, образованного, диагональной плоскостью 1-5-7-3 в элементарной ячейке α- Fe. Для размещения этих ионов первоначальная решетка расширяется. Из указанной плоскости получается квадратная грань элементарной ячейки кубической решетки вюстита с
о
параметром 4,3 А который примерно в  2 =1,42 раза больше, чем у железа, и почти соответствует диагонали квадрата в элементарной ячейке α-Fe.
2 =1,42 раза больше, чем у железа, и почти соответствует диагонали квадрата в элементарной ячейке α-Fe.
Таким образом, передвижение ионов железа в плоскости, параллельной грани 1-2-3-4, сравнительно небольшое: расстояние между ионами Fe2+ увеличивается от
о
4,11 до 4,3А, т. е.всего на 4,6%. Это свидетельствует о наличии размеренного соответствия, так как последнее соблюдается при величине перемещения частиц до 9%. В направлении, перпендикулярном указанной грани, такого соответствия нет. Внедрение анионов О2- требует увеличения расстояния между катионами Fе2+ почти в 1,5 раза.
Между решетками закисной фазы и магнетита размерное соответствие значительно выше. Оно заключается в том, что параметр второй решетки примерно в два раза больше, чем первой, и в одной элементарной ячейке Fe3О4 может без заметной деформации разместиться 23 = 8 ячеек вюстита. Расположение содержащихся в них 32 анионов О2- почти одинаково в обеих фазах. Превращение FеО → Fе3О4 сводится в основном к удалению из решетки вюстита части ионов железа совместно с электронами с одновременным переходом определенного числа катионов Fe2+ в Fe3+.
Структурное и размерное соответствие между Fe3O4 и γ-Fе2О3 еще более высокое — эти фазы имеют практически одинаковые решетки (см. табл. 5.2). Несколько меньший параметр у γ-Fе2О3 связан с сокращением решетки за счет дырок, образующихся при переходе Fe3O4 в γ-Fе2О3.
142

Кристаллы α-Fe2O3 существенно отличаются от остальных как по структуре, так и по соотношению параметров.
Окалина состоит из трех основных слоев. Их состав и порядок расположения такие же, как у гомогенных областей на диаграммесостояниясистемыFе—О (рис. 5.10).
Рис. 5.10. Структура железной окалины и её соответствие с диаграммой железо-кислород: I – закисная фаза; II – магнетит; III – гематит
Строение окалины зависит от температуры и состава газовой фазы. Если последняя содержит кислород, то при Т>570 °С окалина состоит из трех слоев. Внутренний слой (I) по химическому составу и кристаллическому строению соответствует закисной фазе, средний (II) - магнетиту, а наружный (III) — гематиту. Между ними имеются узкие переходные зоны, отвечающие гетерогенным областям диаграммы. При Т < 570°С, когда вюстит неустойчив, отсутствует слой I и окалина состоит из магнетита и гематита.
Если окислителями являются только СО2 или Н2О, и газовая фаза не содержит кислорода, то Fe2O3 не образуется, и выпадает слой III. При Т > 570 °С в окалине имеется два
143
слоя, вюститный и Fe3O4, а при Т < 570° - только один магнетитовый.
На основании имеющихся обобщений окисление железа происходит следующим образом. В атмосфере, содержащей кислород, например в воздухе, на поверхности металла даже при комнатной температуре образуется очень тонкая защитная оксидная пленка, состоящая из γ-Fe2O3. При нагревании она утолщается и за счет повышения подвижности атомов (ионов) в своей наружной части переходит в устойчивую фазу α-Fe2O3. Дальнейшее повышение температуры приводит к заметной диффузии ионов Fe2+ из металла в соприкасающийся с ним слой γ-Fe2O3 , к постепенному заполнению в решетке этой фазы катионами Fe2+ дырок и её перестройке в Fe3O4. При Т > 570 °С между Fe3O4 и Fe появляется слой вюстита. На границе раздела α-Fe2O3 / Fe3O4 сохраняется небольшая прослойка γ- Fe2O3 .
Таким образом формируется первичная оксидная пленка, в которой даже при малой толщине (менее 0,1 мм) обнаруживается слоистое строение. Последующее окисление сводится к непрерывному росту всех слоев.
Образование первичной окалины и дальнейшее увеличение ее толщины происходит за счет так называемой реакционной диффузии. Она складывается из собственно диффузии атомов (ионов) в пределах гомогенных областей и перехода этих частиц через границы раздела соседних фаз, сопровождающегося кристаллохимическими превращениями. При таких переходах частицы железа или кислорода внедряются в смежные кристаллические решетки. В результате на границах раздела фаз образуются пересыщенные растворы, которые затем распадаются и дают новые кристаллические вещества.
При миграции катионов железа (в сопровождении электронов) из металла на наружную поверхность окалины происходят следующие превращения:
144
а) на границе FeO | Fe3O4 катионы внедряются в решетку магнетита и перестраивают ее в закисную фазу Fe +Fe3O4 → 4FeO, что утолщает слой | (см. рис. 5.10);
б) на границе Fe3O4 | γ-Fe2O3 они заполняют дырки в решетке γ-Fe2O3, которая превращается в магнетит Fe + 4Fe2O3 → 3Fe304;
в) на границе α- Fe2O3 | газ ионы железа взаимодействуют с адсорбированным кислородом и образуют Fe2О3, слой которого растет наружу.
Диффузия кислорода в противоположном направлении сопровождается подобными превращениями. В частности, на границе раздела FeO | Fe кислород, внедряясь в решетку железа, дает пересыщенный раствор, который затем переходит в вюстит (рис. 5.10). Слой последнего расширяется в глубь металла.
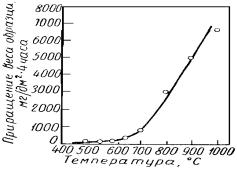
Установлено, что скорость окисления железа увеличивается с температурой неравномерно. До ~600 °С для обычных марок стали наблюдается сравнительно медленное течение реакции, после чего происходит быстрое нарастание скорости (рис.5.11).
Рис. 5.11. Зависимость скорости окисления образца стали от температуры
Для легированных сталей, содержащих такие примеси, как Сг, Ni и др., излом на кинетических кривых
145
обнаруживается при более высоких температурах (750 -900 °С).
Рентгеноструктурный анализ показал, что скачок скорости окисления совпадает с появлением в окалине вюститного слоя. Такая роль закисной фазы объясняется, вопервых, тем, что вследствие дырчатой кристаллической структуры она представляет собой благоприятную среду для диффузии железа. Во-вторых, между кристаллическим строением вюстита и смежных с ним фаз (α-Fe и Fe3O4) имеется структурное и размерное соответствие. Поэтому решетки на границах раздела Fe | FeO и FeO | Fe3O4 перестраиваются сравнительно легко, без значительного перемещения ионов.
При низких температурах, когда закись неустойчива, железо контактирует непосредственно со слоем магнетита. Здесь параметры решеток смежных фаз заметно отличаются друг от друга, и их взаимная перестройка требует преодоления более высокого энергетического барьера (энергии активации), чем в предыдущем случае.
В силу указанных причин при отсутствии в окалине вюститного слоя реакционная диффузия, или окисление, протекает значительно медленнее. Таким образом, одним из условий получения жаростойких сталей является предотвращение образования в окалине закисного слоя. Это достигается введением некоторых легирующих добавок (Ni, Cr и др.) в таких количествах, при которых затрудняется возникновение вюстита.
Контрольные вопросы
1.Перечислите основные закономерности превращений в гетерогенных системах.
2.Рассмотрите процесс образования зародышей новой фазы на примере диссоциации карбоната кальция.
146
3.От каких факторов зависит работа образования зародышей?
4.В чем заключается принцип ориентационного и размерного соответствия?
5.Что такое критический размер зародыша и от каких факторов он зависит?
6.Сформулируйте основные положения линейного роста кристаллов.
7.Перечислите элементарные стадии распада карбоната кальция.
8.Проведите анализ кинетической кривой распада карбоната кальция.
9.Рассмотрите основные факторы, влияющие на скорость разложения карбоната кальция в промышленных условиях.
10.Проведите анализ термограммы диссоциации карбоната и обратного процесса карбонизации окисла.
11.Проведите анализ скорости процесса диссоциации карбонатов в диффузионном и кинетическом режиме.
12.Сформулируйте термодинамические и кинетические условия образования окисла пленок на металлах.
13.Выведите кинетические уравнения окисной пленки
ипроведите его анализ.
14.На кинетической кривой роста окисной пленки укажите и охарактеризуйте кинетическую; диффузионную и переходную области.
15.Охарактеризуйте кристаллическое строение различных окислов железа.
16.Рассмотрите механизм образования железной
окалины.
147
6. ВОССТАНОВЛЕНИЕ ОКИСЛОВ
Многие процессы выплавки сплавов завершаются операцией освобождения их от избытка кислорода (раскислением), удаление кислорода из окисла, растворенного в металле, или восстановление окислов, находящихся в шлаке, имеют большое практическое значение, так как они во многих случаях предопределяют качество и свойства металла или сплава в отливках. Особое значение имеет восстановительная плавка, в процессе которой получают металлы и сплавы различного назначения.
Для того чтобы произошло разложение окисла и выделение из него металла, необходимо, чтобы кислородный потенциал системы πО(г.ф.) был меньше кислородного потенциала восстанавливаемого окисла
πО(г.ф.) < πО(МеО) ,
или (что аналогично) чтобы упругость диссоциации окисла была больше парциального давления кислорода в газовой фазе:
РО2 (МеО) РО2 (г.ф.)
Вакуумирование пространства над расплавом не может обеспечить этого условия. С этой точки зрения более эффективным является химическое связывание кислорода с помощью элементов, обладающих большей степенью химического сродства к кислороду, чем металл восстанавливаемого окисла. Оценить эффективность элементов – восстановителей можно по величине ∆G0 образования окислов и относительному положению кривых температурныхфункций ∆G = f(Т) на рис. 4.5.
На практике в качестве восстановителей используются твердый углерод, СО, Н2, многокомпонентные газовые смеси.
148

6.1. Восстановление окислов газами
Запишем окислительно-восстановительную реакцию с участием окисла металла в общем виде
МеО + В = Ме + ВО, |
(6.1) |
где Ме – металл, В – восстановитель, ВО – окисел восстановителя. В качестве окиси МеО в реакции может участвовать окисел любой валентности, но для упрощения рассмотрим только окислы двухвалентных элементов. Процесс (6.1) может быть экзоили эндотермичным.
Уравнение (6.1) можно получить путем комбинации уравнений реакций образования соответствующихокислов.
2В О2 |
2ВО |
|
|
|
(1) |
2Ме О2 2МеО |
||
|
|
2(МеО В Ме ВО) |
(2) |
|
|
||||||||||||||
На основе закона Гесса имеем |
|
|
|
||||||||||||||||
|
|
Н |
1 |
( Н |
1 Н2 ) |
|
|
(6.2) |
|||||||||||
|
|
|
|
||||||||||||||||
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
GО |
|
1 |
( GO GO ) |
|
|
(6.3) |
|||||||||||
|
|
|
|||||||||||||||||
|
1 |
|
2 |
|
|
1 |
|
1 |
2 |
|
|
|
|
||||||
gK |
( gK1 gK2 ) |
( gРО (МеО) |
gРО (ВО) ) |
(6.4) |
|||||||||||||||
|
|
||||||||||||||||||
2 |
|
|
|
|
|
|
|
|
|
2 |
2 |
|
2 |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
РО2( (МеО) |
|
|
|
|
|
|
|
К = |
|
|
К1 |
|
|
= |
|
|
|
(6.5) |
|||||||
|
|
|
|
К2 |
|
|
|
|
РО (ВО) |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
||
Если восстановителем будет СО, то реакции имеют вид |
|||||||||||||||||||
1) |
|
|
|
2МеО ↔ 2 Ме + О2 |
|
( GО ) |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
149 |
|
|
|
|
||
2) |
2СО |
2 ↔ 2СО + О2 |
|
( |
G2О ) |
|
2(МеО + СО ↔ Ме + СО2), |
(∆GО) . |
|||
Завершенность реакций в соответствии с уравнениями (6.2 - 6.5) характеризуется равновесным составом газовой фазы:
|
К1 = РО2 |
; |
|
|
||||||
К2 = |
РСО2 РО2 |
|
||||||||
РСО2 |
2 |
|
|
|
||||||
К |
РСО |
2 |
|
|
%СО |
(р) |
||||
|
|
|
|
2 |
|
|||||
РСО |
%СО(р) |
|||||||||
|
|
|||||||||
Если восстановление протекает с выделением тепла, то К – убывает, а % СО(р) увеличивается с повышением температуры (рис 6.1). Для эндотермического процесса получается противоположная зависимость.
Уравнение изотермы для данной реакции имеет вид:
|
1 |
|
|
|
|
|
%CO2(ф) |
|
|
|
|
∆G = |
|
(∆G - ∆G ) = |
|
|
|
|
|
|
|
, |
|
|
RT |
n |
nК |
||||||||
|
2 |
1 |
2 |
|
|
|
|
||||
|
|
|
|
|
|
%СО(ф) |
|
|
|
|
|
из которого следует, что при данной температуре направление процесса (определяемые знаком и величиной ∆G), зависит от соотношения фактических и равновесных концентраций СО и СО2.
Если |
%CO2(ф) |
< |
%CO2( р) |
, то ∆G < О, и смесь |
%СО(ф) |
|
|||
|
|
%СО(р) |
||
данного состава будет восстанавливать окисел, в противоположном случае – будет окислять металл. Точки на кривой (рис.6.1) отвечают равновесным условиям или нейтральным газовым смесям как по отношению к окислу, так и к металлу. Точки выше кривой (например точка а) соответствует избытку СО и недостатку СО2 в сравнении с равновесными концентрациями, т.е. восстановительным
150
