
Учебное пособие 800320
.pdf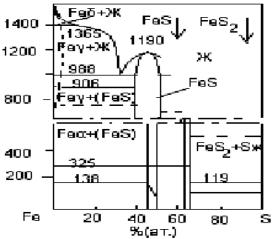
Рис. 4.9. Диаграмма состояний фаз в системе Fe-S.
Видно, что в этой системе отсутствуют химические соединения, соответствующие стехиометрии соединений
FeS и |
FeS2 . Вблизи этих составов имеются небольшие |
|
области |
однородных твёрдых растворов |
переменного |
состава. В частности в природе встречается пирротин, имеющий в своём составе серы больше, чем в FeS , его формула FeS1,12 . По диаграмме Fe S можно уточнить
состояние реагирующих фаз и последовательность превращений в системе.
Контрольные вопросы
1.Сформулируйте особенности термодинамического анализа карбонатов.
2.Проведите термодинамический анализ реакции образования и диссоциации карбонатов кальция, магния, железа.
111
3.Что такое температура начала разложения карбоната?
4.Что такое точка «химического» кипения и как её можно определить?
5.Как описывается термодинамическая прочность
окислов?
6.Как влияет степень дисперсности конденсированной фазы на её термодинамическую прочность?
7.Как зависит температура диссоциации окислов от концентрации растворов, в которых находятся реагирующие вещества?
8.Как влияют фазовые переходы реагирующих веществ на термодинамическую прочность окислов?
9.Охарактеризуйте влияние вакуумирования системы на термодинамическую прочность окислов.
10.Как рассчитывается кислородный потенциал
оксидов?
11.Проведите сравнение термодинамической прочности различных оксидов.
12.Охарактеризуйте термодинамическую прочность оксидов железа.
13.Сформулируйте основные закономерности превращения оксидов железа.
14.Проведите анализ состояния системы Fe-O по фазовой диаграмме железо-кислород.
15.Охарактеризуйте термодинамическую прочность сульфидов металлов.
16.Проведите анализ состояний в системе Fe-S по диаграмме состояния.
112
5. КИНЕТИКА И МЕХАНИЗМ РЕАКЦИЙ ВЗАИМОДЕЙСТВИЯ ТВЕРДЫХ И ГАЗООБРАЗНЫХ ВЕЩЕСТВ
Реакции между твердой и газообразной фазами в металлургических системах имеют очень большое значение. Различают две основные группы таких реакций – процессы окисления металлов и процессы термического разложения соединений, прежде всего карбонатов. Эти превращения относятся к топохимическим реакциям, у которых основные взаимодействия развиваются на поверхности раздела фаз, т.е. являются гетерогенными процессами.
5.1. Зарождение и рост новой фазы
Отмеченные выше и другие гетерогенные процессы (рост кристаллов из жидкой и газовой фазы, выделение газовых пузырей из жидкости, полиморфные превращения и др.) начинаются с зарождения новой фазы (твердой, жидкой, газообразной) в недрах старой. В дальнейшем при определенных условиях возникшие центры нового вещества разрастаются, увеличивая количество новой фазы. Такая двухстадийная схема характерна для большинства гетерогенных процессов, происходящих в металлургических системах. Рассмотрим условия появления зародышей новой фазы на примере разложения карбоната кальция. Существуют убедительные доказательства того, что реакция
СаСО3(тв) = СаО(т) + СО2(г) . |
(5.1) |
происходит на границе раздела между кальцитом и оксидом, поверхность которой с течением времени уменьшается.
Процесс разложения углекислого кальция развивается следующим образом. Карбонат и окисел имеют ионные кристаллические решетки, в узлах которых у СаСО3 ,
113
размещены катионы Са2+ и анионы СО32 , а у СаО—Са2+ и О2-.
Диссоциация начинается с распада аниона СО32 = СО2 + О2-.
После выделения молекул СО2 в решетке СаСО3 остаются пары ионов Са2+ и О2-, которые первоначально растворены в карбонате. Когда раствор становится пересыщенным, в отдельных микрообъемах возникают небольшие участки кристаллической решетки СаО, трехмерные зародыши. Для них величину изменения изобарного потенциала ∆G найдем из следующих соображений.
Допустим, зародыши новой фазы (СаО) имеют форму кубика с длиной ребра l и с числом пар ионов m = пℓ3, где n
— количество частиц в единице объема. Обозначим среднее значение химического потенциала СаО в пересчете на одну пару ионов в растворе (в карбонате) через ,а в новой фазе (в извести) — через °. Из раствора выделяется m пар ионов, за счет чего значение изобарного потенциала системы уменьшается на m . Образование из тех же частиц
новой фазы ведет к увеличению G на m о. Изменение изобарного потенциала ∆G = m ( о - ).
Появление зародыша сопряжено с возникновением новой поверхности площадью F = 6l2 и соответствующим увеличением потенциала на Fσ.
Общее изменение изобарного потенциала |
|
∆ G = пℓ3( о - ) + 6ℓ2σ, |
(5.2) |
где σ - межфазное натяжение.
Величина и знак разности о - зависят при данной температуре от концентрации раствора. Если он не насыщен, то< о, о - > 0, и первое слагаемое в уравнении (5. 2) — положительная величина. Так как второе слагаемое всегда положительно, то увеличение размера зародыша (l) сопровождается непрерывным увеличением ∆ G (рис. 5.1).
114
Самопроизвольное течение изотермического процесса при P = const возможно лишь в сторону уменьшения изобарного потенциала системы. Поэтому в ненасыщенных растворах не происходит роста частиц новой фазы. Возникшие зародыши, растворяются, так как только при этом величина потенциала убывает. По мере разложения карбоната концентрация СаО увеличивается, и ее химический потенциал в растворе ( ) растет. Следовательно, разность о - и величина ∆ G для зародышей одинакового размера уменьшаются.
Процесс зародышеобразования можно описать как возникновение гетерофазной флуктуации, вероятность возникновения которой можно найти по уравнению
|
|
w = |
e-∆G/RT |
(5.3) |
где ∆ G |
- изменение изобарного потенциала в результате |
|||
флуктуации, R – универсальная газовая постоянная, Т – |
||||
температура. |
|
|
|
|
Поэтому при |
уменьшении |
∆ G вероятность |
||
образования зародышей увеличивается |
|
|||
Иначе |
говоря, |
с |
повышением |
концентрации чаще |
возникают частицы новой фазы данного размера. Но пока система не насыщена, частицы неустойчивы и снова переходят в раствор. При насыщении чистая фаза находится в равновесии с раствором, и о = . В данном случае также невозможно выделение новой фазы, так как по-прежнему рост зародыша сопровождается увеличением ∆ G.
В пересыщенных растворах > °, о - < 0, и первое слагаемое в уравнении (5.2) становится отрицательным; второе же всегда положительно. Это означает, что выделение вещества из такого раствора сопровождается убылью изобарного потенциала системы, а создание новой поверхности раздела — его увеличением. Противоположное влияние двух факторов приводит к тому, что на кривой в координатах ∆G
115

- при критическом размере зародыша ( кр ) появляется
максимум (рис.5.1).
G
1
( Gmax )2 2 ( Gmax )3 3
( кр )3 ( кр)2 |
|
Рис. 5.1. Изменение Gсистемы при образовании зародышей новой фазы различных размеров ( ):
1- в ненасыщенном растворе ( 1 0 )
2- в пересыщенном растворе ( 2 0 )
3- то же самое при более высокой концентрации
раствора ( 3 2 )
Зародыши менее критической величины по-прежнему не могут расти, так как это сопряжено с повышением ∆ G — они возникают и снова растворяются. Частицы размером кр
находятся в состоянии неустойчивого равновесия, для них равновероятны и рост и растворение. Если возникшие зародыши имеют размер- кр , то их дальнейшее увеличение связано с уменьшением
∆ G и рост таких частиц может протекать самопроизвольно. Итак, выделение новой фазы возможно лишь из пересыщенного раствора, и при условии, что возникающие трехмерные зародыши имеют величину не менее критической. Для нахождения кр , соответствующего максимуму
функции (∆Gmax), продифференцируем уравнение (5.2) и приравняемпервую производную нулю
116

( G) = 3nℓ2( о - ) + 12 σ = 0
l
Решая это уравнение относительно , найдем
кр = |
4 |
|
(5.4) |
n( |
|
||
|
о) |
||
Подстановка уравнения 5.4 в уравнение 5.2 дает
∆G = |
32 2 |
(5.5) |
max
n2( o)2
Соотношения (5.2, 5.4 и 5.5) получены для кубических кристалликов. Для частиц любой формы сохраняются такие же выражения, отличающиеся лишь величиной численныхкоэффициентов.
Величина ∆Gmax соответствует работе образования критических зародышей и определяет вероятность или частоту возникновения этих зародышей, а следовательно, и скорость процесса.
Из уравнения (5.5) видно, что ∆Gmax зависит, в частности,
от ( - о ) иσ.
Разность - о = ∆ , показывающая превышение величины изобарного или химического потенциала системы над равновесным значением, является мерой пересыщения. Эта величина связана не только с концентрацией пересыщенного раствора, но и с любыми факторами, обусловливающими отклонение системы от равновесия. Например, для процесса разложения карбоната при данной температуре степень удаленности от равновесия или пересыщение определяется тем, насколько фактическое парциальное давление двуокиси углерода Рсо2(ф) меньше равновесного (давления диссоциации). В газовой фазе постоянного состава разложение карбоната возможно при температуре Т1, более высокой, чем
117
равновесная Тн.р (см, рис. 4.1), а его образование—при Т2<Тн.р. Мерой пересыщения системы в первом случае служит величина перегрева Т1 - Тн.р = ∆Тнаг , а во втором — переохлаждения Tн.р - Т2 = ∆Тохл. Из уравнений (5.4 и 5.5.) вытекает, что чем больше пересыщение, тем меньше критический размер зародыша и величина изменения изобарного потенциала, связанная с его образованием (∆Gmax). Графически это иллюстрирует рис. 5.1 (кривые 2 и 3).
Размер критического зародыша и работа его образования существенно зависят от величины поверхностного натяжения ( ) на границе раздела старой и новой фаз. С понижением межфазного натяжения уменьшаются ℓкр и ∆Gmax, и облегчается процесс возникновения зародышевых центров новой фазы. Величинаопределяется природой соприкасающихся фаз. Если последние твердые, то межфазное натяжение тем меньше, чем более сходны их кристаллические структуры, т. е. чем более близки по строению и размерам их решетки.
Закономерности образования нового кристаллического вещества на готовой твердой поверхности сформулированы в виде принципа ориентационного и размерного соответствия. Согласно последнему, в указанных процессах 'кристаллическая решетка новой фазы сопрягается с решеткой исходной фазы подобными кристаллическими плоскостями, параметры которых отличаются друг от друга минимально. Это объясняется тем, что в пограничных слоях атомы (ионы) возникающего вещества находятся под воздействием ориентирующих сил атомов исходной фазы. При небольшом различии в параметрах решеток соприкасающихся фаз наблюдается ориентированная кристаллизация, когда новая решетка становится продолжением старой. В таких случаях межфазное натяжение минимально, и новая фаза возникает
118
при незначительной величине критического зародыша или небольшом пересыщении.
При существенной разнице в кристаллическом строении фаз новое вещество образуется независимо от структуры поверхности исходного. Здесь уже ориентирующие силы не облегчают зарождения новой фазы. Последняя кристаллизуется самостоятельно, и ее зародыши принимают случайную ориентацию по отношению к исходной кристаллической поверхности. В данном случае межфазное натяжение несравненно больше, чем в предыдущем. Это ведет (при данной степени пересыщения) к увеличению размера критического зародыша и работы его образования, а следовательно, к значительному уменьшению вероятности возникновения частиц новой фазы и скорости превращения. Осуществление процесса требует повышенного пересыщения системы.
Возникшие трехмерные зародыши растут не за счет постепенного перехода отдельных атомов (ионов) из старой в новую фазу. Это происходит путем присоединения к грани растущего кристалла достаточно больших скоплений указанных части» в виде так называемых двухмерных зародышей, т. е. зародышей мономолекулярной толщины. Аналогично предыдущему можно показать, что такие зародыши устойчивы на гранях трехмерных кристалликов и способны к дальнейшему увеличению лишь в том случае, если они будут не меньше критического размера. Трехмерный критический зародыш после его образования быстро растет, последовательно присоединяя к себе ряды молекул (ионов) до полного покрытия грани кристалла одномолекулярным слоем. После некоторой паузы подобным образом происходит наращивание нового слоя и т. д.
Формирование двухмерных зародышей также требует некоторой работы, которая, однако, значительно меньше, чем приобразованиитрехмерных. Поэтомупроцесспокрытияграней одномолекулярными слоями, называемый линейным ростом
119
кристаллов, требует много меньшего пересыщения и протекает гораздо легче, чем возникновение зародышевыхцентров.
Из вышеизложенного можно сделать следующие выводы, справедливые для любых процессов образования новой фазы:
1) новая фаза выделяется из старой только в пересыщенных системах и при условии, что возникающие зародыши имеют размер не менее критического;
2)чем меньше критический размер зародыша, тем; больше вероятность его возникновения и выше скорость процесса;
3)величина критического зародыша уменьшается, а
скорость возникновения новой |
фазы растет с понижением |
межфазного натяжения и |
увеличением степени |
пересыщения; |
|
4)в превращениях с участием твердых тел процесс значительно облегчается при наличии между соприкасающимися кристаллическими фазами ориентационного и размерного соответствия;
5)рост возникших центров новой фазы протекает значительно легче, чем их зарождение.
5.2.Кинетика и механизм реакции разложения карбоната кальция
Суммарный процесс диссоциации карбоната кальция складывается из следующих стадий:
1)распад аниона СО32 с образованием
адсорбированных на твердой поверхности молекул СО2 , СО32 → О2- ∙ СО2(адс);
2) десорбция этих молекул, О2-∙СО2(адс) → O2- + -
СО2(г)..
В результате 1 и 2 стадий в карбонате остаются пары ионов О2- и Са2+, которые вначале располагаются в
120
