
- •Общая физика в задачах
- •Механика. Молекулярная физика и термодинамика.
- •Электричество и магнетизм
- •Сборник задач
- •А.В. Калач [и др.]; Воронежский гасу. – Воронеж, 2012. – 181 с.
- •Рецензенты:
- •Введение
- •Глава 1. Сведения о векторах теоретические сведения
- •Задачи для самостоятельного решения
- •Глава 2. Физические основы механики теоретические сведения Кинематика поступательного и вращательного движения
- •Мгновенная скорость:
- •Динамика материальной точки и поступательного движения абсолютно твёрдого тела
- •Работа и энергия
- •Вращательное движение абсолютно твёрдого тела
- •Тяготение. Элементы теории поля
- •Сила тяжести:
- •Механика жидкостей и газов
- •Релятивистская механика
- •Примеры решения задач Кинематика поступательного и вращательного движения
- •Динамика материальной точки и поступательного движения абсолютно твёрдого тела
- •Работа и энергия
- •Вращательное движение абсолютно твёрдого тела
- •Момент инерции маховика в виде сплошного диска определяется формулой
- •Тяготение. Элементы теории поля
- •Механика жидкостей и газов
- •Релятивистская механика
- •Задачи для самостоятельного решения Кинематика поступательного и вращательного движения
- •Динамика материальной точки и поступательного движения абсолютно твёрдого тела
- •Работа и энергия
- •Вращательное движение абсолютного твердого тела
- •Тяготение. Элементы теории поля
- •Механика жидкостей и газов
- •Релятивистская механика
- •Глава 3. Молекулярная физика и термодинамика теоретические сведения Молекулярно-кинетическая теория идеальных газов
- •Основы термодинамики
- •Примеры решения задач Молекулярно-кинетическая теория идеальных газов
- •Основы термодинамики
- •Задачи для самостоятельного решения Молекулярно-кинетическая теория идеальных газов
- •Основы термодинамики
- •Глава 4. Электричество и магнетизм теоретические сведения Электростатика
- •Постоянный электрический ток. Электрические токи в металлах, жидкостях, вакууме и газах
- •Плотность тока насыщения:
- •Магнитное поле
- •Закон Био-Савара-Лапласа
- •Электромагнитная индукция
- •Магнитное поле в веществе
- •Движение заряженных частиц в магнитном поле
- •Примеры решения задач Электростатика
- •Постоянный электрический ток. Электрические токи в металлах, жидкостях, вакууме и газах
- •Магнитное поле
- •Электромагнитная индукция
- •Магнитное поле в веществе
- •Движение заряженых частиц в магнитном поле
- •Электростатика
- •Постоянный электрический ток. Электрические токи в металлах, жидкостях, вакууме и газах
- •Магнитное поле
- •Электромагнитная индукция
- •Магнитное поле в веществе
- •Движение заряженных частиц в магнитном поле
- •Ответы сведения о векторах
- •Физические основы механики Кинематика поступательного и вращательного движения
- •Динамика материальной точки и поступательного движения абсолютно твердого тела
- •Работа и энергия
- •Динамика вращательного движения абсолютно твёрдого тела
- •Тяготение. Элементы теории поля
- •Механика жидкостей и газов
- •Релятивистская механика
- •Молекулярная физика и термодинамика Молекулярно-кинетическая теория идеальных газов
- •Основы термодинамики
- •Электричество и магнетизм Электростатика
- •Постоянный ток. Электрические токи в металлах, жидкостях, вакууме и газах
- •Магнитное поле
- •Электромагнитная индукция
- •Магнитное поле в веществе
- •Движение заряженных частиц в магнитном поле
- •Библиографический список
- •Справочные сведения
- •1. Фундаментальные физические постоянные
- •2. Греческий алфавит
- •3. Сведения о Солнце, Земле и Луне
- •4. Множители и приставки си для десятичных кратных и дольных единиц
- •5. Плотность ρ, 103 кг/м3, некоторых веществ
- •6. Диэлектрическая проницаемость ε некоторых веществ
- •7. Удельная теплоемкость с, 103 Дж/(кг⋅к), некоторых веществ
- •8. Удельное сопротивление ρ, 10-8 Ом·м, некоторых веществ (при 20 0с)
- •Оглавление
- •Общая физика в задачах
- •Механика. Молекулярная физика и термодинамика.
- •Электричество и магнетизм
- •Сборник задач
- •3 94006 Воронеж, ул. 20-летия Октября, 84
Примеры решения задач Молекулярно-кинетическая теория идеальных газов
Пример 1. В баллоне объемом 10 л находится гелий под давлением P1 = 1МПа и при температуре T1 = 300 К. После того, как из баллона было взято m = 10 г гелия, температура в баллоне понизилась до Т2 = 290 К. Определите давление Р2 гелия, оставшегося в баллоне.
Решение. Для решения задачи воспользуемся уравнением Менделеева – Клапейрона, применив его к конечному состоянию газа:
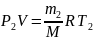 ,
(1)
,
(1)
где m2 – масса гелия в баллоне в конечном состоянии; μ – молярная масса гелия; R – молярная газовая постоянная.
Из уравнения (1) выразим искомое давление:
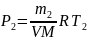 .
(2)
.
(2)
Массу m2 гелия выразим через массу m1, соответствующую начальному состоянию, и массу m гелия, взятого из баллона:
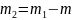 .
(3)
.
(3)
Массу m1 гелия найдем также из уравнения Менделеева – Клапейрона, применив его к начальному состоянию:
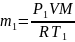 .
(4)
.
(4)
Подставив выражение массы m1 в (3), а затем выражение m2 в (2), найдем
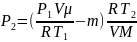 ,
,
или
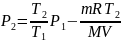 . (5)
. (5)
Произведем вычисления по формуле (5), учитывая, что M = 4⋅10-3 кг/моль:
 .
.
Ответ: P2 = 0,364 МПа.
Пример 2. Баллон содержит m = 80 г кислорода и m2 = 320 г аргона. Давление смеси P =1 МПа, температура Т = 300 К. Принимая данные газа за идеальные, определите объем V баллона.
Решение. По закону Дальтона давление смеси равно сумме парциальных давлений газов, входящих в состав смеси. По уравнению Клапейрона – Менделеева парциальные давления P1 кислорода и P2 аргона выражаются формулами
 .
(1)
.
(1)
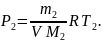 (2)
(2)
По закону Дальтона давление смеси газов
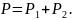 (3)
(3)
Следовательно, с учетом (1) и (2)
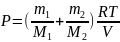 . (4)
. (4)
Найдем объем V из выражения (4):
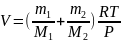 . (5)
. (5)
Произведем вычисления, учитывая, что M1 = 32·10-3кг/моль,
а M2 = 40·10-3 кг/моль:
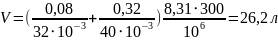
Ответ: V = 26,2 л.
Пример 3. Двухатомный газ, находящийся под давлением P = 0,1 МПа в сосуде объемом V = 0,5 м3, нагревают от T1 = 30 до T2= 130 0С. Определить количество теплоты Q, необходимое для изохорического нагревания газа.
Решение. Количество теплоты, необходимое для нагревания, можно найти по формуле
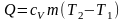 .
(1)
.
(1)
Здесь cV – удельная теплоемкость при постоянном объеме.
Молярная СV и удельная сV теплоемкости связаны соотношением
CV = cVM. (2)
Молярная теплоемкость при постоянном объеме:
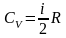 ,
(3)
,
(3)
где i – число степеней свободы.
Из (2) и (3) следует, что
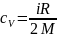 .
(4)
.
(4)
Молярную массу газа найдем из уравнения Менедлеева-Клапейрона, характеризующего начальное состояние газа:
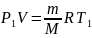 ,
(5)
,
(5)
 .
(6)
.
(6)
Подставим (6) в (4), а затем полученное выражение подставим в (1):
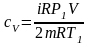 ,
(7)
,
(7)
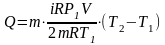 ,
(8)
,
(8)
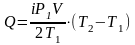 .
(9)
.
(9)
Подставим в (9) числовые данные и получим значение Q:
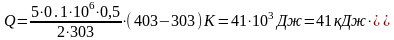 .
.
Ответ: количество теплоты Q = 41 кДж.
