
- •Общая физика в задачах
- •Механика. Молекулярная физика и термодинамика.
- •Электричество и магнетизм
- •Сборник задач
- •А.В. Калач [и др.]; Воронежский гасу. – Воронеж, 2012. – 181 с.
- •Рецензенты:
- •Введение
- •Глава 1. Сведения о векторах теоретические сведения
- •Задачи для самостоятельного решения
- •Глава 2. Физические основы механики теоретические сведения Кинематика поступательного и вращательного движения
- •Мгновенная скорость:
- •Динамика материальной точки и поступательного движения абсолютно твёрдого тела
- •Работа и энергия
- •Вращательное движение абсолютно твёрдого тела
- •Тяготение. Элементы теории поля
- •Сила тяжести:
- •Механика жидкостей и газов
- •Релятивистская механика
- •Примеры решения задач Кинематика поступательного и вращательного движения
- •Динамика материальной точки и поступательного движения абсолютно твёрдого тела
- •Работа и энергия
- •Вращательное движение абсолютно твёрдого тела
- •Момент инерции маховика в виде сплошного диска определяется формулой
- •Тяготение. Элементы теории поля
- •Механика жидкостей и газов
- •Релятивистская механика
- •Задачи для самостоятельного решения Кинематика поступательного и вращательного движения
- •Динамика материальной точки и поступательного движения абсолютно твёрдого тела
- •Работа и энергия
- •Вращательное движение абсолютного твердого тела
- •Тяготение. Элементы теории поля
- •Механика жидкостей и газов
- •Релятивистская механика
- •Глава 3. Молекулярная физика и термодинамика теоретические сведения Молекулярно-кинетическая теория идеальных газов
- •Основы термодинамики
- •Примеры решения задач Молекулярно-кинетическая теория идеальных газов
- •Основы термодинамики
- •Задачи для самостоятельного решения Молекулярно-кинетическая теория идеальных газов
- •Основы термодинамики
- •Глава 4. Электричество и магнетизм теоретические сведения Электростатика
- •Постоянный электрический ток. Электрические токи в металлах, жидкостях, вакууме и газах
- •Плотность тока насыщения:
- •Магнитное поле
- •Закон Био-Савара-Лапласа
- •Электромагнитная индукция
- •Магнитное поле в веществе
- •Движение заряженных частиц в магнитном поле
- •Примеры решения задач Электростатика
- •Постоянный электрический ток. Электрические токи в металлах, жидкостях, вакууме и газах
- •Магнитное поле
- •Электромагнитная индукция
- •Магнитное поле в веществе
- •Движение заряженых частиц в магнитном поле
- •Электростатика
- •Постоянный электрический ток. Электрические токи в металлах, жидкостях, вакууме и газах
- •Магнитное поле
- •Электромагнитная индукция
- •Магнитное поле в веществе
- •Движение заряженных частиц в магнитном поле
- •Ответы сведения о векторах
- •Физические основы механики Кинематика поступательного и вращательного движения
- •Динамика материальной точки и поступательного движения абсолютно твердого тела
- •Работа и энергия
- •Динамика вращательного движения абсолютно твёрдого тела
- •Тяготение. Элементы теории поля
- •Механика жидкостей и газов
- •Релятивистская механика
- •Молекулярная физика и термодинамика Молекулярно-кинетическая теория идеальных газов
- •Основы термодинамики
- •Электричество и магнетизм Электростатика
- •Постоянный ток. Электрические токи в металлах, жидкостях, вакууме и газах
- •Магнитное поле
- •Электромагнитная индукция
- •Магнитное поле в веществе
- •Движение заряженных частиц в магнитном поле
- •Библиографический список
- •Справочные сведения
- •1. Фундаментальные физические постоянные
- •2. Греческий алфавит
- •3. Сведения о Солнце, Земле и Луне
- •4. Множители и приставки си для десятичных кратных и дольных единиц
- •5. Плотность ρ, 103 кг/м3, некоторых веществ
- •6. Диэлектрическая проницаемость ε некоторых веществ
- •7. Удельная теплоемкость с, 103 Дж/(кг⋅к), некоторых веществ
- •8. Удельное сопротивление ρ, 10-8 Ом·м, некоторых веществ (при 20 0с)
- •Оглавление
- •Общая физика в задачах
- •Механика. Молекулярная физика и термодинамика.
- •Электричество и магнетизм
- •Сборник задач
- •3 94006 Воронеж, ул. 20-летия Октября, 84
Глава 3. Молекулярная физика и термодинамика теоретические сведения Молекулярно-кинетическая теория идеальных газов
Плотность вещества определяется из соотношения
 ,
,
где m – масса вещества, V – его объем.
Количество вещества определяется из соотношений
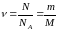 ,
,
где N – число частиц; NA – число Авогадро; m – масса вещества; M – его молярная масса.
Основное уравнение молекулярно–кинетической теории идеальных газов:
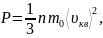
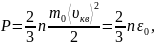

где n
– число молекул в единице объема
(концентрация); m0
– масса одной молекулы;
 – среднеквадратичная скорость молекул;
ε0 – средняя
кинетическая энергия поступательного
движения молекул идеального газа; k
– постоянная Больцмана; T
– абсолютная температура газа.
– среднеквадратичная скорость молекул;
ε0 – средняя
кинетическая энергия поступательного
движения молекул идеального газа; k
– постоянная Больцмана; T
– абсолютная температура газа.
Закон Дальтона для давления смеси N идеальных газов:
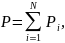
где pi – парциальное давление i-го компонента смеси.
Уравнение состояния идеального газа (уравнение Клайперона–Менделеева):

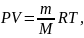
где Vm – молярный объем газа; m – масса газа; M – молярная масса газа; R – молярная газовая постоянная; ν = m/M – число молей газа.
Закон распределения молекул по энергиям теплового движения (закон Максвелла) позволяет найти число молекул N, имеющих кинетическую энергию поступательного движения в интервале от до +:
 .
.
Скорости молекул:
среднеквадратичная:
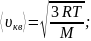
среднеарифметическая:
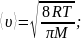
наиболее вероятная:
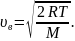
Барометрическая формула:
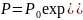
где P и P0 – давление газа на высоте h и h0; g – ускорение свободного падения.
Распределение (Больцмана) молекул во внешнем потенциальном поле:
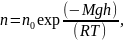
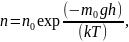
где n и n0 – концентрация молекул на высоте h и h0 = 0; g – ускорение свободного падения; m0 – масса одной молекулы; M – молярная масса газа.
Средняя длина свободного пробега молекулы газа:
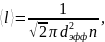
где dэфф – эффективный диаметр молекулы.
Среднее число столкновений одной молекулы в единицу времени:
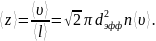
Общее число столкновений всех молекул в единице объема за единицу времени:

Число молекул, ударяющих за единицу времени в единичную площадку, которая помещена в газе:
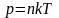 .
.
Масса, перенесенная за время t при диффузии (закон Фика):
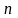 ,
,
где
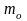 – градиент плотности в направлении,
перпендикулярном к площадке S;
D – коэффициент
диффузии.
– градиент плотности в направлении,
перпендикулярном к площадке S;
D – коэффициент
диффузии.
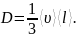
Количество теплоты, перенесенное за время t за счет теплопроводности, определяется формулой
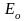 ,
,
где
 – градиент температуры в направлении,
перпендикулярном площадке S;
– коэффициент
теплопроводности.
– градиент температуры в направлении,
перпендикулярном площадке S;
– коэффициент
теплопроводности.

где cV = CV/M – удельная теплоемкость газа при постоянном объеме; – плотность газа.
Сила внутреннего трения Fтр в газе:
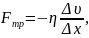
где υ / x – градиент скорости течения газа в направлении, перпендикулярном к площадке S; η – динамическая вязкость.
Основы термодинамики
Средняя кинетическая энергия поступательного движения, приходящаяся на одну степень свободы молекулы:
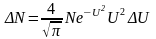 ,
,
где k – постоянная Больцмана, Т – абсолютная температура.
Средняя энергия молекулы:
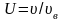 ,
,
где i – число степеней свободы (поступательных, вращательных и удвоенного числа колебательных степеней свободы).
Число степеней свободы для молекул газа:
– одноатомных i = 3;
– двухатомных i = 5;
– трехатомных i = 6.
Внутренняя энергия идеального газа:
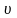 ,
,
где ν – количество вещества, m – масса газа, М – молярная масса газа, R – молярная газовая постоянная.
Первое начало термодинамики может быть записано в виде
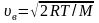 ,
,
где dQ – количество теплоты, подводимое к системе; dU – изменение внутренней энергии системы; dA – работа, совершаемая системой или над ней внешними силами.
Связь между молярной C и удельной c теплоемкостями газа:
C = cM,
где М – молярная масса газа.
Молярные теплоемкости газа:
– при постоянном объеме
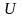 ;
;
– при постоянном давлении
 .
.
Связь молярных теплоемкостей при постоянном объеме и постоянном давлении:
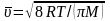 .
.
Изменение внутренней энергии идеального газа:
.
Работа, совершаемая газом:

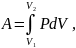
где V1 и V2 – начальный и конечный объемы газа.
Работа газа при различных процессах:
– при изобарном

– при изотермическом
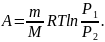
Уравнение адиабатического процесса (уравнение Пуассона):

где
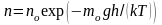 .
.
Работа при адиабатическом процессе:
.
Уравнение политропического процесса:
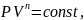
где
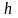 – показатель политропы.
– показатель политропы.
Работа при политропическом процессе:
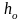 .
.
Коэффициент полезного действия тепловой машины (практический КПД):
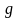 ,
,
где Q1 – количество теплоты, полученное рабочим телом от нагревателя; Q2 – количество теплоты, отданное холодильнику.
Для цикла Карно:
,
где Т1 – температура нагревателя; Т2 – температура холодильника.
Разность энтропий двух состояний:
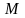 .
.
Термодинамическая вероятность W и энтропия S связаны соотношением
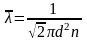 .
.
