
- •Физико-химия и технология полимеров, полимерных композитов
- •Введение
- •ГлаВа 1. Основные определения и понятия высокомолекулярных соединений
- •Номенклатура полимеров
- •Классификация вмс
- •Сополимеры
- •Основные отличия вмс от низкомолекулярных соединений
- •Значение вмс в природе, технике, технологии
- •Вопросы для самоподготовки
- •Глава 2. Методы получения полимеров
- •Синтез полимеров реакцией цепной полимеризации
- •Мономеры реакции полимеризации
- •Радикальная полимеризация
- •Кинетические закономерности
- •Регуляторы и ингибиторы
- •Влияние различных факторов на процесс радикальной полимеризации
- •Ионная полимеризация
- •Катионная полимеризация (кп)
- •Катализаторы катионной полимеризации. Сокатализаторы
- •Механизм и кинетика катионной полимеризации
- •Факторы, влияющие на процесс катионной полимеризации
- •Анионная полимеризация
- •Механизм и кинетика анионной полимеризации
- •Анионно-координационная полимеризация
- •Полимеризация полиеновых соединений
- •Полимеризация с раскрытием цикла
- •Ступенчатая полимеризация
- •Поликонденсация
- •Факторы, влияющие на процесс поликонденсации
- •Способы проведения полимеризации и поликонденсации
- •Вопросы для самоподготовки
- •Глава 3. Физико-Механические свойства полимеров
- •Гибкость цепи полимеров
- •Термодинамическая и кинетическая гибкость
- •Параметры, определяющие гибкость цепи
- •Факторы, влияющие на термодинамическую гибкость цепи
- •Факторы, влияющие на кинетическую гибкость цепи
- •Физические состояния полимеров
- •Вопросы для самоподготовки
- •Глава 4. Растворы высокомолекулярных соединений
- •Сравнительные особенности золей и растворов высокомолекулярных соединений
- •Термодинамика растворения вмс
- •Набухание вмс
- •Свойства растворов вмс
- •Вязкость растворов вмс
- •Изоэлектрическая точка полиамфолитов
- •Мембранное равновесие
- •Устойчивость растворов вмс
- •Коллоидная защита
- •Пластификация и применение растворов вмс
- •Вопросы для самоподготовки
- •Глава 5. Химические превращения полимеров
- •Особенности химических реакций полимеров
- •Полимераналогичные превращения
- •Макромолекулярные реакции
- •Реакции концевых групп
- •Реакции деструкции
- •Химическая деструкция полимеров
- •Физическая деструкция полимеров
- •Добавки, снижающие скорость старения полимеров
- •Вопросы для самоподготовки
- •Глава 6. Композиционные материалы
- •Факторы, влияющие на процессы образования и свойства композиционных материалов
- •Совместимость компонентов композита
- •Переработка полимерных материалов
- •Некоторые представители композиционных материалов, применяемых в строительстве
- •Понятие адгезии, работа адгезии
- •Теории адгезии
- •Пленкообразующие и лакокрасочные материалы
- •Вопросы для самоподготовки
- •Лабораторные работы
- •Синтез высокомолекулярных соединений
- •Экспериментальная часть Получение полимеров методом полимеризации
- •Получение полимеров методом поликонденсации
- •Контрольные вопросы и упражнения
- •Физико-механические свойства полимеров
- •Массы полимеров
- •Экспериментальная часть
- •Контрольные вопросы и упражнения
- •Экспериментальная часть
- •Контрольные вопросы и упражнения
- •Экспериментальная часть
- •Контрольные вопросы и упражнения
- •Химические превращения полимеров
- •Экспериментальная часть Полимераналогичные превращения или реакции звеньев цепи
- •Макрореакции полимеров
- •Контрольные вопросы и упражнения
- •Научно-исследовательская работа
- •Темы рефератов
- •План и порядок оформления рефератов
- •Темы нир по полимерным композиционным материалам
- •Примерный развернутый план проведения исследований
- •Итоговое тестирование
- •Словарь терминов (глоссарий)
- •Библиографический список рекомендуемой литературы Основная литература
- •Дополнительная литература
- •Оглавление
- •3 94006 Воронеж, ул. 20-лет Октября, 84
Катализаторы катионной полимеризации. Сокатализаторы
Катализаторы - сильные акцепторы электронов. В качестве катализаторов используются: протонные кислоты (серная H2SO4, хлорная HClO4, фосфорная H3PO4), апротонные кислоты или кислоты Льюиса - полигалоидные соли металлов ( BF3 > AlBr3 > TiCl4 > TiBr4 > BCl3 > BBr3 > SnCl4 ).
При использовании протонных кислот происходит прямое протонирование мономера с образованием иона карбония:
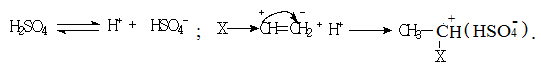
Полимеризация в присутствии протонных кислот производится, как правило, при довольно высоких температурах (200-3000С) и приводит к образованию полимеров с небольшой молекулярной массой до 1000 а.е.м.. Они используются в качестве дизельного топлива, смазочных материалов.
При использовании апротонных кислот, часто требуются сокатализаторы, являющиеся донорами протонов (вода, некоторые кислоты). При взаимодействии сокатализатора с молекулой катализатора образуется комплекс:
![]()
который протонирует мономер с образованием активного центра – иона карбония:

Роль сокатализаторов могут играть некоторые алкилгалогениды. Предполагают, что здесь же образуется комплекс, который при взаимодействии с мономерами приводит к образованию иона карбония:
![]()
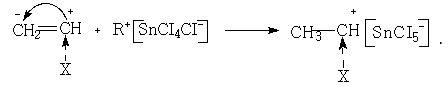
Механизм и кинетика катионной полимеризации
Катионная полимеризация, как уже было сказано, протекает в три стадии.
1. Инициирование, которое в свою очередь состоит из следующих этапов:
а) диссоциация катализатора или его взаимодействие с сокатализатором:
![]()
б) взаимодействие катализатора с мономером, превращение его в ион карбония, образующего ионную пару:
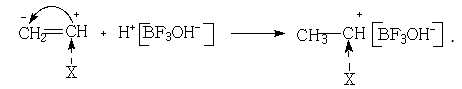
Скорость инициирования выразится следующим образом:
Vu = Ku∙[K]∙[А] , (2.14)
где Vu – скорость реакции инициирования; Ku – константа скорости процесса инициирования, [K] – концентрация сокатализатора Н2О; [А] – концентрация мономера.
2. Рост цепи. Полученная ионная пара взаимодействует с молекулой мономера многократно, передавая по растущей цепи положительный заряд:
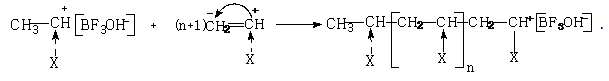
Скорость роста цепи выражается уравнением
Vp = Kp∙[А]∙[А+], (2.15)
где Кр – константа скорости реакции роста цепи; [А+] – концентрация карбониевого иона; [А] – концентрация мономера.
3. Обрыв цепи. Обрыв цепи может быть самопроизвольный или осуществлен передачей цепи на противоион.
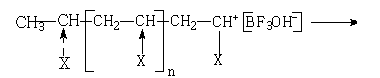

Скорость самопроизвольного обрыва цепи выражается уравнением
Vo = Ko∙[А+] . (2.16)
При
установившемся состоянии равновесия
средняя степень полимеризации (![]() )
равна
)
равна
 (2.17)
(2.17)
где Vр – скорость роста цепи; Vо – скорость обрыва цепи; Kр – константа скорости реакции роста цепи; Kо – константа скорости реакции обрыва цепи; K – константа скорости реакции полимеризации; [А] – концентрация мономера, [А+ ] – концентрация карбониевого иона.
Следовательно, средняя степень полимеризации прямо пропорциональна концентрации мономера и не зависит от концентрации катализатора.
Суммарная скорость (V) реакции полимеризации равняется произведению скорости реакции инициирования (Vu) на среднюю степень полимеризации:
![]() (2.18)
(2.18)
где Vи – скорость реакции инициирования; – средняя степень полимеризации; Kи – константа скорости реакции инициирования; [K] – концентрация сокатализатора Н2О; K` – константа скорости реакции полимеризации; [А] – концентрация мономера.
При условии, что концентрация мономера [А]=const, это уравнение принимает вид
V = K`∙[K] , (2.19)
где суммарная скорость катионной полимеризации прямо пропорциональна концентрации катализатора.
Вследствие того, что одинаково заряженные макроионы взаимно отталкиваются, невозможен обрыв цепи путем рекомбинации, как это имело место при радикальной полимеризации.
Обрыв молекулярной цепи может произойти в результате передачи цепи на мономер или полимер. Передача цепи на мономер часто бывает при очень низких температурах:
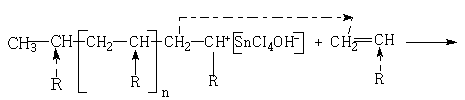
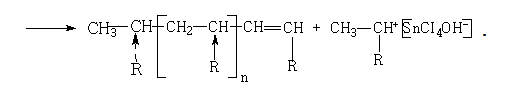
В мономере вновь образуется активный центр, который начинает новую цепь полимера. Передача цепи на полимер приводит к образованию разветвленных полимеров:
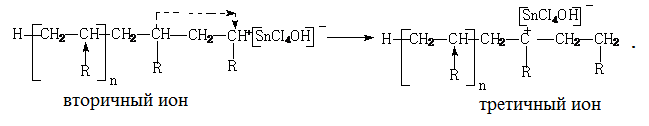
Здесь из вторичного иона в результате перегруппировки образуется третичный ион, что служит началом образования разветвления полимерной цепи.
