
Учебники / Лекции по термодинамике неравновесных систем. Пармон
.pdfВ ситуации, когда доминирующей формой активного центра является интермедиат K2, т. е. адсорбированная форма
|
|
|
|
|
|
|
|
|
|
|
|
θK |
2 |
|
|
ε |
|
|
~ ~ |
|
μKo − μKo |
2 |
|
|
|||||
конечного продукта |
|
Р, |
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
θ |
|
|
≡ |
ε |
3 |
R +P |
exp |
|
RT |
|
|
>>1 и |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
K |
|
|
|
|
|
|
|
|
|
|
|
||||||
|
θK |
2 |
|
ε |
|
~ ~ |
|
|
|
μKo |
− μKo |
|
|
|
θK |
1 |
~ |
|
|
μKo − μKo |
|
||||||||
|
|
|
|
2 |
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
1 |
|
|
|
||||
|
θ |
|
≡ |
ε |
3 |
R +P |
exp |
|
|
RT |
|
|
>> |
|
θ |
|
≡ R exp |
RT |
|
|
. |
||||||||
|
K |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
K |
|
|
|
|
|
|
|
|
||||
|
|
При этом возможны две альтернативы. |
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
~ |
|
|
~ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
a) Если ε2R |
>> ε3P , степень заполнения активного центра |
||||||||||||||||||||||||||
интермедиатом K2 контролируется концентрацией исходного |
|||||||||||||||||||||||||||||
реагента R и |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
~ ~ |
|
|
μKo 2 − μKo |
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
v |
|
|
≈ ε K R exp |
|
|
|
|
. |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
RT |
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
Σ |
|
3 o |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Обратим внимание, что в этой ситуации скорость-
определяющим параметром оказывается усеченная константа скорости ε3 элементарной реакции 3 элиминиро-
вания конечного продукта из интермедиата К2, а не константы ε2 реальной скорость-лимитирующей стадии 2.
Кажущаяся энергия активации всей реакции при этом
|
E |
a Σ |
≈ |
H≠o |
|
|
− |
Ho |
+RT ≡ E |
aK2 |
,KP |
, |
||||
|
|
|
f |
K2 ,KP |
|
f K2 |
|
|
|
|
|
|||||
что соответствует энергии активации |
Ea K 2 ,KP |
стадии 3 (см. |
||||||||||||||
рис. 1.8, б). |
~ |
|
|
~ |
|
|
|
|
|
|
|
|
|
|
|
|
б) Если ε2R << ε3P , заполнение активного центра интерме- |
||||||||||||||||
диатом K2 контролируется концентрацией конечного продукта |
||||||||||||||||
P и |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
~ |
|
~ |
|
o |
|
o |
|
|
|
|
|
|
|
|
|
ε K |
|
R |
μK |
− μK |
|
|
|||||
|
|
|
vΣ ≈ |
2 |
|
o |
|
|
|
2 |
|
|
|
|
||
|
|
|
|
~ |
|
exp |
|
RT |
|
. |
|
|
||||
|
|
|
|
|
|
P |
|
|
|
|
|
|
|
|||
Кажущаяся энергия активации в этом случае дается выражением
81

|
E |
a Σ |
≈ |
H≠o |
− |
Ho |
+ |
Ho |
− |
Ho |
+ RT = |
|
|
|
|
|
f K1,K2 |
f R |
|
f P |
|
f K2 |
|
|
|
||
= ( |
H≠o |
− |
|
Ho +RT) |
−( |
Ho |
− |
Ho ) + ( |
Ho |
− |
Ho ) ≡ |
||
|
f K1,K2 |
|
f K1 |
|
|
f K2 |
|
f K1 |
f P |
|
f R |
||
|
|
|
|
≡ E |
aK1,K2 |
− |
Ho |
+ |
|
Ho . |
|
|
|
|
|
|
|
|
|
f K1,K2 |
|
r Σ |
|
|
|
||
Это выражение можно интерпретировать как сумму энер-
гий активации EaK1,K 2 |
скорость-лимитирующего преобразова- |
|||
ния интермедиата K1 в K2 и стандартной энтальпии полной |
||||
реакции |
r |
Ho минус стандартную энтальпию Ho |
преобра- |
|
|
Σ |
K1,K 2 |
|
|
зования интермедиата K1 в K2 (см. рис. 1.8, г). |
|
|||
|
|
a |
б |
|
в |
г |
Рис. 1.8. Графическая интерпретация кажущейся энергии активации Еа Σ для схемы с двумя каталитическими интермедиатами. Пояснения даны в тексте
82

Пример 3. Каталитическая реакция с большим числом интермедиатов.
Выявим скорость-определяющие параметры для каталитической брутто-реакции
R  Р
Р
с более сложным механизмом, который описывается схемой
R + K  {Ki}
{Ki}  P + K, (1.61)
P + K, (1.61)
где K – свободная форма активного центра, а {Ki} – совокупность термализованных каталитических интермедиатов Ki (i = 1, …, Q), претерпевающих произвольную совокупность мономолекулярных превращений.
Для схемы (1.61), скорость стационарной реакции опреде-
ляется выражением |
|
|
|
~ ~ ~ |
~ ~ ~ |
, |
(1.62) |
vΣ = εэфф(R −P)K |
= εэфф(R −P)Ko |
где параметр εэфф является алгебраической комбинацией па-
раметров εij, в то время как |
|
|
|
RT) |
|
|
|
||
~ |
|
|
o |
|
|
|
|||
Ko = exp(μK |
|
|
|
||||||
и знаменатель соответствует выражению |
|
||||||||
=1+ |
θK1 |
+ |
θK 2 |
|
+...+ |
θKQ |
|
, |
|
θ |
θ |
θ |
|||||||
|
|
|
|
||||||
|
K |
|
K |
|
K |
|
|||
которое является простой алгебраической функцией величин
~ ~ |
|
o |
o |
|
|
|
μK −μKi |
|
|||
εij, R , P |
и exp |
|
|
|
. |
RT |
|
||||
|
|
|
|
||
|
|
|
|
|
|
Появление знаменателя в выражении (1.62), как и |
ранее, |
является следствием массобаланса различных форм |
актив- |
ного центра:
Q |
|
[K] + ∑[Ki ] = [K]o , |
(1.63) |
i=1
где [K]o является полной концентрацией активных центров.
83

Если все формы активного центра являются термодинамически идеальными (т. е. μKi = μKo i + RTln[Ki ] ), отсюда следует
~ |
|
o |
RT) |
Q ~ |
|
o o |
|
K |
exp(− μK |
+ ∑Ki exp[(μK − μKi ) RT]= |
(1.64) |
||||
|
|
|
~ |
i=1 |
|
RT) |
|
|
|
|
|
o |
|
||
или |
|
|
= Ko exp(− μK |
|
|||
|
Q |
|
|
|
|
|
|
|
~ |
~ |
o |
o |
~ |
(1.65) |
|
|
K |
+ ∑Ki exp((μK |
− μKi |
) RT)= Ko . |
|||
i=1
Для нахождения скорость-контролирующих параметров схемы (1.61) можно действовать так же, как в предыдущих случаях. Например, при малой степени заполнения активного центра интермедиатами вновь не возникает зависимости общей скорости процесса vΣ от стандартных параметров этих интермедиатов.
Достаточно общий анализ ситуации с большой степенью заполнения активного центра интермедиатами легче всего осуществить в случае, когда общая реакция происходит в результате серии последовательных превращений соответствующих термализованных интермедиатов Ki (i = 1, …, n):
R + K  К1
К1  …
… 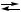 Кn
Кn  K + P.
K + P.
Превращения интермедиатов можно разделить на две категории: превращения, предшествующие скорость-ли- митирующей стадии «L, L + 1» («lim») с наибольшим перепадом химических потенциалов, и превращения, которые осуществляются после этой стадии.
В первом приближении для стадий, предшествующих ско- рость-лимитирующей стадии, можно считать
μR + μK ≈ μK1 ≈ μK 2 ≈...≈ μKL ,
и, таким образом,
~ ~ ~ |
~ |
|
~ |
R K ≈ K1 |
≈ K |
2 |
≈...≈ KL . |
Для стадий после скорость-лимитирующей можно грубо предположить
84
~ ~ |
~ |
~ |
~ ~ |
R K |
>> KL+1 |
> KL+2 |
>...> P K . |
В такой ситуации при малой степени заполнения активных центров интермедиатами
|
|
|
|
|
|
|
~ |
~ |
|
|
|
|
|
|
|
|
|
vΣ ≈ εlimKo |
R |
|
|
|
|
и |
|
|
|
|
|
|
|
|
|
|
|
|
E |
a Σ |
≈ |
f |
H≠o − |
Ho − |
f |
Ho |
+RT ≡ |
|
|
|
|
|
|
lim |
f K |
R |
|
|
|||
≡ ( |
fHlim≠o − fHLo +RT)+ |
( |
fHLo − |
fHKo |
− |
fHRo )≡ Ealim + rH(RKo |
→L) . |
||||
Видно, что кажущаяся энергия активации, как и ранее, равна энергии активации Ea lim скорость-лимитирующей стадии
плюс полная стандартная энтальпия rH(oRK→L) всех предше-
ствующих стадий.
В ситуации, когда поверхность покрыта преимущественно интермедиатом Ki, который образовался до скоростьлимитирующей стадии,
|
|
|
|
|
|
~ |
|
|
|
o |
|
o |
|
||
|
|
|
|
|
|
|
|
|
μKi |
− μK |
|
||||
|
v |
|
≈ ε K |
|
exp |
|
|
|
|
|
|
||||
|
|
|
|
RT |
|
|
|||||||||
|
|
|
Σ |
|
lim |
|
o |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
и |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
E |
a Σ |
≈ |
H≠o |
− |
f |
Ho |
+ RT ≡ |
|
||||||
|
|
|
r |
lim |
|
|
Ki |
|
|
|
|
||||
≡ ( |
fHlim≠o − fHLo + RT)+ |
( |
fHLo − |
fHKo i |
)≡ Ealim + rH(Ko |
i →L). |
|||||||||
Это означает, что в ситуации, когда поверхность покрыта преимущественно интермедиатом Ki, который образовался до скорость-лимитирующей стадии, кажущаяся энергия активации равна энергии активации скорость-лимитирующей стадии плюс стандартная энтальпия образования интермедиата KL из этого интермедиата Ki.
В случае, когда поверхность покрыта преимущественно интермедиатом Ki, который образовался после скоростьлимитирующей стадии, ситуация оказывается более сложной для анализа и необходимо отдельно рассматривать случаи,
85

когда концентрация Ki определяется концентрацией либо исходного реагента R, либо конечного продукта превращения P.
При этом может оказаться, что скорость-определяющая стадия не совпадает со скорость-лимитирующей.
Пример 4. Каталитическая реакция с последовательным образованием двух конечных продуктов.
Найдем выражение для стационарной скорости каталитической брутто-реакции
R → H + P,
которая осуществляется по механизму
R + K |
|
1 |
К1, |
|||||||||
|
|
|
||||||||||
|
||||||||||||
К1 |
2 |
|
|
|
К2 + H, |
|||||||
|
|
|
|
|
|
|
|
|
||||
|
3 |
|
|
|
|
|||||||
К2 |
|
|
|
|
|
P + K, |
||||||
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
||||
где R – исходный реагент; Н и Р – конечные продукты стехиометрического каталитического брутто-процесса; К – свободная форма активного центра катализатора; К1 и К2 – каталитические интермедиаты, образующиеся на этом центре.
Скорость брутто-процесса можно определить как
vΣ = |
d[P] |
~ |
~ ~ |
dt |
= ε3 (K2 |
−P K) . |
|
|
|
|
В условиях стационарности концентрации интермедиатов К1 и К2
d[X] |
|
~ |
|
~ |
|
~ |
~ |
~ |
~ |
dt |
= ε1(R |
K |
−K1) |
− ε2 (K1 |
−K2 |
H) = 0 , |
|||
|
|
|
|
|
|
|
|
|
|
d[Y] |
= ε2 |
~ |
|
|
~ |
~ |
~ |
~ |
~ |
dt |
(K1 |
−K |
2 H) − ε3 (K |
2 −P K) = 0 . |
|||||
|
|
|
|
|
|
|
|
|
|
~
Следовательно, стационарное значение K1 равно
~ |
|
~ ~ |
~ |
~ |
|
= |
ε1R K |
+ ε2K2 |
H |
. |
|
K1 |
ε1 |
+ ε2 |
|
||
|
|
|
|
Подставляем это значение во второе уравнение:
86

|
|
~ ~ |
+ ε |
~ |
~ |
~ |
~ |
~ |
|
~ |
|
|
|
|
ε |
ε R K |
K |
H |
− ε K |
H − ε |
K |
|
H |
|
|
−P K) = 0 |
|||
|
1 |
2 |
2 |
|
1 2 |
2 |
|
2 |
|
− ε (K |
|
|||
|
2 |
|
|
|
3 |
~ |
2 |
~ ~ |
||||||
|
|
|
|
ε1 + ε2 |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Обозначив |
ε1ε2 |
|
|
= εэ , |
||
ε1 + ε2 |
||||||
|
|
|
||||
|
~ |
~ |
~ |
|
||
|
εэ(R |
K |
−K |
2 |
||
получим |
|
|
~ |
~ |
~ ~ |
H) − ε3 |
(K2 |
−P K) = 0 . |
Отсюда стационарное значение напора интермедиата К2 равно
|
|
|
~ |
|
~ |
~ |
~ ~ |
|
|
|
|
|
|
|
|
|
= |
εэR K + ε3P K |
|
|
|
|
|
|
|||
|
|
|
K2 |
|
~ |
|
|
|
|
|
|
|
|
|
|
|
|
|
εэH + ε3 |
|
|
|
|
|
|
||
Таким образом, |
|
|
|
|
|
|
|
|
|
|
|||
|
~ ~ |
|
~ ~ |
|
~ ~~ |
~ ~ |
ε |
ε |
~ ~ ~ ~ |
|
|
||
ε R K |
+ ε P K − ε |
HPK |
− ε P K |
K(R − H P) |
|
|
|||||||
|
э |
3 |
~ |
э |
3 |
|
3 |
э |
~ |
|
.(1.66) |
||
vΣ = ε3 |
|
|
|
|
|
= |
|
|
|
||||
|
|
|
εэH + ε3 |
|
|
|
εэH + ε3 |
|
|
||||
Из этого выражения следует, что при |
|
~ |
скорость- |
||||||||||
εэH >> ε3 |
|||||||||||||
лимитирующей стадией |
является |
стадия |
3, при |
~ |
|
– |
|||||||
εэH << ε3 |
|||||||||||||
стадии 1 или 2 с наименьшим значением εi .
Выразим стационарные напоры и концентрации интерме- |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
~ |
диатов через стационарное значение напора интермедиата K . |
|||||||||||||||||||||
|
|
|
|
~ ~ |
|
~ |
|
|
~ |
~ |
|
~ ~ |
|
|
|
|
|
||||
|
|
|
|
|
εэR |
K |
+ ε3P |
K |
|
|
|
|
|||||||||
|
~ |
|
|
ε1R K + ε2H |
|
|
|
~ |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
εэH + ε3 |
|
|
|
|
|
|
||||
|
K1 = |
|
|
|
|
|
|
|
|
|
|
|
|
|
= |
|
|
|
|||
|
~ |
~ |
|
|
ε1 |
+ ε2 |
~ |
|
~ |
|
|
|
|||||||||
|
~ |
|
|
|
|
|
|
|
|
~ |
|
|
|
|
|
|
|||||
|
|
ε1R(εэH + ε3 ) |
+ ε2H(εэR + ε3P) |
= |
|
|
|||||||||||||||
|
= K |
|
(ε1 |
|
|
|
|
|
~ |
|
|
|
|
|
(1.67) |
||||||
|
|
|
|
|
+ ε2 )(εэH + ε3 ) |
~ ~ |
|
|
|
||||||||||||
|
~ |
|
|
|
|
~ |
|
|
|
|
~ |
|
|
|
|
|
|
||||
|
|
[(ε1 + ε2 )εэH + ε1ε3 |
]R |
+ ε2ε3H P |
|
|
|
||||||||||||||
|
= K |
|
|
|
|
|
|
|
|
|
~ |
|
|
|
|
|
= |
|
|
||
|
|
|
|
|
(ε1 + ε2 )(εэH + ε3 ) |
|
|
|
|
|
|
||||||||||
|
~ |
|
|
ε ε |
~ |
|
|
ε |
ε |
|
~ ~ |
|
~ |
|
|
~ |
|
||||
~ |
|
|
|
|
3 |
|
|
|
|
||||||||||||
= K |
εэH + |
|
|
1 3 |
R + |
|
|
2 |
|
|
P |
H |
|
(εэH + ε3 ) ≡ K |
α. |
||||||
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
ε1 |
+ ε2 |
|
|
|
|
|
|
|
|
||||
|
|
|
ε1 + ε2 |
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
87

Условие массобаланса по каталитическим интермедиатам для рассматриваемой брутто-реакции записывается в виде
~
Ko
где θК
~ |
|
|
~ |
|
|
~ |
|
|
|
|
|
|
|
|
|
|
|
|
~ |
~ |
|
|
|||
+ λ |
|
+ λ |
|
~ |
|
+ λ α + λ |
|
|
εэR + ε3P |
|
|
≡ |
|||||||||||||
= K |
|
K |
|
K |
|
= K 1 |
|
ε H + ε |
|
|
|||||||||||||||
|
|
K1 |
1 |
|
K2 |
|
2 |
|
|
|
|
|
K1 |
|
|
|
K2 |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
~ |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
э |
3 |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
θ |
K1 |
|
θ |
K2 |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
~ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
≡ K |
|
1+ |
|
|
|
|
+ |
|
|
|
, |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
θ |
|
θ |
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
K |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
K |
|
|
|
|
|
|
|
|
|
|
|
||
– доля свободных активных центров, а θKi |
– степень |
||||||||||||||||||||||||
заполнения |
активного |
центра |
|
интермедиатом |
Кi, |
||||||||
|
|
μo |
− μo |
|
|
|
|
|
μo |
− μo |
|
|
|
λK1 |
= exp |
K |
K1 |
|
, |
λK2 |
= exp |
K |
|
K2 |
. |
|
|
|
RT |
|
RT |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Анализ выражения (1.66) можно провести, как и ранее, для различных случаев с заполнением активного центра интермедиатами.
Ниже рассмотрены некоторые конкретные случаи. Случай а. Пусть доминирующей формой активного центра
является форма К2, т. е. θK2 |
≈ 1 или, что то же, θK2 θK >> 1. |
|||||||||||||||
При этом |
|
|
|
|
|
|
|
|
~ |
|
|
|
~ |
|
||
|
θK |
|
|
|
|
|
|
|
|
+ ε |
|
|
||||
|
2 |
|
|
|
|
|
ε R |
|
P |
|||||||
|
|
|
= λ |
|
|
|
|
|
э |
|
|
3 |
|
|
||
|
θK |
|
K2 |
|
|
|
ε |
~ |
|
|
|
|
|
|||
|
|
|
|
|
|
H + ε |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
э |
|
|
|
3 |
||
и |
|
|
|
|
|
|
~ |
|
|
|
|
|
|
|||
~ |
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
Ko |
|
|
|
|
|
. |
|||
|
K |
≈ |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
ε |
|
|
~ |
+ ε |
~ |
|
||||||
|
|
|
|
|
|
э |
R |
P |
|
|||||||
|
|
|
|
λK2 |
|
|
~ |
3 |
|
|
|
|||||
|
|
|
|
ε |
|
|
||||||||||
|
|
|
|
|
|
|
H + ε |
3 |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
э |
|
|
|
|
|
||
Тогда
|
ε |
|
~ |
|
~ |
~ ~ |
~ |
) |
|
ε |
|
~ |
|
3 |
ε K |
|
(R |
−H P)(ε |
H + ε |
|
|
ε K |
|||
vΣ ≈ |
|
э~ o |
|
~э |
~3 |
|
= |
|
3 |
э o |
||
|
|
|
|
|
||||||||
|
(εэH |
+ ε3 )λK2 (εэR + ε3P) |
|
|
|
λK2 (ε |
||||||
~ |
~ ~ |
(R −H P) |
|
~ |
~ . |
эR |
+ ε3P) |
88

При контроле заполнения активного |
центра |
катализатора |
продуктом брутто-реакции Р (т. е. при |
~ |
~ |
εэR << ε3P , что соот- |
||
ветствует контролю заполнения активного центра интерме-
диатом К2 |
посредством стадии 3) |
|
~ |
~ ~ ~ |
|
|
||||
|
|
~ |
~ |
~ ~ |
|
|
|
|||
|
vΣ ≈ |
ε3εэKo (R −H P) |
= |
εэKo (R −H P) |
. |
|||||
|
λ |
ε |
~ |
λK |
|
~ |
|
|||
|
|
P |
|
2 |
P |
|
||||
|
|
|
K2 |
3 |
|
|
|
|
|
|
В случае, когда каталитическая брутто-реакция осуществ-
ляется кинетически необратимо «слева направо» и поэтому
~ >> ~ ~ R H P ,
ε~ ~
vΣ ≈ λЭKo R~
K2 P
Случай б. Пусть доминирующей формой активного центра является интермедиат К1, т. е. θK1 ≈ 1 или θK1  θK >> 1 и кон-
θK >> 1 и кон-
троль степени заполнения активного центра также обусловлен продуктом брутто-реакции Р, т. е.
|
~ |
ε ε |
|
|
~ |
ε |
ε |
3 |
~ ~ |
|
|
1 3 |
|
|
2 |
|
|||||
|
εэH + |
|
|
R << |
|
|
P H |
|||
ε + ε |
|
ε + ε |
2 |
|||||||
|
|
1 |
2 |
|
1 |
|
|
|
||
(см. выражение (1.67)). |
|
|
|
|
|
|
|
|
|
|
||||
Тогда |
|
|
~ |
|
~ |
|
~ ~ |
|
~ ~ |
~ ~ |
|
|||
|
|
|
|
|
|
|
||||||||
v |
|
≈ ε3εэKo |
(R |
−P H) = ε |
Ko (R |
−P H) |
. |
|||||||
Σ |
|
|
|
|
~ ~ |
|||||||||
|
|
|
ε |
ε |
|
|
~ ~ |
1 |
λ |
|
|
|||
|
|
|
3 |
|
|
|
H P |
|||||||
|
|
λK1 |
|
|
2 |
|
|
|
|
|
K1 |
|
|
|
|
|
|
ε1 |
+ ε2 |
P H |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|||||
Очевидно, что при этом скорость-определяющей стадией всегда является стадия 1, независимо от того, какая стадия является скорость-лимитирующей.
Пример 5. Рассмотрим несколько еще более сложную каталитическую брутто-реакцию
2 R → H + P,
которая осуществляется по механизму
R + K  1 К1,
1 К1,
89

К1 |
|
2 |
|
|
К2 + H, |
||||||||
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|||||||
К2 |
+ R |
|
|
|
3 |
К3, |
|||||||
|
|
|
|
|
|||||||||
|
|
|
|
||||||||||
К3 |
|
4 |
|
|
|
P + K, |
|||||||
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
||||
где R – исходный реагент; Н и Р – конечные продукты; К1, К2; К3 – каталитические интермедиаты.
Стационарная скорость каталитического брутто-процесса выражается соотношением
vΣ = |
d[P] |
~ |
~ ~ |
dt |
= ε4 (K3 |
−P K) . |
|
|
|
|
В случае стационарности по концентраций интермедиатов
|
d[K1 |
] |
|
~ ~ ~ |
− ε2 |
|
~ ~ ~ |
= 0, |
||||||
|
dt |
|
|
= ε1(R |
K −K1) |
(K1 −K |
2 H) |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
d[K2 ] |
|
|
|
~ |
|
~ |
~ |
|
|
~ |
~ |
~ |
|
|
|
|
|
|
= ε2 (K1 |
|
−K |
2 H) − ε3 |
(K2 |
R −K3 ) = 0, |
|||||
|
dt |
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
d[K3 ] |
|
~ |
|
~ |
~ |
|
|
~ |
|
~ ~ |
|
||
|
|
|
|
= ε3 |
(K2 |
R |
−K3 ) − ε |
4 (K |
3 −P K) = 0. |
|||||
|
dt |
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Из первого равенства следует
~ |
|
~ ~ |
~ |
~ |
|
= |
ε1R K |
+ ε2K2 |
H |
. |
|
K1 |
ε1 |
+ ε2 |
|
||
|
|
|
|
~
Используя это значение K1 , находим стационарное значе-
~
ние K2 :
|
|
~ ~ |
~ |
~ |
− ε |
~ |
|
~ |
− ε |
~ |
|
~ |
|
|
|
|
|
|
ε |
ε R K |
+ ε K |
H |
K |
|
H |
K |
|
H |
|
|
R −K ) = 0 , |
||||||
|
1 |
2 2 |
|
1 |
2 |
|
|
2 |
2 |
|
− ε (K |
|||||||
|
2 |
|
|
|
|
|
|
~ |
~ ~ |
|
||||||||
|
|
|
ε1 |
+ ε2 |
|
|
|
|
|
|
|
3 3 |
|
3 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
~ |
~ |
~ |
|
|
~ |
|
~ |
|
~ |
|
~ |
|
|
|
|
|
|
|
εэ(R K |
−K2 |
H) − ε3 |
(K |
2 R |
−K3 ) = 0 , |
|
|||||||||
|
|
|
|
|
~ |
|
|
|
~ |
~ |
|
|
~ |
|
|
|
|
|
|
|
|
|
|
= |
|
εэR K |
+ ε3K3 |
|
. |
|
|
|
|||||
|
|
|
|
|
K2 |
|
|
~ |
|
|
~ |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
εэH + ε3R |
|
|
|
|
|
||||
~
Подставляем это значение K2 в третье равенство и получаем
90
