
КФ 2
.pdf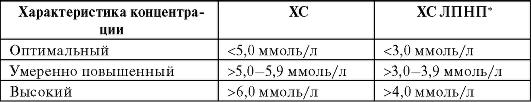
Обозначения: * - концентрацию ХС ЛПНП рассчитывают по формуле Фридвальда (1972) при условии, что концентрация ТГ в крови не превышает 4,5 ммоль/л (400 мг/дл). ХС ЛПНП (ммоль/л) = ХС - ХС ЛПВП - (ТГ: 2,2). ХС ЛПНП (мг/дл) = ХС - ХС ЛПВП - (ТГ: 5,0).
Наиболее частые причины вторичных ДЛП:
-СД II типа;
-ХПН;
-нефротический синдром;
-гипотиреоз;
-гиперурикемия;
-ожирение;
-избыточное употребление алкоголя;
-холестаз;
-беременность;
-лекарственные препараты (неселективные β-адреноблокаторы, эстрогены, глюкокортикоиды, анаболические стероиды, циклоспорин).
Диагностика гиперлипопротеидемий и методы обследования пациентов
Большую часть ДЛП все еще диагностируют случайно или при появлении сосудистых осложнений. ДЛП могут протекать совершенно бессимптомно; характерными, но не во всех случаях, считают следующие анамнестические и клинические данные (табл. 12-5).
Количественная характеристика различных типов ГЛП представлена в табл. 12-6.
Необходима также оценка липопротеидного спектра крови, основанная на расчете отношения атерогенных классов ЛП (ЛПНП и ЛПОНП) к неатерогенным ЛПВП.
Наиболее простым считают определение концентрации общего ХС и ХС ЛПВП, что делает возможным расчет индекса атерогенности (ИА): ИА = (ХС - ХС ЛПВП)/ХС ЛПВП.
Таблица 12-5. Алгоритм диагностики дислипопротеидемий
Еще больше книг только на канале Telegram "Медицинские книги" https://t.me/medknigi

Таблица 12-6. Количественная характеристика ГЛП
Величина этого отношения отражает благоприятное и неблагоприятное сочетание указанных классов ЛП для прогноза риска развития атеросклероза и ИБС.
Клинико-фармакологические подходы к лечению гиперлипопротеидемий
На первых этапах лечения атерогенных ДЛП наибольшее внимание необходимо уделить правильному питанию, но его положительный эффект возможен не ранее чем через 2-3 мес. При неэффективности такого метода к лечению добавляют гиполипидемические препараты.
Основная цель лечения атерогенных ДЛП - достижение оптимальных или «целевых» значений липидных параметров, которые были приняты секцией атеросклероза Всероссийского научного общества кардиологов (2008) в соответствии с Европейскими рекомендациями по профилактике сердечно-сосудистых заболеваний.
Еще больше книг только на канале Telegram "Медицинские книги" https://t.me/medknigi

Классификация гиполипидемических препаратов
•Статины (ингибиторы синтеза ХС).
•Фибраты.
•Никотиновая кислота.
•Ингибиторы абсорбции ХС.
•Препараты, способствующие экскреции и катаболизму ХС.
Контроль эффективности назначения
гиполипидемических препаратов
Объединенный комитет Европейского кардиологического общества, Европейского общества по атеросклерозу и Европейского общества по АГ, согласно III пересмотру Всероссийского научного общества кардиологов, предложили следующие целевые значения концентрации липидов, которых следует достигнуть при проведении первичной и вторичной профилактики атеросклероза: при первичной профилактике целевая концентрация ХС составляет <5 ммоль/л (195 мг/дл), ХС ЛПНП - <3 ммоль/л (100 мг/дл), при вторичной профилактике целевая концентрация ХС составляет <4,5 ммоль/л (175 мг/дл), ХС ЛПНП <2,5 ммоль/л (100 мг/дл).
12.2. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ СТАТИНОВ
Наиболее высокой гипохолестеринемической активностью обладают статины. Первые из них были получены из плесневых культур (ловастатин), полусинтетическим (симвастатин, правастатин) и синтетическим путем (флувастатин, аторвастатин, розувастатин).
Фармакокинетика. Ловастатин и симвастатин - пролекарства; в печени из них образуются активными метаболитами соответствующие β-гидроксикислоты. Для правастатина и флувастатина дополнительной активации не требуется. Период полувыведения стати-нов из организма не превышает 2 ч, за исключением аторвастатина и розувастатина, период полувыведения которых составляет более 12 ч, что объясняет как их более высокую активность по снижению концентрации ХС и ХС ЛПНП при одинаковых дозах, так и необходимость регулярного контроля их безопасности. С учетом этих различий можно выбирать препарат и подбирать его дозу в зависимости от исходной концентрации липидов, а также сопутствующей патологии. Фармакокинетические свойства статинов приведены в табл. 12-7.
Таблица 12-7. Фармакокинетические свойства статинов
Еще больше книг только на канале Telegram "Медицинские книги" https://t.me/medknigi

Фармакодинамика. Гипохолестеринемический эффект при приеме статинов проявляется сравнительно быстро. Они снижают синтез ХС и ЛПОНП в печени благодаря угнетению активности фермента З-гидрокси-3-метилглутарил- коэнзим-А редуктазы - ключевого фермента синтеза ХС на ранней стадии процесса. В результате концентрация ХС в клетках печени снижается и на некоторое время (несколько часов) в них увеличивается синтез ХС, что сопровождается более длительным (несколько суток) увеличением количества специфических рецепторов на мембране, которые связывают ХС ЛПНП и снижают его концентрацию в крови. Это способствует компенсаторному увеличению липопротеиновых рецепторов печени, что приводит к уменьшению концентрации ЛПНП, ЛПОНП и аполипопро-теина в плазме из-за их печеночного катаболизма. В меньшей степени в крови снижается концентрация ТГ, а ЛПВП - повышается. Наряду с гиполипидемическим действием, статины обладают плейотропными (нелипидными) эффектами, главные из которых - улучшение функционирования эндотелия, подавление воспалительной активности в сосудистой стенке: уменьшение процессов окисления ЛПНП, истощение и физикохимическая стабилизация липидного ядра атероскле-ротической бляшки, ингибирование тромбообразования, уменьшение тромбогенного ответа, противовоспалительный эффект.
Большое значение имеет способность статинов при длительном приеме вызывать регресс атеросклеротической бляшки. Это было определено в нескольких исследованиях результатов назначения ста-тинов по данным селективной коронарографии и внутрисосудистого УЗИ. Обычно статины назначают 1 раз в сутки вечером. Это обусловлено тем, что синтез ХС наиболее интенсивно происходит в ночное время. При назначении статинов в высокой дозе ее можно разделить на два приема (утро и вечер).
Лечение статинами должно быть многолетним, практически пожизненным, так как при их отмене клинический эффект быстро исчезает. Препараты безопасны, в том числе в отношении онкогенности.
Назначение статинов в течение 5 лет и более ведет к снижению частоты осложнений ИБС и других сердечнососудистых заболеваний на 25-40%. Максимальный гиполипидемический эффект при назначении статинов проявляется через 2-3 нед после начала приема.
Плейотропные эффекты
Для оригинальных препаратов описаны антиатерогенные плейо-тропные эффекты (не связанные с основным) (табл.
12-8).
Таблица 12-8. Плейотропные эффекты статинов
НЛР. Обычно пациенты хорошо переносят прием статинов. У 1-2% больных увеличивается активность печеночных трансаминаз без нарушения функций печени; у 10-11% - мышечной креатинкиназы (не более чем в 3-5 раз), что может сопровождаться миалгией, редко - миопати-ей (у 0,1-0,2% больных) и повреждением мышечной ткани (рабдомио-лиз). Кроме того, возможны диспепсические расстройства (запор, боли в животе, тошнота), головная боль, кожная сыпь. Рабдомиолиз (распад поперечно-полосатой мышечной ткани) проявляется, если не удалось вовремя диагностировать миопатию и лечение статином, вызвавшим миопатию, продолжалось. Рабдомиолиз - тяжелое, жизнеугрожающее осложнение приема статинов, проявляющееся миалгией, миопатией, мышечной слабостью. Оно сопровождается повышением активности КФК более 10 000 Ед и увеличением концентрации креатинина. Пациентам с рабдомиолизом необходима срочная госпитализация. Для лечения рабдомиолиза применяют экстракорпоральные методы очистки крови - плазмаферез и гемодиализ. Рабдомиолиз чаще наблюдается при одновременном назначении статинов с фибратами, цитостатиками, макролидами. Причина более частого возникновения осложнений при таком сочетании обусловлена тем, что метаболизм ловастатина, симвастатина, аторвастатина происходит через изоформы 3А4 цитохрома Р-450. Конкурентное связывание фермента приводит к увеличению концентрации статинов в плазме крови и к проявлению их миотоксических свойств.
По данным завершенных клинических исследований, статины - одни из самых безопасных классов ЛС. Прием статинов крайне редко может сопровождаться болями в животе, метеоризмом, запорами. Повышение активности АЛТ и ACT в сыворотке крови наблюдается у 1-5% больных. Если активность хотя бы одного из этих ферментов
Еще больше книг только на канале Telegram "Медицинские книги" https://t.me/medknigi

превышает в 3 раза верхние пределы лабораторной нормы, прием ста-тина нужно прекратить. При меньшем повышении достаточно ограничиться снижением дозы препарата и, если активность ферментов не возвращается к норме, переходят на лечение другим статином.
Статины противопоказаны при активном гепатите и циррозе печени, увеличении активности трансаминаз, беременности и кормлении грудью, индивидуальной непереносимости.
Взаимодействие статинов с другими ЛС. Один из путей печеночной биотрансформации большинства статинов осуществляется с помощью микросомального изофермента Р-450 CYP3A4. 50-80% флува-статина подвергается биотрансформации с помощью изофермента CYP2C9. Конкуренция с другими ЛС на уровне ферментативных реакций может привести к увеличению концентрации статинов в крови и усилению побочных реакций.
Лекарственные взаимодействия: симвастатин, аторвастатин, лова-статин, флувастатин в сочетании с фибратами, а также циклоспорином, эритромицином, иммунодепрессантами, никотиновой кислотой могут вызывать острый некроз скелетных мышц и острую почечную недостаточность (ОПН). Статины усиливают эффекты варфарина и дигоксина, что обусловливает необходимость более строгого контроля назначения этих препаратов, для розувастатина характерно отсутствие клинически значимых взаимодействий с фенофибратом, дигоксином, препаратами, подвергающимися биотрансформации с помощью системы цитохрома Р-450 (3А4), такими, как флуконазол и кетоконазол. Ранитидин и омепразол могут повысить биодоступность статинов. Умеренно значимые взаимодействия отмечаются с антацидами (уменьшение действия розувастатина на 50%), эритромицин незначительно уменьшает концентрацию розувастатина в плазме. Клинически значимые взаимодействия выявлены с гем-фиброзилом - увеличение концентрации розувастатина в плазме в 2 раза. Циклоспорин в 7 раз увеличивает концентрацию розувастатина в плазме, а при сочетании с варфарином выявлено увеличение международного нормализованного отношения (МНО).
12.3. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ ФИБРАТОВ
Фибраты - первые эффективные гипохолестеринемические средства, которые начали применять для лечения атеросклероза. В настоящее время выделяют два поколения препаратов: к первому относят
клофибрат® (в настоящее время не применяется), а ко второму - все остальные фибраты: фенофибрат, безафибрат®, ципрофибрат, гем-фиброзил.
Фармакокинетика. Фармакокинетические свойства фибратов представлены в табл. 12-9.
Таблица 12-9. Фармакокинетические свойства фибратов
Фармакодинамика. Механизм гипохолестеринемического действия фибратов заключается в угнетении синтеза в печени и поступления в кровь ЛПОНП, увеличении числа липопротеиновых рецепторов и стимуляции эндоцитоза ЛПНП печенью, ингибировании синтеза ХС на стадии образования мевалоновой кислоты (активность процесса невысока), повышение активности липопротеин-липазы эндотелия. В результате в крови снижается концентрация ЛПОНП и ЛПНП. При длительном приеме фибратов включаются дополнительные механизмы их антиатеросклеротического действия: увеличивается концентрация ЛПВП в плазме, уплотняются атеросклеротические бляшки в стенке сосудов, что приводит к увеличению их просвета. Положительной стороной действия фибратов считают также улучшение реологических параметров крови благодаря антиагрегантной активности. Препараты этой группы назначают длительно (до нескольких лет). Фибраты - агонисты подкласса ядерных рецепторов (активируемых пролифератором пероксисом - PPARa), содержащих набор ферментов, активация которых ведет к интенсификации процессов в ядре клетки, регулирующих синтез ряда функционально важных белков системы ЛП. Реализация этих механизмов приводит к активации постгепариновой и печеночной липопротеидлипаз, ферментов, катализирующих гидролиз ТГ в хиломикронах, ЛПОНП и ЛПНП, что ведет к снижению их концентрации в сыворотке крови. Прием фибратов сопровождается достоверным увеличением ХС ЛПВП из-за усиления синтеза
их основных апопротеинов AI и А11. Режим дозирования фибратов представлен в табл. 12-10.
Таблица 12-10. Режим дозирования фибратов
Еще больше книг только на канале Telegram "Медицинские книги" https://t.me/medknigi

Фибраты лучше назначать с утренним приемом пищи из-за того, что синтез ЛП, богатых ТГ, более интенсивно происходит в утренние часы.
НЛР отмечают у 2-15% больных, наиболее часто: диспепсические расстройства (тошнота, диарея) и кожные высыпания; значительно реже встречаются сонливость, лейкопения, холестаз, миозиты, образование камней в желчном пузыре.
Взаимодействие фибратов с другими ЛС. При сочетании фибратов со статинами повышается риск развития миопатии. При необходимости такого сочетания нужно контролировать активность печеночных ферментов и КФК не реже 1 раза в месяц.
Согласно ежегодному отчету FDA по мониторингу безопасности сочетания фибратов со статинами, наименьшей опасностью развития НЛР обладает фенофибрат.
12.4. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ ПРОИЗВОДНЫХ НИКОТИНОВОЙ КИСЛОТЫ
Фармакокинетика. Никотиновая кислота быстро и почти полностью всасывается из ЖКТ, выделяется с мочой в неизмененном виде или в форме метаболитов. В РФ применяют пролонгированный препарат никотиновой кислоты - эндурацин*, в котором активное вещество фиксировано на восковидной матрице, что обеспечивает медленное нарастание концентрации препарата в крови
(табл. 12-11).
Основное показание к назначению никотиновой кислоты - комбинированная ГЛП, а также повышение концентрации ТГ в сочетании с низким ХС ЛПВП.
Таблица 12-11. Режим дозирования никотиновой кислоты
Фармакодинамика. Никотиновая кислота в высоких дозах обладает гиполипидемическим действием, в большей степени снижая концентрацию ТГ, в меньшей - общий ХС и ХС ЛПНП, а также значительно увеличивая концентрацию ХС ЛПВП. Никотиновая кислота снижает синтез ЛПОНП в печени и частично блокирует высвобождение жирных кислот из жировой ткани. Препарат снижает концентрацию в плазме крови всех фракций атерогенных ЛП: в большей степени ЛПОНП, в меньшей - ЛПНП и ЛПВП. Снижение концентрации ТГ начинается с 1-4-х суток приема препарата, а ХС - на 5-7-е сутки. В основе механизма действия никотиновой кислоты лежит угнетение тканевого липолиза: она повышает в клетках активность фосфодиэстеразы, что приводит к снижению внутриклеточной концентрации цАМФ и активности внутриклеточной липазы, как следствие происходит уменьшение транспорта жирных кислот в печени с последующим уменьшением синтеза ТГ и ЛПОНП. Концентрация ЛПВП в крови повышается из-за замедления их катаболизма.
НЛР. В качестве гиполипидемического средства никотиновую кислоту назначают в дозе 2-6 г/сут, обусловливающей выраженные побочные эффекты, сдерживающие ее применение. При приеме никотиновой кислоты характерны гиперемия кожи (синдром воспламенения), зуд, диспепсические расстройства (рвота, диарея), образование язв в желудке, гипергликемия, гиперурикемия, а также отмечается гепатотоксическое действие. При длительном назначении никотиновой кислоты чаще возникают аритмии. Прием этого препарата нередко сопровождается побочными явлениями в виде гиперемии лица и верхней половины туловища с ощущением жара и приливов. Реакция обусловлена высвобождением простагландинов. Эти эффекты никотиновой кислоты можно ослабить постепенным титрованием дозы и назначением ацетилсалициловой кислоты в дозе 250 мг за 30 мин до ее приема. Принимать никотиновую кислоту рекомендуют одновременно с пищей. При лечении эндурацином* указанные кожные реакции возникают реже. Из других побочных явлений возможны боли в животе, очень редко - печеночная недостаточность, которая
проявляется выраженным увеличением активности печеночных ферментов и печеночной комой. Лучшая профилактика этого осложнения - периодический контроль активности АЛТ, ACT в сыворотке крови.
Еще больше книг только на канале Telegram "Медицинские книги" https://t.me/medknigi
Особую осторожность следует соблюдать при сочетании никотиновой кислоты со статинами или фибратами. Противопоказанием к назначению никотиновой кислоты считают подагру. Назначение никотиновой кислоты также не рекомендуют больным СД и МС из-за возможного развития гипергликемии или повышения толерантности к глюкозе.
12.5. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ
ИНГИБИТОРОВ ВСАСЫВАНИЯ ХОЛЕСТЕРИНА
В КИШЕЧНИКЕ
Фармакодинамика. Эзетимиб относится к новому классу гипо-липидемических препаратов, блокирующих абсорбцию ХС в тонкой кишке. Основное место действия эзетимиба и его производного глюкуронида - ворсинчатый эпителий щеточной каймы тонкой кишки. Ингибирование эзетимибом абсорбции ХС (как пищевого, так и в составе желчных кислот) ведет к снижению концентрации ХС в гепатоцитах.
Эзетимиб при монотерапии в стандартной дозе 10 мг/день снижает концентрацию ХС ЛПНП не более чем на 1718%. Он находит все более широкое применение в сочетании с различными статина-ми. При этом эффект по снижению концентрации ХС и ХС ЛПНП очень высок благодаря одновременному ингибированию всасывания ХС в кишечнике и синтеза ХС в печени. Добавление стандартной дозы эзетимиба к лечению статинами соответствует увеличению дозы статина в 3-4 раза. Параметры безопасности сочетания симвастатина с эзетимибом соответствуют таковым для статинов.
НЛР. Эзетимиб хорошо переносится. В редких случаях его прием может сопровождаться болями в спине, артралгией, слабостью, увеличением активности сывороточных трансаминаз. Эзетимиб нельзя назначать (также в сочетании со статинами) больным с увеличением активности печеночных ферментов в 3 раза и при острых заболеваниях печени. Сочетание с циклоспорином не рекомендовано.
12.6. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ ОМЕГА-3-ПОЛИНЕНАСЫЩЕННЫХ ЖИРНЫХ КИСЛОТ
Фармакодинамика. Использование ω-3-полиненасыщенных жирных кислот (ПНЖК) для профилактики развития ИБС основано на многочисленных данных эпидемиологических исследований северных народов (эскимосов Гренландии, жителей побережья Чукотки), рацион которых традиционно включает в себя большое количество океанической рыбы и морских животных, обеспечивая потребление до 13 г/сут длинноце-почечных ω-3-ПНЖК: эйкозопентаеновая (ЭПК) и докозагексаеновая (ДГК) кислота. При этом спектр липидов сыворотки крови отличался от такового жителей европейских народов более низкой концентрацией ТГ, ХС и более высокой концентрацией ХС ЛПВП. ω-3-ПНЖК в дозе 2-4 г/сут длительно применяли только в качестве биологически активных добавок, представляющих собой капсулированный рыбий жир или его экстракты, содержащие не более 30% ЭПК и ДГК. В настоящее время появились лекарственные препараты, содержащие очищенные и концентрированные ω-3-ПНЖК: в частности, одна капсула омакор* содержит 840 мг (84%) длинноцепочечных ЭПК и ДГК.
Одним из первых обнаруженных эффектов ω-3-ПНЖК было уменьшение концентрации ТГ в сыворотке крови, которое проявляется при ежедневном приеме в дозе 2-4 г. Обычно их применяли и применяют для лечения ГЛП IV иУ типа. При наличии ЭПК и ДГК в мембране клеток они оказывают антиаритмогенный эффект с существенным снижением риска внезапной кардиальной смерти. Это связано с проявлениями свойств омакора* по электрической стабилизации кардиомиоцитов и способностью благодаря этому противостоять аритмогенным влияниям. Длительное назначение омакора* в дозе 1 г/сут способствует не только формированию мембранных депо, но и увеличению концентрации свободных ω-3-ПНЖК в плазме. При достижении определенной концентрации свободных ЭПК и ДГК в крови (более 4,5%) в условиях ишемии уже не требуется мобилизация ПНЖК из клеточных мембран.
12.7. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ СЕКВЕСТРАНТОВ ЖЕЛЧНЫХ КИСЛОТ
В настоящее время секвестранты желчных кислот (колестира-мин®) имеют историческое значение как ионообменные смолы, свя-
зывающие в кишечнике желчные кислоты - продукты превращения ХС в печени, которые выводятся из организма, благодаря чему концентрация ХС в сыворотке крови снижается.
12.8. КОМБИНИРОВАННАЯ ГИПОЛИПИДЕМИЧЕ-
СКАЯ ТЕРАПИЯ
Сочетания гиполипидемических препаратов применяют при тяжелой ГЛП или для коррекции липидного спектра. Так, у пациентов с сочетанной гиперхолестеринемией фибраты, нормализуя уровень ТГ и ХС ЛПВП, могут повысить концентрацию ЛПНП. В этом случае рационально сочетание фибратов с никотиновой кислотой или ста-тинами
(табл. 12-12).
Еще больше книг только на канале Telegram "Медицинские книги" https://t.me/medknigi
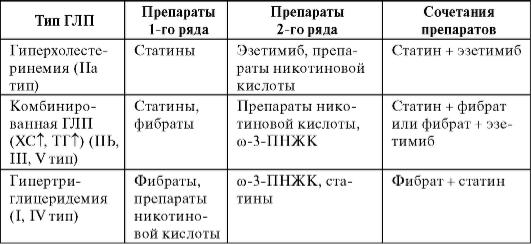
При неэффективности двух гиполипидемических препаратов в рефрактерных к лечению случаях возможно использование сочетания из трех препаратов, например статинов с ингибиторами всасывания ХС и никотиновой кислотой.
Таблица 12-12. Рациональные сочетания гиполипидемических препаратов
Глава 13. НАРУШЕНИЯ СЕРДЕЧНОГО РИТМА
Нарушения ритма сердца могут осложнять течение сердечнососудистых, а также других заболеваний. Их лечение определяется целым рядом факторов. У некоторых пациентов с органическими заболеваниями сердца нарушения ритма могут стать причиной смерти. Аритмии способны существенно снижать качество жизни пациентов с сердечнососудистыми заболеваниями из-за нарушений гемодинамики, психологического дискомфорта и необходимости постоянного приема антиаритмических препаратов.
Нарушения ритма сердца развиваются в результате врожденных или приобретенных нарушений электрических свойств миокардио-цитов.
13.1. ЭЛЕКТРИЧЕСКИЕ СВОЙСТВА КЛЕТОК СЕРДЦА
Электрические свойства клеток миокарда иллюстрирует потенциал действия (ПД). Он формируется в результате функционирования ионных каналов, которые активируются в строго определенной временной последовательности и формируют фазы потенциала действия (рис. 13-1).
Представленная на рисунке форма ПД характерна для клеток проводящей системы сердца и сократительного миокарда предсердий и желудочков. Фазы обозначены на рисунке цифрами. Фаза 0 - быстрая деполяризация клеточной мембраны, обусловленная входящим током ионов натрия через специфические натриевые каналы. Под влиянием электрического потенциала они переходят в активное состояние и способны пропускать ионы натрия. Скорость деполяризации сердечной клетки определяется скоростью деполяризации соседней сердечной клетки. Такая последовательная активация обусловливает скорость распространения импульса в миокарде.
Фаза 1 - короткий начальный период реполяризации, вызванный выходящим из клетки током ионов калия.
Фаза 2 - период медленной реполяризации (плато), обусловленный медленным движением ионов кальция внутрь клетки через кальциевые каналы.
Еще больше книг только на канале Telegram "Медицинские книги" https://t.me/medknigi

к+
Рис. 13-1. Основные ионные токи. Пояснения в тексте
Фаза 3 - период быстрой реполяризации, во время которой ионы калия выходят из клетки. Во время периода реполяризации клетка не может ответить электрическим возбуждением на стимул. Этот феномен известен как рефрактерность, а временной промежуток от окончания фазы деполяризации до окончания фазы реполяриза-ции определяется как рефрактерный период.
Фаза 4 - полная реполяризация или потенциал покоя. Во время этой фазы восстанавливаются исходные ионные концентрации по обе стороны клеточной мембраны. При этом с помощью системы взаимодействующих ионных насосов ионы калия перемещаются обратно внутрь клетки, а ионы натрия и кальция выходят из клетки
В сердце также имеются клетки, способные спонтанно генерировать электрические импульсы, которые активируют клетки проводящей системы и сократительного миокарда предсердий и желудочков. Эти клетки получили название водителей ритма, или пейсмекерных. Их потенциал действия отличается от потенциала действия других клеток миокарда (рис. 13-2). В клетках-водителях ритма СА-узла, в отличие от клеток сократительного миокарда, во время фазы покоя (4) потенциал не остается стабильным. Он постепенно увеличивается до определенного порогового уровня, что вызывает развитие деполяризации. Такое изменение потенциала в фазу покоя, ведущее к появлению спонтанной деполяризации, считают основой способности пейсмекерных клеток
НАРУШЕНИЯ СЕРДЕЧНОГО РИТМА
Рис. 13-2. Потенциал действия клеток водителей ритма. Пояснения в тексте
Еще больше книг только на канале Telegram "Медицинские книги" https://t.me/medknigi

самостоятельно генерировать электрические импульсы. Скорость диа-столических ионных потоков изменяется под влиянием симпатической и парасимпатической нервной системы, что обеспечивает изменение скорости образования импульсов и частоты ритма
С биофизической точки зрения сердце представляет собой сложный электромеханический насос, который должен снабжать кровью органы и ткани не только в покое, но и в условиях стресса или физической нагрузки. Для более оптимальной работы сердца и синхронизации его различных отделов существует управление с помощью электрической системы, представленной синоатриальным (СА) узлом, проводящими предсердными путями, АВузлом, пучком Гиса и волокнами Гиса - Пуркинье. Генерация импульсов в СА-узле обеспечивает последовательную активацию предсердий, затем импульс «задерживается» в атриовентрикулярном узле, что позволяет сократиться предсердиям и обеспечить максимальное заполнение желудочков. Затем импульс распространяется по пучку Гиса, его ветвям и волокнам Гиса - Пуркинье на сократительный миокард, обеспечивая последовательное сокращение различных отделов и слоев миокарда, показывая оптимальный сердечный выброс.
Аритмии, нарушая нормальное распространение электрического импульса по миокарду, снижают эффективность работы сердца.
13.2. МЕХАНИЗМЫ РАЗВИТИЯ АРИТМИЙ
Механизмы развития аритмий можно классифицировать следующим образом:
-аритмии, обусловленные патологическим автоматизмом (автоматические аритмии);
-аритмии, обусловленные механизмом повторного входа возбуждения («re-entry» аритмии);
-аритмии, обусловленные появлением следовых деполяризаций (триггерные аритмии).
Аритмии, обусловленные патологическим автоматизмом, возникают в ситуации, когда под влиянием определенных причин (гипоксии, ишемии, высокого симпатического тонуса, электролитного дисбаланса) клетки, не обладающие свойствами водителей ритма - предсердий, проводящей системы или миокарда желудочков, приобретают свойство спонтанно генерировать импульсы. Обычно это связано с появлением в клетках аномальных ионных токов в фазу покоя с возникновением спонтанной диастолической деполяризации, что приводит к генерации импульсов клетками, не обладающими в нормальных условиях свойствами водителей ритма.
Аритмии, обусловленные механизмом re-entry, считают наиболее распространенными. В упрощенном виде механизм re-entry можно представить следующим образом (рис. 13-3).
Рис. 13-3. Развитие аритмии по механизму повторного входа. Пояснения в тексте
Для развития re-entry аритмий необходимы определенные условия.
• Наличие двух параллельных путей (А и Б), которые соединяются с помощью проводящей ткани с формированием замкнутого электрического контура.
Еще больше книг только на канале Telegram "Медицинские книги" https://t.me/medknigi
