
КФ 2
.pdf
вероятность возникновения АГ на 50% выше, чем у лиц с нормальной массой тела. Ожирение I степени увеличивает риск развития СД II типа в 3 раза, II степени - в 5 раз и III степени - в 10 раз.
Факторы риска метаболического синдрома. Считают, что формирование МС генетически детерминировано. Известен ген к инсулиновым рецепторам, который локализован на 19-й хромосоме. Описано более 50 мутаций этого гена. Однако наиболее важными факторами внешней
МЕТАБОЛИЧЕСКИЙ СИНДРОМ
среды, способствующими развитию МС, считают избыточное употребление пищи, содержащей жиры, и низкую физическую активность.
В основе накопления жировых масс в организме лежит избыток животных жиров, содержащих насыщенные жирные кислоты. Если масса потребляемого жира превосходит возможности организма по его окислению, происходит развитие и прогрессирование ожирения. Насыщенные жирные кислоты, в избытке поступающие с пищей, вызывают структурные изменения фосфолипидов клеточных мембран и нарушение экспрессии генов, контролирующих проведение сигнала инсулина в клетку. Кроме того, жиры более калорийны, чем белки и углеводы: 1 г жира содержит 9 ккал, тогда как белки и углеводы - по 4 ккал. Следовательно, при употреблении жиров организм получает в 2 раза больше калорий, чем при употреблении белков и углеводов в одинаковом объеме.
Снижение физической активности - второй по значимости после переедания фактор, способствующий развитию ожирения и инсулинорезистентности. При гиподинамии происходит замедление липолиза и утилизации триглицеридов в мышечной и жировой ткани и снижение транслокации транспортеров глюкозы в мышцах, что и приводит к развитию инсулинорезистентности.
Иногда увеличение массы тела может быть побочным эффектом приема некоторых лекарственных препаратов
(табл. 16-1).
Таблица 16-1. Лекарственные препараты, способствующие увеличению массы тела
16.2. ДИАГНОЗ И МЕТОДЫ ОБСЛЕДОВАНИЯ
Основной признак: центральный (абдоминальный) тип ожирения - окружность талии более 80 см у женщин и более 94 см у мужчин.
Дополнительные критерии:
-АГ (АД >130/85 мм рт. ст.);
-повышение концентрации триглицеридов в крови (>1,7 ммоль /л);
-снижение концентрации ХС ЛПВП (<1,0 ммоль/л у мужчин; <1,2 ммоль/л у женщин);
-повышение концентрации ХС ЛПНП >3,0 ммоль/л;
-гипергликемия натощак (концентрация глюкозы в плазме крови натощак >6,1 ммоль/л);
-нарушение толерантности к глюкозе (концентрация глюкозы в плазме крови через 2 ч после нагрузки глюкозой в пределах >7,8 и <11,1 ммоль/л).
Согласно современным международным и национальным рекомендациям, наличие у пациента центрального ожирения и двух дополнительных критериев считают основанием для постановки диагноза МС (табл. 16-2).
Еще больше книг только на канале Telegram "Медицинские книги" https://t.me/medknigi
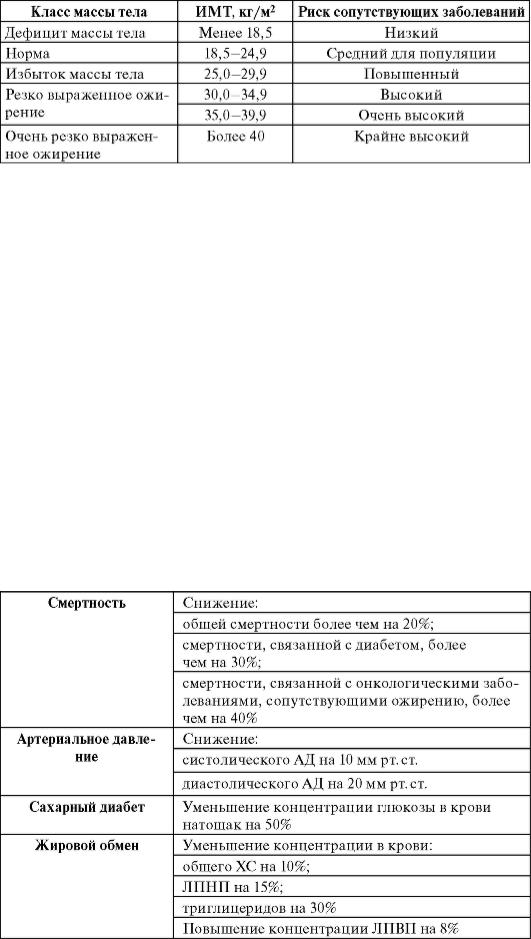
Таблица 16-2. Классификация массы тела по ИМТ (ВОЗ, 1997)
16.3. КЛИНИКО-ФАРМАКОЛОГИЧЕСКИЙ ПОДХОД К ЛЕЧЕНИЮ МЕТАБОЛИЧЕСКОГО СИНДРОМА
Следует отметить, что эффективность лечения МС, как и любого хронического состояния, тесно связана с его продолжительностью, и максимальных положительных результатов можно ожидать на начальных стадиях развития заболевания.
Современные подходы к лечению МС заключаются в использовании нефармакологических методов, которые при необходимости дополняют ЛС.
Цели лечения больных с МС: - снижение массы тела;
-достижение хорошего метаболического контроля;
-достижение оптимального уровня АД;
-максимальное предупреждение острых и отдаленных сердечнососудистых осложнений.
Рекомендации по модификации образа жизни должны включать в себя индивидуальный расчет диеты, изменение стереотипа питания и отказ от вредных привычек.
К нефармакологическим методам относят низкокалорийную диету, направленную на уменьшение массы тела и ее оптимизацию в сочетании с систематическими физическими тренировками или нагрузками бытового характера
(табл. 16-3).
Таблица 16-3. Уменьшение массы тела на 10 кг (в среднем это 10% исходной) сопровождается многочисленными положительными эффектами
Еще больше книг только на канале Telegram "Медицинские книги" https://t.me/medknigi
Немедикаментозные мероприятия по снижению массы тела:
-умеренно гипокалорийная диета;
-обучение больных правильному образу жизни с изменением пищевых привычек;
-ведение дневника питания;
-физические упражнения.
Больным можно рекомендовать регулярные динамические физические нагрузки (дозированную ходьбу, плавание, велотренажер)
умеренной интенсивности (4-5 занятий в неделю по 30-45 мин), поскольку в начале лечения больные МС часто не в состоянии выполнять продолжительные и интенсивные занятия. Основу лечения МС составляет низкокалорийное питание гиполипидемической направленности с учетом нарушений липидного спектра крови.
Только около 4-5% больных с МС могут достичь положительных результатов без дополнительной фармакотерапии. Таким образом, в ряде случаев необходимо к немедикаментозным методам лечения ожирения добавлять лекарственные препараты, снижающие массу тела.
Показанием к их применению является наличие:
-ИМТ >30 кг/м2;
-ИМТ >27 кг/м2 в сочетании с абдоминальным ожирением, наследственной предрасположенностью к СД II типа и наличием факторов риска сердечно-сосудистых осложнений (дис-липидемия, АГ и СД II типа).
Классификация препаратов. По механизму действия препараты для лечения ожирения можно разделить на три группы.
• Снижающие потребление пищи:
-фентермин , мазиндол , фенфлурамин , дексфенфлурамин , сибутрамин, флуоксетин, фенилпропаноламин.
• Увеличивающие расход энергии:
-термогенные симпатомиметики эфедрин, кофеин, сибутрамин.
• Уменьшающие всасывание питательных веществ:
- орлистат.
В настоящее время разрешены к применению два лекарственных препарата для лечения ожирения. Это препарат периферического действия - орлистат и центрального действия - сибутрамин.
Орлистат - препарат периферического действия, не обладающий системными эффектами. Действие препарата обусловлено его способностью ковалентно связываться с активным центром желудочно-кишечных липаз - ключевых ферментов, участвующих в гидролизе триглицеридов пищи, высвобождении жирных кислот и моногли-церидов. Это приводит к тому, что около 30% триглицеридов пищи не переваривается и не всасывается, что позволяет создать дополнительный дефицит калорий по сравнению с применением только гипокалорийной диеты. Орлистат назначают тем, кто предпочитает жирную пищу; при переедании углеводов препарат неэффективен.
Сибутрамин - мощный ингибитор обратного захвата норадренали-на и серотонина на уровне ЦНС. Он оказывает влияние на обе стороны энергетического баланса - поступление и расход энергии. С одной
стороны, это приводит к быстрому наступлению чувства насыщения, продлению чувства сытости и, таким образом, к снижению аппетита. С другой стороны, сибутрамин увеличивает расход энергии на тер-могенез, что также способствует снижению массы тела. Сибутрамин имеет дозозависимое действие. Значительный вклад в подтверждение того, что сибутрамин не только можно, но и нужно назначать больным АГ с ожирением, внесло исследование SCOUT (Sibutramine Cardiovascular OUtcome Trial). Опубликованные результаты 6-недельного вводного периода убедительно показали, что при приеме сибутрами-на происходит не только снижение массы тела, но и АД. Чем выше был исходный уровень АД, тем более выраженным антигипертензив-ным эффектом обладал
Еще больше книг только на канале Telegram "Медицинские книги" https://t.me/medknigi
сибутрамин. Препарат благоприятно влияет на проявления МС, обменные показатели у больных СД II типа, массу миокарда ЛЖ у пациентов с АГ и функции эндотелия при ИБС.
Сибутрамин назначают пациентам с повышенным аппетитом, которым трудно постоянно ограничивать себя. Это те больные, которые предпринимали неоднократные попытки похудеть, но не могли длительно ограничивать себя в еде.
Преимуществом сибутрамина считают отсутствие неприятных побочных эффектов со стороны ЖКТ, которые могут снижать качество жизни и приверженность лечению.
Также необходимо учитывать тот факт, что многие больные с АГ и ожирением имеют сниженный фон настроения, склонны к депрессии. Учитывая механизм действия сибутрамина, близкий к антидепрессантам, можно ожидать повышения настроения и жизненного тонуса в целом у этой группы пациентов.
В последнее время появились данные о возможном повышении риска сердечно-сосудистых осложнений на фоне применения сибу-трамина.
Применять препараты центрального действия более 3 мес не рекомендуется.
16.4. ПРЕПАРАТЫ, ПРИМЕНЯЕМЫЕ ДЛЯ КОРРЕКЦИИ ГИПЕРГЛИКЕМИИ
ПРИ МЕТАБОЛИЧЕСКОМ СИНДРОМЕ
Одно из проявлений МС - гипергликемия натощак и /или нарушение толерантности к глюкозе. Адекватный контроль концентрации глюкозы в крови существенно снижает у этих больных риск развития
сердечно-сосудистых осложнений. Коррекция инсулинорезистент-ности - важное направление лечения. В настоящее время одним из препаратов выбора фармакотерапии инсулинорезистентности при МС считают метформин.
Метформин - препарат, относящийся к группе бигуанидов. Повышает печеночную и периферическую чувствительность к эндогенному инсулину, не влияя на его секрецию. Интенсивный липолиз при висцеральном ожирении приводит к повышенной продукции свободных жирных кислот, поступающих через систему воротной вены в печень. Не оказывая прямых эффектов на β-клетки, метформин опосредованно улучшает секрецию инсулина, снижая глюкозоток-сичность и концентрацию свободных жирных кислот (липотоксич-ность). Первичный антигипергликемический эффект метформина вызван снижением продукции глюкозы печенью (глюконеогенез), а также продукции свободных жирных кислот, окисления жира и частично - усилением периферического захвата глюкозы.
Основной механизм действия метформина - снижение продукции глюкозы печенью. Такой механизм действия препарата связан с подавлением процессов глюконеогенеза и в меньшей степени - гликогенолиза, что в итоге обеспечивает нормализацию показателей гликемии натощак. Наряду с этим повышается поглощение глюкозы скелетными мышцами и жировой тканью. Метформин способствует инсулиноиндуцированному подавлению глюконеогенеза из таких предшественников глюкозы, как лактат, пируват, глицерол и некоторые аминокислоты, а также противодействует глюконеогенетиче-скому действию глюкагона. Повышение чувствительности периферических тканей к действию инсулина под влиянием метформина реализуется посредством ряда клеточных механизмов. Со стороны рецепторов инсулина под влиянием метформина наблюдается повышение их количества и аффинности. Кроме того, происходят стимуляция тирозинкиназной активности рецептора инсулина, а также стимуляция экспрессии и активности транспортеров глюкозы, их транслокация из внутриклеточного пула на клеточную мембрану. Вышеперечисленные процессы приводят к увеличению поглощения глюкозы органамимишенями инсулина - печенью, мышечной и жировой тканями, усиливается синтез гликогена в печени.
Метформин оказывает влияние на всасывание углеводов в ЖКТ, замедляя его скорость, а также снижает аппетит, благодаря чему уменьшается постпрандиальная гликемия. Важным эффектом мет-формина считают уменьшение или стабилизацию массы тела, а также
снижение отложения висцерального жира. Наряду с этим метформин обладает и другими метаболическими эффектами, включая влияние на жировой обмен. Лечение метформином оказывает благоприятный эффект на метаболизм липидов плазмы путем гиполипидемического и антиатерогенного действия.
Результаты исследования DPP (Diabetes Prevention Program) установили, что прием оригинального метформина снижает частоту развития СД II типа на 31% по сравнению с плацебо.
Лечение метформином начинают с дозы 500-850 мг на ночь. Поддерживающая доза - 500-850 мг 1-3 раза в сутки.
Еще больше книг только на канале Telegram "Медицинские книги" https://t.me/medknigi
Лечение МС метформином в сочетании с нефармакологическими методами не только улучшает тканевую чувствительность к инсулину, но и положительно влияет на многочисленные факторы риска сердечно-сосудистых заболеваний, замедляя развитие и прогресси-рование атеросклеротического процесса.
Таким образом, у больных МС прием метформина оказывает не только положительное влияние на факторы риска сердечнососудистых осложнений, но и выполняет функцию профилактики СД II типа. При коррекции АГ у больных МС необходимо добиваться полной нормализации АД. Наиболее важным требованием при выборе гипотензивных ЛС считают отсутствие отрицательного метаболического действия препарата.
Тиазолидиндионы - относительно новый класс препаратов, действие которых направлено на снижение инсулиноре-зистентности в тканях, главным образом мышечной и жировой. Тиазолидиндионы - высокоаффинные агонисты ядерных рецепторов, активируемых пероксисомальным пролифератором (PPAR) типа γ. Ядерные рецепторы семейства PPAR стимулируют транскрипцию значительного числа генов. PPAR-γ играют важную роль в липид-ном метаболизме, процессах утилизации глюкозы, формировании инсулинорезистентности, образовании пенистых клеток и атероге-незе, а также в развитии СД и ожирения. Агонисты PPAR-γ - тиа-золидиндионы - повышают чувствительность тканей к инсулину, что сопровождается снижением концентрации глюкозы, липидов и инсулина в сыворотке крови. Клиническая эффективность препаратов этой группы в контроле гипергликемии как при монотерапии, так и в сочетании с препаратами инсулина и другими сахаропонижающими средствами подтверждена многочисленными клиническими исследованиями. В отличие от других сахароснижаю-щих препаратов, применение тиазолидиндионов не сопровождается
повышением риска гипогликемии и побочных эффектов со стороны ЖКТ. Однако для тиазолидиндионов характерны некоторые специфичные побочные эффекты: периферические отеки и увеличение массы тела. Из-за этого назначать тиазолидиндионы пациентам с сердечной недостаточностью необходимо крайне осторожно. Если у больного диагностирована ХСН 3 ФК, лечение тиазолидиндиона-ми следует начинать с минимальных доз: для росиглитазона - 2 мг. Последующее увеличение дозы должно проходить под контролем массы тела и симптомов ХСН. У больных с ХСН 3-4 ФК от лечения тиазолидиндионами следует воздержаться.
16.5. ПРЕПАРАТЫ, ПРИМЕНЯЕМЫЕ ДЛЯ КОРРЕКЦИИ НАРУШЕНИЯ ТОЛЕРАНТНОСТИ
К ГЛЮКОЗЕ ПРИ МЕТАБОЛИЧЕСКОМ СИНДРОМЕ
Акарбоза. Один из самых безопасных препаратов, влияющих на постпрандиальный уровень глюкозы и инсулинорезистентность, представитель класса ингибиторов α-глюкозидаз. Исследование STOP-NIDDM наглядно продемонстрировало высокую эффективность акарбозы в предотвращении СД II типа у больных с нарушением толерантности к глюкозе. Главным итогом исследования STOP-NIDDM стало то, что у больных, находившихся на активном лечении акарбозой, относительный риск развития СД II типа был на 36% меньше, чем в группе плацебо. Относительный риск развития новых случаев АГ на фоне активного лечения снизился на 34%, ИМ - на 91%, любого зафиксированного сердечно-сосудистого события - на 49%. Результаты российского исследования «Апрель» продемонстрировали, что акарбоза позитивно воздействует на основные факторы риска сердечно-сосудистых осложнений - избыточную массу тела, постпрандиальную гипергликемию и АГ.
Механизм действия акарбозы - обратимая блокада α-глюкозидаз (глюкомилазы, сахаразы, мальтазы) в верхнем отделе тонкой кишки. Это приводит к нарушению ферментативного расщепления поли-и олигосахаридов и всасыванию моносахаридов, благодаря чему предотвращается развитие постпрандиальной гипергликемии и снижается концентрация инсулина.
Обычно первые 10-15 сут акарбозу принимают по 50 мг 3 раза в сутки непосредственно перед или во время еды, затем дозу постепенно увеличивают до 100 мг 3 раза в сутки с учетом переносимости.
Подобная тактика назначения акарбозы позволяет предотвратить или уменьшить желудочно-кишечные симптомы, такие, как метеоризм и диарею. При расстройствах кишечника, вызванных приемом препарата, необходимо строго соблюдать диету с ограничением углеводов и уменьшить его дозу. Противопоказания к назначению акарбозы - заболевания кишечника, сопровождающиеся нарушением всасывания, язвы, дивертикулы, трещины, стенозы. Акарбозу не следует назначать пациентам моложе 18 лет, а также во время беременности и лактации.
16.6. ГИПОЛИПИДЕМИЧЕСКАЯ ТЕРАПИЯ У ПАЦИЕНТОВ С МЕТАБОЛИЧЕСКИМ СИНДРОМОМ
Дислипидемия - один из основных признаков МС и фактор риска раннего развития атеросклероза. Она может быть как следствием, так и одной из причин развития инсулинорезистентности при снижении инсулинзависимого транспорта глюкозы. К назначению гиполипиде-мических препаратов пациентам с МС необходимо подходить индивидуально, с учетом не только концентрации ХС и ТГ, но и наличия или отсутствия ИБС или других основных факторов риска. У пациентов с инсулинорезистентностью предпочтительнее использовать все возможности для первичной профилактики атеросклероза, так как, базируясь только на принципах вторичной профилактики, когда уже существует клинически значимое поражение мозговых и коронарных артерий, невозможно добиться успеха в увеличении выживаемости таких больных. У больных с МС и гиперлипидемией необходимо проводить стратификацию риска сердечно-сосудистых осложнений по системе SCORE. При риске более 5% рекомендовано интенсивное вмешательство с назначением статинов, фибратов для достижения строгих целевых уровней
Еще больше книг только на канале Telegram "Медицинские книги" https://t.me/medknigi
показателей липидного обмена. Больным с МС и высоким риском возникновения ИБС необходимо такое же снижение концентрации ХС ЛПНП, как и больным с установленным диагнозом ИБС.
Коррекцию дислипидемий при МС проводят как статинами, так и фибратами. Основная цель лечения в этом случае - достижение оптимальных параметров липидного обмена. Выбор гиполипидеми-ческого препарата зависит от конкретной ситуации.
Статины. Широкое применение статинов при лечении дислипиде-мии у больных с МС оправдано тем, что эта группа ЛС обладает наи-
более выраженным и мощным гипохолестеринемическим действием, имеет наименьшее число побочных эффектов и хорошо переносится. Статины снижают показатели заболеваемости и смертности, связанные с ИБС и общей смертностью больных СД II типа существенно больше, чем у больных без СД, о чем свидетельствуют результаты крупного многоцентрового исследования 4S (Scandinavian Simvastatin Survival Study). По результатам крупного международного многоцентрового исследования Heart Protection Study (HPS), гиполипидемиче-ские препараты эффективны в качестве первичной профилактики. Достоверно снизилось количество сердечно-сосудистых заболеваний: острых инфарктов миокарда, инсультов, операций реваскуляризации сердца. Особенно сильно это снижение заметно в группе больных с инсулинорезистентностью.
Статины не влияют на показатели углеводного обмена и не взаимодействуют с гипогликемическими препаратами. Кроме того, по данным ряда российских исследований, статины - в частности розувастатин - способны повышать чувствительность периферических тканей к инсулину. Флувастатин и розувастатин лучше, чем другие статины, влияют на антиатерогенные фракции липопро-теидов - в большей степени повышают концентрацию ХС ЛПВП.
Статины сначала назначают в небольших дозах, постепенно титруя до достижения целевых уровней показателей липидного обмена. Препараты этой группы хорошо переносятся пациентами, но могут вызывать диспепсические расстройства в виде запора, метеоризма, болей в животе. В 0,5-1,5% случаев отмечается увеличение активности печеночных ферментов в крови. Превышение верхней границы нормы в 3 раза хотя бы одним из печеночных ферментов считают основанием для прекращения лечения. Через некоторое время, когда активность ферментов снизится до нормальных значений, лечение можно возобновить, назначая меньшие дозы или другой препарат. В 0,1-0,5% случаев на фоне приема статинов наблюдаются миопатии и миалгии. Самое опасное осложнение при приеме статинов - раб-домиолиз или распад мышечной ткани, что сопровождается увеличением активности КФК более чем в 10 раз и потемнением мочи из-за миоглобинурии. При подозрении на развитие рабдомиолиза статины следует немедленно отменить.
Фибраты. Способность фибратов снижать уровень ТГ, повышать концентрацию ХС ЛПВП, повышать активность липопротеидлипазы и усиливать действие гипогликемических препаратов делает их ценными в лечении дислипидемии при МС. По результатам многочисленных
исследований, применение фибратов снижает общую концентрацию ХС на 20-25%, ТГ - на 40-50% и повышает концентрацию ХС ЛПВП на 10-15%, что значительно снижает риск инфаркта, инсульта и смерти, связанной с ИБС. В частности, фенофибрат повышает концентрацию ХС ЛПВП на 20%, снижает концентрацию ТГ на 44%, фракцию ЛПОНП - на 51%, уменьшая индекс атерогенности плазмы. В самом крупном плацебоконтролируемом исследовании с фибратами (FIELD), изучающем применение фенофибрата на протяжении 5 лет, было продемонстрировано достоверное снижение не только макрососудистых (кардиоваскулярного риска на 27% у пациентов с дислипидемией и на 19% в общей популяции; снижение количества нефатальных ИМ и операций реваскуляризации на 21%), а также микрососудистых осложнений. В ходе этого исследования впервые были выявлены положительные эффекты приема фенофибрата на микроциркуляцию. При лечении фенофибратом было продемонстрировано достоверное снижение количества ампутаций на 47%, лазерного лечения диабетической ретинопатии - на 30%, микроальбуминурии - на 15%, случаев пролиферативной ретинопатии - на 30%, макулопатии сетчатки - на 31%, частоты прогрессирования существующей ретинопатии и необходимости первой лазерной терапии - на 79%, а также частоты возникновения новых случаев ретинопатии.
Фибраты хорошо переносятся, но в 5-10% случаев могут возникать диспепсические расстройства в виде запора, диареи, метеоризма. Эти нежелательные явления, как правило, протекают в легкой форме и не требуют отмены лечения. Не рекомендовано принимать фибра-ты при желчекаменной болезни. В исследовании FIELD количество нежелательных сердечно-сосудистых событий при приеме фенофи-брата не отличалось от таковых в группе плацебо.
Никотиновая кислота. Оказывает сходное с фибратами действие на показатели липидного обмена, но ее длительное применение не может быть рекомендовано больным с инсулинорезистентностью из-за возможности этого препарата снижать толерантность к глюкозе, повышать концентрацию мочевой кислоты и усугублять инсулинорезистентность. Тем не менее в некоторых случаях при неэффективности других сочетаний
допустимо назначение никотиновой кислоты в дозе не более 2 г/сут при частом контроле концентрации глюкозы в крови.
Секвестранты желчных кислот. ЛС этой группы не применяют в качестве препаратов первого выбора при лечении дислипидемии у больных с МС из-за того, что они могут вызывать нежелательное увеличение концентрации ТГ.
Еще больше книг только на канале Telegram "Медицинские книги" https://t.me/medknigi
Глава 17. САХАРНЫЙ ДИАБЕТ
САХАРНЫЙ ДИАБЕТ
Сахарный диабет (СД) - группа заболеваний, которая характеризуется хронической гипергликемией1. В основе патогенеза СД лежит недостаточность инсулина в организме, которая может быть:
-абсолютной - при нарушении секреции инсулина;
-относительной:
◊при уменьшении количества рецепторов к инсулину на поверхности клеток и развитии толерантности клеток к его действию;
◊при увеличении синтеза глюкозы в организме2.
Эпидемиология сахарного диабета
СД - наиболее распространенное заболевание желез внутренней секреции: в 2000 г. в мире было зарегистрировано 151 млн больных СД II типа. Число больных с СД I типа примерно в 4 раза меньше. Большинство больных СД одновременно страдают еще целым рядом заболеваний, наиболее частые из которых - атеросклероз, ИБС и АГ. Примерно 25% больных СД нуждаются в постоянном введении препаратов инсулина.
Этиология и патогенез сахарного диабета
Инсулин - полипептидный гормон, состоящий из двух аминокислотных цепей. Синтез инсулина происходит в β- клетках островков Лангерганса поджелудочной железы. Синтезированный инсулин накапливается в секреторных гранулах этих клеток в виде кристаллов, содержащих цинк.
1Гипергликемия - повышение концентрации глюкозы в крови выше 6,1 ммоль/л.
2Некоторые гормоны (глюкогон, адреналин и глюкокортикоиды) стимулируют синтез глюкозы в организме и /или тормозят синтез инсулина.
Высвобождение инсулина из секреторных гранул в кровь происходит под влиянием различных факторов1, важнейший из которых - повышение концентрации глюкозы в крови (после приема пищи наблюдается повышение секреции инсулина). В процессах высвобождения инсулина из β-клеток островков Лангерганса принимают участие калиевые каналы, проницаемость которых регулируется АТФ. При повышении концентрации глюкозы в крови увеличивается ее поступление в β-клетки, что приводит к увеличению синтеза АТФ и закрытию калиевых каналов. Этот процесс вызывает деполяризацию клеточной мембраны и увеличение поступления в клетку ионов Са++, что приводит к высвобождению инсулина из гранул.
Метаболизм инсулина. В плазме инсулин не имеет белка-носителя, соответственно период его полураспада не превышает 5-7 мин. Метаболизм инсулина особенно активно происходит в печени и почках (у беременных в плаценте). За один проход через печень из плазмы исчезает до 50% содержащегося в ней инсулина. В метаболизме инсулина принимают участие две ферментные системы: инсулин-специфическая протеиназа, содержащаяся во многих тканях организма, но преимущественно в печени и почках; глутатион-инсулин-трансгидрогеназа.
На поверхности клеток молекулы инсулина взаимодействуют с инсулиновыми рецепторами, которые представляют собой гликопро-теиновые комплексы, состоящие из двух субъединиц (α и β), связанных между собой дисульфидными мостиками. α-Субъединица расположена внеклеточно и отвечает за связь с молекулой инсулина, а β-субъединица - за преобразование сигнала. Рецепторы к инсулину постоянно синтезируются и распадаются, в среднем период жизни рецептора на поверхности мембраны составляет 7-12 ч, а их количество на поверхности одной клетки достигает 20 тыс.
У некоторых больных СД протекает с образованием антител, которые препятствуют связыванию рецептора с инсулином, что приводит к инсулинорезистентности. Дефекты строения рецепторов, обусловленные генетически, встречаются крайне редко.
Физиологические эффекты инсулина в организме
• Стимулирует транспорт глюкозы через мембрану клетки с помощью облегченной диффузии. Скорость поступления глюкозы в мышечные и жировые клетки определяет интенсивность ее
Еще больше книг только на канале Telegram "Медицинские книги" https://t.me/medknigi

1 α-Адреномиметики (эпинефрин) тормозят секрецию инсулина даже в присутствии глюкозы, β-адреномиметики обладают противоположным действием.
фосфорилирования и дальнейшего метаболизма. Примерно половина глюкозы, поступившей в организм, расходуется на энергетические нужды (гликолиз), от 30 до 40% превращается в жиры, а около 10% - в гликоген.
•Снижает концентрацию глюкозы в плазме крови.
•Ингибирует глюконеогенез.
•Ингибирует липолиз.
•Стимулирует синтез белков и тормозит их распад - анаболическое действие.
•Стимулирует рост и размножение клеток.
Недостаточность инсулина при СД приводит в первую очередь к снижению поглощения глюкозы клетками и к гипергликемии. Особенно высокая концентрация глюкозы в плазме крови наблюдается вскоре после приема пищи
(так называемая постпрандиальная гипергликемия).
В норме почечные клубочки непроницаемы для глюкозы, но при повышении ее концентрации в плазме выше 9-10 ммоль/л она начинает активно выделяться с мочой (глюкозурия). Это, в свою очередь, приводит к повышению осмотического давления мочи, замедлению реабсорбции воды и электролитов. Объем суточной мочи увеличивается до 3-5 л (в тяжелых случаях - 7-8 л) - развивается полиурия, а как следствие - обезвоживание (гипогидрата-ция) организма (рис. 17-1), что сопровождается сильной жаждой. При отсутствии инсулина происходит избыточное расщепление белков и жиров, которые используются клетками в качестве
источников энергии. Из-за этого, с одной стороны, организм теряет азот (в виде мочевины) и аминокислоты, а с другой стороны, в нем накапливаются токсичные продукты липолиза - кетоны1. Они имеют очень большое значение в патофизиологии СД: выведение из организма сильных кислот (ацетоуксусная и β-гидроксимасляная кислота) приводит к потере буферных катионов, истощению щелочного резерва и кетоацидозу. Особенно чувствительны к изменению осмотического давления крови и параметров кислотно-основного равновесия ткани головного мозга. Таким образом, нарастание кетоацидоза может приводить к кетоацидотической коме, а затем к необратимым повреждениям нейронов и смерти больного.
1 Ацетил-КоА, образующийся в печени в процессе быстрого окисления жирных кислот, затем превращается в ацетоуксусную кислоту, которая переходит в β -гидроксимасляную кислоту и декарбоксилируется до ацетона. Продукты липолиза можно обнаружить в крови и моче больных (кетоны или кетоновые тела).
Рис. 17-1. Патофизиология недостаточности инсулина в организме
Еще больше книг только на канале Telegram "Медицинские книги" https://t.me/medknigi
СД вызывает целый ряд осложнений, которые могут оказаться более тяжелыми, чем основное заболевание, привести к инвалидности и смерти больных. В основе большинства осложнений лежит повреждение кровеносных сосудов при атеросклерозе и гликозили-ровании белков (присоединении глюкозы к молекулам белков).
Основные осложнения сахарного диабета
• Атеросклероз (увеличение концентрации в крови свободных жирных кислот), который, в свою очередь, приводит к развитию макрососудистых осложнений (атеросклероз - непосредственная причина гибели 65% больных СД):
-ИМ;
-инсульта.
•Нефропатия (повреждение почек) с прогрессированием ХПН (встречается у 9-18% больных).
•Нейропатия (преимущественно поражаются периферические нервы).
•Ретинопатия (повреждение сетчатки, приводящее к слепоте) и катаракта (уменьшение прозрачности хрусталика).
•Снижение резистентности организма к инфекционным заболеваниям.
•Трофические нарушения (с образованием длительно незаживающих язв). Отдельно выделяют синдром диабетической стопы, под которым понимают инфекцию, язву и /или деструкцию глубоких тканей стопы, связанную с неврологическими нарушениями (нейропатия) и снижением магистрального кровотока (ангио-патия) в артериях нижних конечностей. Синдром диабетической стопы - наиболее частое осложнение диабета.
Классификация сахарного диабета
В настоящее время различают две основные клинические формы СД:
-СД I типа;
-СД II типа.
Сравнительная характеристика этих типов диабета представлена в табл. 17-1.
Таблица 17-1. Сравнительная характеристика основных типов сахарного диабета
Еще больше книг только на канале Telegram "Медицинские книги" https://t.me/medknigi
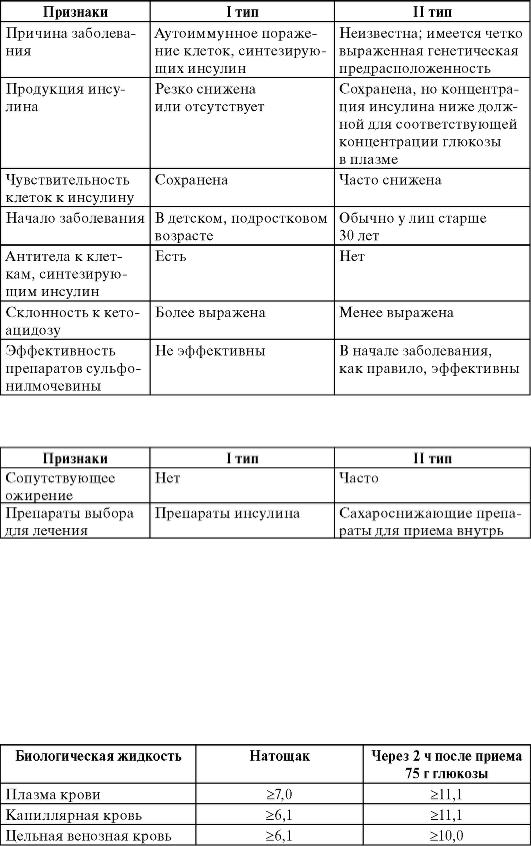
Окончание табл. 17-1
СД I типа - полиэтиологический синдром, обусловленный абсолютным дефицитом инсулина, что приводит к нарушению углеводного, а затем и других видов метаболизма. СД I типа развивается в результате аутоиммунного разрушения инсулинпродуцирующих клеток поджелудочной железы (аутоиммунный вариант) или спонтанно (идиопатический вариант). СД I типа - аутоиммунное заболевание, при котором специфические антитела повреждают β-клетки островков Лангерганса, постепенно (в течение нескольких лет) приводя к их полной гибели. СД I типа обычно развивается в молодом возрасте и требует пожизненной заместительной терапии инсулином.
Диагноз СД I типа ставят только при обязательном определении концентрации глюкозы в плазме крови (гликемии), а также на основании типичной клинической картины (прогрессивное снижение массы тела, развитие кетоацидоза, прогрессирующая физическая слабость) (табл. 17-2).
Таблица 17-2. Лабораторные критерии СД по концентрации глюкозы в крови (моль/л)
Лечение СД I типа включает в себя диетотерапию, физические нагрузки, инсулинотерапию. Большое значение имеет обучение больных, так как именно больной становится основным исполнителем медицинских рекомендаций.
СД II типа - синдром гипергликемии, хроническое заболевание, вызванное преимущественной инсулинорезистентностью и относительной инсулиновой недостаточностью, либо преимущественным дефектом секреции инсулина с инсулинорезистентностью или без нее. СД II типа составляет 80% всех случаев СД. СД II типа
Еще больше книг только на канале Telegram "Медицинские книги" https://t.me/medknigi
