
КФ 2
.pdf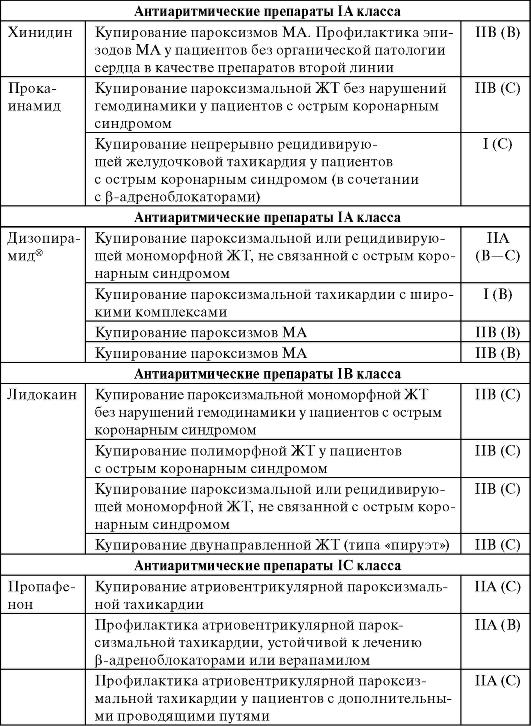
Продолжение табл. 13-3
Еще больше книг только на канале Telegram "Медицинские книги" https://t.me/medknigi
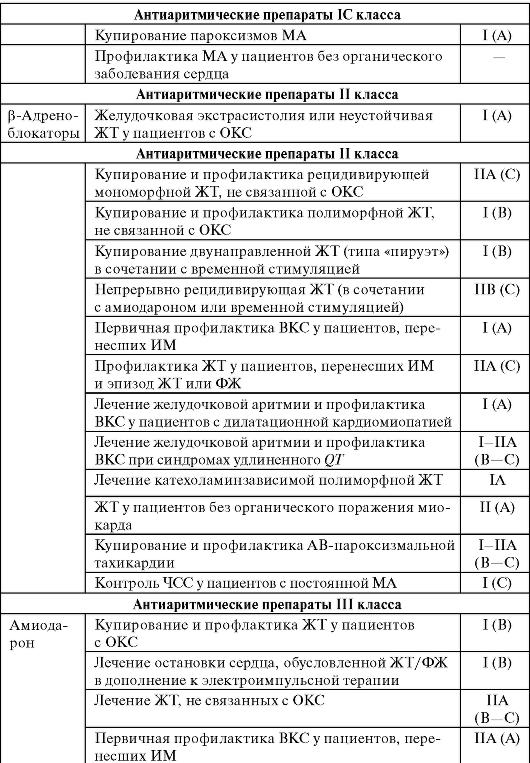
Окончание табл. 13-3
Еще больше книг только на канале Telegram "Медицинские книги" https://t.me/medknigi
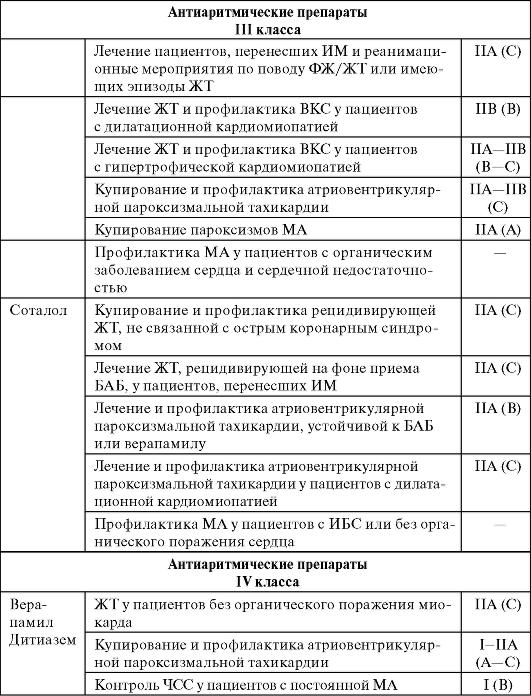
Принципы выбора антиаритмических препаратов и лечение некоторых наиболее распространенных
аритмий
Выбор антиаритмического препарата, как правило, основан на балансе между эффективностью и безопасностью.
Если у пациентов диагностирована аритмия, угрожающая жизни, предпочтение отдают препаратам с доказанной эффективностью. При лечении аритмий, снижающих качество жизни, но не приводящих к смерти, лучше назначать препараты с максимальной безопасностью, которые не вызывают проаритмий и обладают низкой токсичностью.
При выборе ААП необходимо учитывать наличие стандартных противопоказаний. Кроме того, принимают во внимание необходимость приема других препаратов, которые могут способствовать развитию проаритмий при совместном назначении с ААП.
Ниже представлены современные рекомендации по лечению наиболее распространенных аритмий.
Суправентрикулярные тахикардии
Еще больше книг только на канале Telegram "Медицинские книги" https://t.me/medknigi
Синоатриальная реципрокная тахикардия. Наиболее вероятным механизмом ее развития считают повторный вход возбуждения. При этом круг циркуляции импульса в основном заключен внутри СА-узла, но может включать и околоузловую предсердную ткань. Для лечения синоатриальной реципрокной тахикардии рекомендуют назначать БАБ, БМКК, амиодарон. При частой рецидивирующей тахикардии этого типа, не контролирующейся приемом ААП, рекомендована радиочастотная аблация СА-узла.
Атриовентрикулярная реципрокная тахикардия. Механизм, ответственный за ее развитие, - повторный вход возбуждения. Круг циркуляции импульса находится в тканях АВ-узла и связан с его разделением на два канала с различными электрофизиологическими свойствами. Метод лечения, эффективность которого считают доказанной, - радиочастотная катерная аблация (уровень доказательности I). Ее применяют как у пациентов с плохо переносимыми повторяющимися приступами атриовентрикулярной реципрокной тахикардии, так и у больных с редкими приступами. Из антиаритмических препаратов показаны БМКК, БАБ (уровень доказательности I), соталол, амиодарон, флекаи-нид*>, пропафенон (уровень доказательности IIa). При этом флекаинид*3 и пропафенон не рекомендуют использовать при ИБС и дисфункции
ЛЖ. Соталол, флекаинид*3 и пропафенон целесообразны в качестве препаратов резерва при неэффективности БАБ и БМКК.
Мерцательная аритмия (МА). Механизм, ответственный за развитие МА, - циркуляция импульса в одной или нескольких петлях re-entry, локализованных в миокарде предсердий. Кроме того, предполагают, что МА может развиваться по механизму патологического автоматизма.
Лечение МА основано на двух подходах:
-купирование пароксизмов МА с последующим поддержанием синусового ритма;
-контроль ЧСС при сохраняющейся МА.
Для купирования пароксизмов МА и восстановления синусового ритма эффективна электрическая кардиоверсия (уровень доказательности I). При пароксизме МА эффективны пропафенон (уровень доказательности I), амиодарон (уровень доказательности IIa), менее эффективны (или менее изучены) хинидин и прокаинамид (уровень доказательности IIb).
Для профилактики повторных эпизодов МА у пациентов без органических заболеваний сердца в качестве препаратов первой линии назначают пропафенон и соталол, препаратов резерва - амиодарон, дизопирамид®, прокаинамид и хинидин. Препарат выбора при сердечной недостаточности - амиодарон. У пациентов с ИБС в качестве препарата первой линии применяют соталол, препаратом резерва служит амиодарон. При их неэффективности возможно назначение дизопирамида®, прокаинамида и хинидина.
Для контроля ЧСС при сохраняющейся МА эффективны БМКК (уровень доказательности I), БАБ (уровень доказательности I), сердечные гликозиды (уровень доказательности I).
Желудочковые аритмии
Желудочковая аритмия у пациентов, перенесших инфаркт миокарда.
У пациентов, перенесших ИМ, часто отмечается ВКС при желудочковых тахикардиях. Основным механизмом развития этих аритмий считают re-entry. Для первичной профилактики ВКС пациентам, перенесшим ИМ, назначают БАБ (уровень доказательности I) и амиодарон (уровень доказательности IIa). Эффективно снижать риск ВКС у пациентов после ИМ способны ИАПФ и статины (уровень доказательности I). Если у пациентов после ИМ повторяются эпизоды ФЖ или ЖТ, эффективно применение ИКД (уровень доказательности I). Также достаточно эффективны БАБ или амиодарон (уровень доказательности IIa).
Желудочковая аритмия у пациентов с дилатационной кардио-миопатией. У пациентов с дилатационной кардиомиопатией желудочковые тахиаритмии становятся основной причиной смерти. Механизмом развития этих аритмий считают re-entry. Для лечения желудочковых тахиаритмий и профилактики ВКС пациентам с дилатационной кардиомиопатией назначают БАБ (уровень доказательности I). Кроме того, эффективны препараты без прямых электрофизиологических свойств - ИАПФ (уровень доказательности I) и блокаторы рецепторов альдостерона (уровень доказательности IIa). Кроме того, можно применять ИКД как для первичной (уровень доказательности IIa), так и для вторичной (уровень доказательности I) профилактики.
Желудочковая аритмия у пациентов с синдромом удлиненного QT. Синдром удлиненного QT - наследственный дефект ионных каналов (калиевых или натриевых) миокардиоцитов. Функционирование патологических ионных токов приводит к увеличению продолжительности потенциала действия, что проявляется существенным увеличением интервала QT на стандартной ЭКГ. Пациенты с синдромом удлиненного QT имеют высокий риск развития желудочковых тахиаритмий и ВКС. Основным механизмом развития аритмий у этой категории пациентов считают следовые деполяризации. Для лечения и профилактики ЖТ у пациентов с синдромом
удлиненного QT рекомендовано: избегать приема препаратов, удлиняющих интервал QT или снижающих
Еще больше книг только на канале Telegram "Медицинские книги" https://t.me/medknigi
концентрацию калия (уровень доказательности I-IIa), занятий профессиональным спортом (уровень доказательности I-IIa), прием БАБ (уровень доказательности I-IIA). При рецидиве аритмий на фоне приема БАБ показана имплантация ИКД в сочетании с дальнейшим приемом БАБ (уровень доказательности I-IIA).
Катехоламинзависимая полиморфная желудочковая тахикардия. Она развивается у пациентов без органического поражения сердца, характеризуется развитием эпизодов полиморфной ЖТ, возникающей после физической нагрузки или приема β-адреномиметиков. В качестве механизма развития катехоламинзависимой полиморфной ЖТ предполагают появление следовых деполяризаций. Препараты выбора для первичной профилактики ВКС - БАБ (уровень доказательности IIa). Пациентам, перенесшим эпизоды ЖТ и ВКС, рекомендована имплантация ИКД в сочетании с приемом БАБ (уровень доказательности I) или только БАБ (уровень доказательности IIa).
13.5. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ АНТИАРИТМИЧЕСКИХ ПРЕПАРАТОВ
13.5.1. Клиническая фармакология антиаритмических препаратов !А класса
Хинидин
Основной представитель !А группы.
Фармакокинетика. Биодоступность хинидина сульфата* при приеме внутрь составляет 70-80%. При приеме препарата до еды его максимальная концентрация в крови определяется через 1,5 ч, после еды - через 3-6 ч. При внутримышечном введении биодоступность составляет 85-90%, максимальная концентрация в крови определяется через 1,5-2 ч. Средняя терапевтическая концентрация хинидина в крови - 5 мкг/мл. Побочные эффекты проявляются при концентрации препарата в крови больше 10 мкг/мл. Хинидин на 60-90% связывается с альбуминами крови. Хорошо проникает в ткани, его концентрация в органах в 20-30 раз выше, чем в крови. Метаболизм (окисление) препарата происходит в печени. Скорость биотрансформации зависит от активности окислительных ферментов. Дозирование хинидина определяется скоростью его окисления. Неизмененный хинидин выводится с мочой (20%) и желчью (5%), метаболиты - с мочой. Снижение элиминации происходит при сердечной недостаточности, циррозе печени, поражении почек.
Фармакодинамика. Хинидин увеличивает продолжительность потенциала действия и эффективный рефрактерный период. Он снижает скорость проведения в AВ-узле, угнетает эктопические очаги возбуждения, что приводит к уменьшению частоты экстра-систолий. Подавляет re-entry, переводя однонаправленную блокаду проведения в двунаправленную. На ЭКГ больных, принимающих хинидин, часто регистрируются расширение зубца Р, удлинение интервалов PR и QT, расширение комплекса QRS, депрессия сегмента ST. Между концентрацией хинидина в плазме крови, шириной QRS и длиной QT имеется прямая зависимость. Препарат обладает холинолитическим действием, уменьшает влияние на сердце катехоламинов, оказывает выраженное отрицательное инотропное действие, снижает АД.
Показания. Хинидин применяют для купирования пароксизмаль-ной МА; пароксизмальной наджелудочковой тахикардии; частой предсердной и желудочковой экстрасистолии.
НЛР. При интоксикации хинидином отмечаются сердечнососудистые (артериальная гипотония, ФЖ, АВ-блокада, синусовая брадикардия) и внесердечные (тошнота, рвота, диарея, нарушения слуха, зрения, гемолитическая анемия) расстройства. Препарат нельзя назначать при повышенной чувствительности к нему, ХСН, значительной кардиомегалии, шоке, тромбоэмболии, тяжелой почечной и печеночной недостаточности, интоксикации сердечными гликозидами, АВ-блокаде II-III степени и блокадах ножек пучка Гиса.
Прокаинамид
Близкий по действию к хинидину и один из наиболее эффективных антиаритмических препаратов этой группы.
Фармакокинетика. Биодоступность прокаинамида - 85%. Максимальная концентрация препарата в крови при назначении внутрь достигается через 1 ч, при внутримышечном введении - через 15-30 мин. При использовании терапевтических доз до 10% препарата циркулирует в крови (85% из них в свободном виде), а остальная часть захватывается тканями. В печени происходит N-ацетилирование препарата, при этом образуется N- ацетилпрокаинамид, оказывающий одинаковое с прокаинамидом антиаритмическое действие. Скорость образования N-ацетилпрокаинамида генетически обусловлена. Основная часть (до 90%) прокаинамида выводится почками, из них в неизмененном виде - около половины. Скорость элиминации существенно зависит от функций печени и почек.
Показания. Прокаинамид широко применяют при наджелудочко-вых и желудочковых тахиаритмиях.
НЛР. Прокаинамид приводит к образованию антиядерных антител у 70% больных, что у 20% из них вызывает развитие синдрома системной красной волчанки. Этот лекарственный синдром чаще развивается у «медленных ацетиляторов». Прокаинамид обладает ганглиоблокирующим действием, снижая артериальное и венозное
Еще больше книг только на канале Telegram "Медицинские книги" https://t.me/medknigi
давление. При внутривенном введении может ухудшать сократительную активность миокарда, но в меньшей степени, чем хинидин. Противопоказан при AВ-блокаде, блокаде ножек пучка Гиса, декомпенсации ХСН.
13.5.2. Клиническая фармакология антиаритмических препаратов !В класса (местные анестетики)
Препараты блокируют вхождение натрия в 4 фазу ПД и увеличивают проницаемость мембран для ионов К+ в 3 фазу ПД, тем самым они снижают длительность реполяризации и укорачивают ПД. Анестетики снижают автоматизм эктопических очагов в желудочках, особенно в области ишемии. Не влияют на проводимость и силу сокращений миокарда. Основные показания к назначению ААП !В класса - желудочковая экстрасистолия в острой фазе ИМ, приступы ЖТ, аритмии по типу re-entry.
Лидокаин
Фармакокинетика. При приеме внутрь пресистемная элиминация лидокаина составляет 90%, из-за этого препарат не назначают внутрь. Основной путь введения - внутривенный. 20-25% лидокаи-на связывается с белками плазмы. Большая часть препарата выводится с мочой в виде метаболитов и только 3% - в неизмененном виде. При внутривенном введении период полувыведения лидо-каина составляет 1,5 ч. Терапевтическая концентрация сохраняется недолго - примерно 20 мин. При патологии печени период полувыведения может возрасти в 3 раза. При внутримышечном введении терапевтическая концентрация в крови сохраняется в течение 2 ч.
Фармакодинамика. Препарат в терапевтических дозах практически не влияет на сократимость миокарда.
Показания. Лидокаин применяют при желудочковой тахиаритмии, желудочковой экстрасистолии при остром ИМ, для профилактики ФЖ. Лидокаин особенно эффективен при желудочковых аритмиях, обусловленных механизмом re-entry.
НЛР. При передозировке возможно развитие судорог, парестезий, тошноты. Препарат не применяют при выраженной блокаде ножек пучка Гиса, артериальной гипотензии.
Фенитоин
Фармакокинетика. Препарат медленно, но полностью всасывается в ЖКТ. Максимальная концентрация в крови достигается через 8 ч. В плазме крови до 90% фенитоина находится в связанном состоянии. Биотрансформация происходит в печени, большая часть метаболитов выводится с желчью. Период полувыведения препарата - 24 ч.
Фармакодинамика. Оказывает влияние на электрофизиологические параметры кардиомиоцитов, схожее с лидокаином. Фенитоин повышает концентрацию ионов калия в кардиомиоцитах, что особенно актуально при аритмиях, связанных с интоксикацией сердечными гликозидами.
Показания к применению. Фенитоин применяют при дигиталис-ных токсических аритмиях, особенно желудочковых.
НЛР. Может вызывать изменения со стороны ЦНС: расстройства сна, головокружение, нистагм, тошноту. При длительном применении вызывает гипертрофию десен. Препарат противопоказан при ХСН, АВ-блокаде.
13. 5. 3. Клиническая фармакология
антиаритмических препаратов !С класса
Препараты блокируют №+-каналы, существенно замедляя скорость деполяризации (фаза 0) и угнетая автоматизм, преимущественно в волокнах Гиса - Пуркинье и желудочках, при этом практически не влияют на реполяризацию. ЛС этой группы применяют при пред-сердных и желудочковых аритмиях.
Лаппаконитина гидробромид
Препарат, полученный из растения аконита белоустого.
Фармакокинетика. При назначении препарата через рот его биодоступность составляет менее 40%. Латентный период составляет 40-60 мин, максимальный эффект развивается через 4-6 ч, продолжительность действия - 8 ч. При внутривенном введении действие препарата развивается относительно медленно - латентный период составляет 15-20 мин, максимальный эффект достигается через 2 ч, продолжительность действия - 6-8 ч.
Показания. Наджелудочковые и желудочковые аритмии (экстраси-столия, пароксизмальная тахикардия).
Еще больше книг только на канале Telegram "Медицинские книги" https://t.me/medknigi
НЛР. Возможно появление головной боли, головокружения, диплопии, аритмогенное действие. Лаппаконитина гидробромид противопоказан при атриовентрикулярных и внутрижелудочковых блокадах.
Пропафенон
Фармакокинетика. Хорошо всасывается из ЖКТ, но биодоступность не превышает 50%. Латентный период пропафенона - 30 мин,
максимум эффекта достигается через 3 ч, длительность действия - от 4 до 8-10 ч. Выводится почками в виде метаболитов.
Фармакодинамика. Препарат уменьшает скорость быстрой деполяризации - фазы 0 преимущественно в волокнах Пуркинье и сократительных волокнах желудочков, снижает автоматизм, слабо блокирует β-адренорецепторы.
Показания. Препарат назначают при желудочковых аритмиях (ЖТ, синдроме Вольфа - Паркинсона - Уайта), фибрилляции предсердий.
НЛР. Наблюдаются у 13-17% больных. Чаще всего возникают слабость, головокружение, рвота. Проаритмические эффекты пропа-фенона регистрируют у 5-6% пациентов. Препарат противопоказан при АВ-блокаде, обструктивных заболеваниях легких.
13.5.4. Клиническая фармакология антиаритмических препаратов !! класса (β-адреноблокаторы)
ЛС этой группы блокируют влияние симпатомиметиче-ских веществ на развитие потенциала действия. Они уменьшают №+ ток в4и0 фазу ПД, снижают активность синусового узла и эктопических очагов. Большинство БАБ замедляют ЧСС, снижают СА- и АВ-проводимость, увеличивают рефрактер-ность AВ-узла. Препараты оказывают отрицательное инотроп-ное действие. БАБ отличаются по кардиоселективности (действие на β1-адренорецепторы сердца), наличию внутренней симпатоми-метической и мембраностабилизирующей активности.
При назначении БАБ в небольших дозах возникает антиаритмический эффект, при увеличении дозы развиваются антиангинальный и гипотензивный эффекты. Наиболее выраженной антиаритмической активностью обладают препараты без внутренней симпатоми-метической активности.
К БАБ, которые применяют в качестве антиаритмических препаратов, относят как неселективные препараты: пропранолол, окспре-нолол®, пиндолол, так и кардиоселективные: атенолол, талинолол. Все перечисленные БАБ показаны при синусовой тахикардии любого гене-за (кроме интоксикации сердечными гликозидами), при предсердной пароксизмальной тахикардии, мерцании и трепетании предсердий, синдроме Вольфа - Паркинсона - Уайта. При наличии у больного
экстрасистол в ранний период после ИМ применение БАБ может предупредить внезапную смерть больного от нарушений сердечного ритма. Кроме того, БАБ являются препаратами выбора при аритмиях, провоцируемых физическими нагрузками. Основные НЛР БАБ - выраженная брадикардия, АВ-блокада, артериальная гипотония, бронхоспазм. Выраженность НЛР зависит от селективности препарата. Кардиоселективные БАБ реже вызывают НЛР. Противопоказания к назначению БАБ - нарушения АВ-проводимости.
13. 5. 5. Клиническая фармакология антиаритмических препаратов !!! класса (ингибиторы реполяризации)
Антиаритмические препараты этой группы значительно удлиняют потенциал действия, блокируя К+-каналы, возможно Са2+- и №+-каналы, обладают антиадренергическим действием. Эти эффекты приводят к увеличению продолжительности ПД и эффективного рефрактерного периода путем снижения скорости реполяризации. Ингибиторы реполяризации действуют на все проводящие и сократительные клетки сердца.
Амиодарон
Фармакокинетика. Препарат медленно всасывается. Биодоступность низкая и в среднем составляет 35%. Латентный период - от 2 сут до нескольких недель. Период полувыведения - 1 мес. Амиодарон выводится из организма через ЖКТ.
Фармакодинамика. Помимо основного противоаритмического действия, амиодарон уменьшает работу сердца, ослабляя адренергиче-ское влияние на миокард. Он уменьшает ЧСС, увеличивает коронарный кровоток, улучшает метаболизм миокарда путем повышения концентрации креатинфосфата и гликогена. Не влияет на сократимость миокарда и сердечный выброс.
Показания к применению. Препарат назначают при угрожающих жизни желудочковых аритмиях у пациентов с ИБС, особенно осложняющейся декомпенсацией ХСН, фибрилляцией предсердий, частыми желудочковыми экстрасистолами; при синдроме Вольфа - Паркинсона - Уайта. Амиодарон назначают больным с желудочковыми тахиаритмиями при повышенном риске внезапной смерти.
Еще больше книг только на канале Telegram "Медицинские книги" https://t.me/medknigi
НЛР. Амиодарон часто вызывает НЛР, что существенно ограничивает его применение. По разным данным, у 0,002- 5% больных развиваются повреждения легких в виде глубокого интерстициального пневмонита. Ввиду этого при длительном приеме препарата необходимо каждые 3-4 мес проводить рентгенологическое исследование легких. Молекула амиодарона содержит йод (31% массы), что необходимо учитывать при заболеваниях щитовидной железы, кроме того, возможно развитие тиреотоксикоза. Частота возникновения этого осложнения колеблется от 1 до 5%. При длительном применении препарата у 5% больных возникает серовато-коричневая пигментация кожи, у 10-20% - фотосенсибилизация. Амиодарон не применяют при всех видах нарушений проводимости сердца, артериальной гипо-тензии, дисфункции щитовидной железы, БА.
Соталол
Фармакокинетика. При приеме внутрь препарат быстро всасывается из ЖКТ, его биодоступность составляет 90100%. С белками плазмы практически не связывается, период полувыведения - 15 ч, выводится преимущественно почками.
Фармакодинамика. Соталол обладает электрофизиологическими свойствами антиаритмических препаратов как II, так и III класса. Как и все БАБ вызывает угнетение предсердно-желудочковой проводимости и уменьшение ЧСС, а также удлиняет рефрактерный период в предсердиях, желудочках и проводящей системе путем удлинения ПД в кардиомиоцитах, что характерно для антиаритмических препаратов III класса.
Показания. Соталол применяют при наджелудочковой и желудочковой тахикардии, пароксизмальной форме мерцания предсердий.
НЛР. Для соталола характерны НЛР, свойственные другим БАБ: брадикардия, АВ-блокада, артериальная гипотония, бронхоспазм.
13.5.6. Клиническая фармакология антиаритмических препаратов IV класса (блокаторы медленных кальциевых каналов)
Препараты блокируют медленный трансмембранный ток ионов кальция в клетку, что вызывает торможение фазы 0 ПД клеток с медленным электрическим ответом (клетки СА- и АВ-узлов, поврежденные волокна миокарда). Это способствует снижению автоматизма
СА-, AВ-узла и эктопических очагов. БМКК нарушают механизм reentry. Показания к применению - купирование приступов пред-сердной пароксизмальной тахикардии.
Верапамил
Верапамил (Изоптин*) - производное фенилалкиламинов (см. гл. 10), препарат, наиболее широко применяемый при аритмиях.
Фармакокинетика. Хорошо всасывается при приеме внутрь, но обладает низкой биодоступностью - 10-20% из-за метаболизма в печени при первом прохождении. В крови связывается с белками на 90%. Биотрансформация происходит в печени путем N-деалкилирования и O-деметилирования. Однако существуют значительные индивидуальные различия в фармакокинетике препарата. Период полувыведения варьирует от 2,5 до 7,5 ч после однократного введения и от 4,5 до 12 ч после повторного приема. Увеличение периода полувыведения при повторном введении обусловлено угнетением ферментных систем печени. Стабильная терапевтическая концентрация в крови достигается через 4 сут после начала приема. Выводится почками, в том числе в неизменном виде - 5% препарата. Толерантности к верапамилу не возникает.
Показания. Верапамил назначают для лечения и профилактики предсердных и наджелудочковых аритмий (пароксизмальной тахикардии, мерцании предсердий), профилактики приступов стенокардии, при АГ.
НЛР наблюдаются у 9% больных. У 4% пациентов возникают нарушения со стороны сердечно-сосудистой системы - АВ-блокады, артериальная гипотензия, декомпенсация ХСН. У 2% больных отмечаются нарушения со стороны ЖКТ - запор, тошнота, у 2% - негативные реакции со стороны ЦНС: головная боль, головокружение.
Противопоказания. Верапамил нельзя назначать при синдроме слабости синусового узла, АВ-блокаде степени, синдроме
Вольфа - Паркинсона - Уайта (WPW).
Взаимодействие с другими ЛС. Одновременное назначение вера-памила с БАБ или противоаритмическими препаратами !А класса может приводить к развитию АВ-блокады, брадикардии, артериальной гипотонии, сердечной недостаточности. При одновременном назначении верапамила с другими гипотензивными препаратами отмечается взаимное потенцирование их эффектов. При совместном назначении возможно повышение концентрации дигоксина в плазме. Нейротоксическое действие верапамила потенцируется карбамазепи-
Еще больше книг только на канале Telegram "Медицинские книги" https://t.me/medknigi
ном и солями лития, причем психотропный эффект лития при этом ослабляется. Концентрация циклоспорина или теофиллина в плазме крови при совместном назначении с верапамилом возрастает. Верапамил потенцирует действие миорелаксантов.
Дилтиазем
Дилтиазем - селективный блокатор медленных кальциевых каналов, производное бензотиазепина (см. главу 10).
Показания. Дилтиазем назначают для купирования пароксизмов наджелудочковой тахикардии и МА с целью урежения ЧСС при МА, а также для предупреждения пароксизмов МА при острой ишемии миокарда.
НЛР. Брадикардия, нарушения атриовентрикулярной проводимости, ХСН, тахикардия, зуд, крапивница, фотосенсибилизация.
13.6. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ ПРЕПАРАТОВ РАЗНЫХ ГРУПП, ОБЛАДАЮЩИХ АНТИАРИТМИЧЕСКОЙ АКТИВНОСТЬЮ
Аденозина фосфат
Эндогенное биологически активное вещество, принимающее участие в различных метаболических процессах в организме.
Фармакокинетика. При внутривенном введении захватывается эритроцитами и эндотелиальными клетками сосудов. В организме быстро окисляется до инозина и аденозинмонофасфата. Период полувыведения - менее 10 с. Выводится почками в виде неактивных метаболитов.
Фармакодинамика. Оказывает антиаритмическое действие, замедляет АВ-проводимость, увеличивает рефрактерность АВ-узла, понижает автоматизм синусового узла. Оказывает также сосудорасширяющее действие.
Показания. Купирование приступов наджелудочковой тахикардии, в том числе у больных с синдромом Вольфа - Паркинсона - Уайта.
Противопоказания: АВ-блокада II-III степени, синдром слабости синусового узла, гиперчувствительность к препарату.
НЛР: асистолия, ЖТ, ФЖ.
Лекарственное взаимодействие. Кофеин и теофиллин - конкурентные антагонисты препарата. Дипиридамол усиливает действие адено-зина фосфата. Карбамазепин - увеличивает степень АВ-блокады.
Препараты калия
К противоаритмическим препаратам можно отнести ЛС, содержащие калий и магний, - панангин*, аспаркам, калия хлорид. Иногда их причисляют к первой группе противоаритмических средств. Препараты калия вызывают торможение медленной спонтанной диа-столической деполяризации, снижают скорость проведения импульса в сердечных клетках.
Препараты калия способствуют поддержанию ионного баланса в организме, восполняют имеющийся дефицит ионов. Их назначают для лечения аритмий, связанных с гипокалиемией (например, на фоне приема салуретиков или при интоксикации сердечными гликозидами).
Противопоказания. Тяжелая почечная недостаточность, гиперка-лиемия, болезнь Аддисона, одновременный прием калийсберегаю-щих диуретиков.
НЛР: Тошнота, рвота, диарея, гиперкалиемия с возможным развитием аритмий, блокады сердца, асистолии.
Сердечные гликозиды
Сердечные гликозиды - это наиболее ранние соединения, применяемые при лечении предсердных тахиаритмий и сердечной недостаточности.
Это стероидные кардиотонические соединения растительного происхождения, и при гидролизе они расщепляются на сахарную (гликон) и несахарную (агликон или генин) части.
Еще больше книг только на канале Telegram "Медицинские книги" https://t.me/medknigi
Фармакодинамика. Сердечные гликозиды - единственная широко применяемая группа препаратов с положительным инотропным действием. Положительное инотропное действие объясняется угнетением №+,К+- АТФазы, являющейся для них специфическим рецептором. Это способствует увеличению в кардиомиоцитах концентрации Na+, снижению - К+ и активации системы обмена Na+ - Ca2+, повышая концентрацию Ca2+ в цитоплазме и реализуя положительное инотропное действие. При этом процесс релаксации не страдает, так как сердечные гликозиды не ингибируют Са2+-АТФазу. Предполагают, что сердечные гликозиды имитируют эффект эндогенных дигиталисоподобных веществ.
Повышение силы и скорости сокращений сердца при введении сердечных гликозидов происходит без увеличения потребности миокарда в кислороде. Они в равной степени повышают сократимость миокарда при сердечной недостаточности и ее отсутствии. Однако
их применение у здоровых людей не сопровождается изменением минутного объема сердца, величина которого определяется не только силой сердечных сокращений, но и их частотой, величиной пред-и постнагрузки.
Механизм диастолического действия сердечных гликозидов связан с активацией барорецепторов дуги аорты путем повышения ударного объема сердца, с прямой активацией центра блуждающего нерва в продолговатом мозге и с замедлением АВ-проводимости. Увеличение времени диастолы оказывает положительное влияние на процессы кровенаполнения желудочков сердца и кровоснабжения миокарда.
При внутривенном введении сердечные гликозиды могут вызвать сужение артериол и венул, которое объясняется прямым миотроп-ным действием препаратов и стимуляцией α-адренорецепторов гладких мышц сосудов. Вазоспастическое действие сердечных гликозидов может сопровождаться повышением АД, что необходимо учитывать при лечении некоторых заболеваний, например острого ИМ. Этого эффекта можно избежать при медленном (в течение 15 мин) введении препарата.
Сердечные гликозиды оказывают прямое действие на канальце-вую реабсорбцию натрия, что также связано с подавлением активности Na+, К+-АТФазы. Однако в терапевтических дозах этот эффект проявляется слабо и не имеет существенного значения. Увеличение диуреза при приеме сердечных гликозидов объясняется улучшением почечной гемодинамики благодаря повышению минутного объема сердца.
Классификация сердечных гликозидов. К настоящему времени открыто более 400 сердечных гликозидов, но основное место в медицинской практике занимают гликозиды реснитчатой, шерстистой и пурпурной наперстянки (дигоксин, ланатозид Ц, дигитоксин), строфанта (строфантин К) и майского ландыша (коргликон*).
Принцип классификации сердечных гликозидов основан на их фармакокинетических свойствах: неполярные (жирорастворимые) и полярные (водорастворимые) препараты.
Фармакокинетика сердечных гликозидов. Неполярные сердечные гликозиды (дигитоксин, дигоксин, ланатозид Ц) хорошо всасываются в кишечнике, что определяет их применение в амбулаторной практике. В крови они находятся преимущественно в неактивной связанной (с альбуминами) форме, что обусловливает наличие у них латентного периода. Большая продолжительность действия и способность жирорастворимых гликозидов к кумуляции определяются
Окончание табл. 13-4
особенностями их метаболизма. Биотрансформация в печени протекает в два этапа: вначале при участии микросомальных ферментов происходит их метаболическая трансформация с последующей конъюгацией с глюкуроновой кислотой. Экскретируются гликозиды преимущественно с желчью (табл. 13-4).
Таблица 13-4. Сравнительная фармакокинетика основных сердечных глико-зидов
Еще больше книг только на канале Telegram "Медицинские книги" https://t.me/medknigi
