
- •Кислотные и основные свойства органических соединений
- •1. Кислоты и основания Бренстеда
- •Кислоты Бренстеда
- •Кислотность по Бренстеду
- •Факторы, влияющие на силу кислот
- •• Природа атома в кислотном центре
- •• Структурное окружение кислотного центра
- •Электронные эффекты заместителей
- •Стабилизация пара-нитрофенолят-аниона за счет –М-эффекта нитрогруппы
- •Основания Бренстеда
- •Основность по Бренстеду
- •Факторы, влияющие на силу оснований
- •Увеличение электроотрицательности
- •• Структурное окружение основного центра
- •Ароматические амины
- •Электронные эффекты заместителей
- •Снижение основности пара-нитроанилина под действием –М-эффекта нитрогруппы
- •Основность гетероциклических соединений
- •2. Кислоты и основания Льюиса
- •Жесткие и мягкие кислоты и основания
- •Структурное окружение кислотного центра
- •Факторы, влияющие на силу оснований
- •Структурное окружение основного центра

Кислотные и основные свойства органических соединений

1. Кислоты и основания Бренстеда
Кислоты Бренстеда – это частицы, способные отдавать протон (доноры протона)
HA |
|
H+ + A- |
|
||
|
||
кислота |
|
сопряженное |
|
|
основание |
Основания Бренстеда – это частицы, способные присоединять протон (акцепторы протона)
B: + H+ |
|
BH+ |
|
||
|
||
основание |
сопряженная |
|
|
кислота |
|
|
|
|
Кислотно-основное взаимодействие:
HA + B: |
|
A- |
+ BH+ |
|
|||
|
Кислоты Бренстеда
Классификация
ОН-кислоты: Карбоновые кислоты Cпирты
Фенолы
SH-кислоты: Тиолы
NH-кислоты: Амины Амиды
Пиррол
CH-кислоты: Углеводороды Карбонильные соединения
Галогенпроизводные
Нитросоединения
RCOOH
ROH
ArOH
RSH
RNH2, R2NH RCONH2
NH
RH RCH2CHO
RCH2Hal RCH2NO2

Кислотность по Бренстеду
K |
|
[CH3COO ][H3O ] |
|
|||
a |
|
|
|
|
- константа кислотности |
|
|
[CH3COOH] |
|||||
|
|
|
|
|||
pKa = - lg K a
Чем меньше pKa, тем сильнее кислота

Факторы, влияющие на силу кислот
HA |
|
H+ + A- |
|
||
|
||
кислота |
|
сопряженное |
|
|
основание |
Сила кислоты определяется стабильностью сопряженного основания
•Природа атома в кислотном центре
•Структурное окружение кислотного центра
•Электронные эффекты заместителей

• Природа атома в кислотном центре
СН- < NH- < OH- < SH-кислоты
CH3CH2-H CH3NH-H CH3O-H CH3S-H
pKa |
40 |
30 |
16 |
10,5 |
|
|
Увеличение кислотности |
|
|
Увеличение электроотрицательности
|
sp3 |
sp2 |
sp |
|
CH3CH2-H |
CH2=CH-H |
HC C-H |
pKa |
40 |
36 |
25 |
Увеличение кислотности

• Структурное окружение кислотного центра
ROH |
HOH |
ArOH |
RCOOH |
pKa 16-17 |
15,7 |
8-11 |
4-5 |
Увеличение кислотности

|
|
|
O |
|
|
|
O |
|
+ |
H+ |
CH |
|
C |
OH |
|
CH3 |
|
C |
- |
||
|
|
|||||||||
|
|
|
||||||||
|
||||||||||
3 |
|
|
|
|
|
O |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
Карбо н о вая кисло та |
Карбо ксилат-ан ио н |
|
|
|||||||
Стабилизации за счет p- сопряжения
|
|
|
|
OH |
|
O |
+ H+ |
|
|
|
|
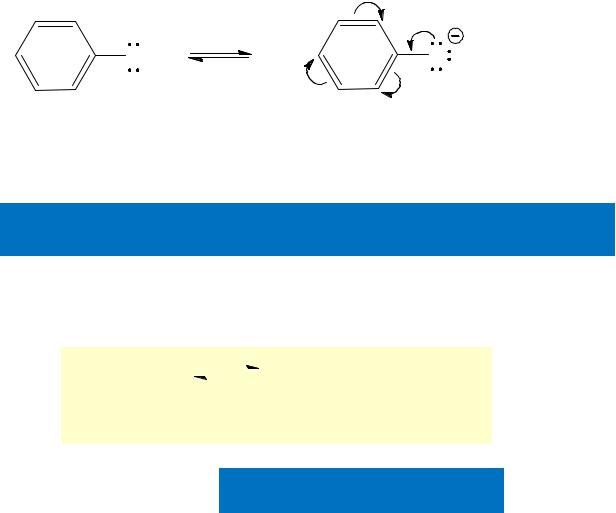
фенол |
фенолят-анион |
|
|
Стабилизации за счет p- сопряжения
R |
|
OH |
|
R |
|
O- |
+ H+ |
|
|
||||||
|
|
|
|||||
|
|
||||||
ñï èðò |
|
àëêî ãî ëÿò |
|
||||
|
|
|
àí èî í |
|
|||
нет стабилизации

Электронные эффекты заместителей
донор (+I) акцептор (-I)
|
|
COOH |
|
Cl |
CH2 COOH |
|
CH3 |
H-COOH |
|||
|
|
|
|
|
|
pKa |
4,7 |
3,7 |
2,8 |
||
Увеличение кислотности
донор (+М > -I) |
|
|
ацептор (-I , -M) |
|
|
CH3O |
|
OH |
OH |
O N |
OH |
|
|
|
|
2 |
|
pKa |
10,2 |
10 |
|
7,2 |
|
Увеличение кислотности
Электроноакцепторные заместители увеличивают силу кислот Электронодонорные заместители уменьшают силу кислот
