- •Введение. Общая характеристика иммунитета. Иммунология, как
- •1958); Формирование теории идиотипической сети при иммунной регуляции (н.Ерне,1974);
- •II.Неспецифическая (врожденная,естественная)
- •III. Специфический иммунитет. Органы и клетки иммунной
- •2) Активация внутриклеточных эндонуклеаз и разрушение днк клетки-мишени.
- •IV. Антигены. Характеристика. Инфекционные и
- •3 Аллели: а, в и о(н) и может проявляться соответственно в виде а-антигена, в-антигена и
- •55 %, Вторая группа а (II)- 31 %; третья группа в α (III) -11 %, четвертая ab (IV) – 3 %.
- •V. Антитела (иммуноглобулины)
- •15 Лет. В это время в иммунной системе подростка происходят следующие изменения:
- •VII. Антиинфекционный иммунитет
- •VIII. Иммунопатология. Иммунодефицитные состояния.
- •IX. Аутоиммунные заболевания
- •Ревматоидный артрит (ра) – системное, хроническое воспалительное заболевание со-
- •X. Аллергия
- •30 Мин. Немедленные реакции еще называют – повышенная чувствительность немедлен-
- •I тип реакций. Анафилактические реакции (реагиновые, IgE-зависимые).
- •5, 6, 8), Вовлекающих другие лейкоциты. Эти клетки, в свою очередь, выделяют вторичные
- •II тип. Цитотоксические реакции.
- •III тип. Иммунокомплексные реакции.
- •V тип. Антирецепторные реакции.
- •XI. Противоопухолевый иммунитет
- •Определяют естественные (в отношении групп крови, эритроцитов животного и т.Д.)
- •XIII. Иммунотерапия и иммунопрофилактика.
- •14 Дней. Лечебный эффект сывороток проявляется максимально при раннем введении, поско-
- •XIV. Серологические реакций.
V. Антитела (иммуноглобулины)
Способность клеток и молекул принимать участие в иммунологических реакциях, обусло-
влена структурами (рецепторами), находящимися на мембранах клеток. К таким рецепторам
на В-лимфоцитах относятся иммуноглобулиновые молекулы, которые способны отделятся от
поверхности лимфоцитов и функционировать как свободные антитела (связывать антитела).
Рецепторы на поверхности Т-лимфоцитов, при отделении от поверхности клеток, теряют
способность связывать антигены.
Рецепторы лимфоцитов и свободные антитела принадлежат к суперсемейству иммуногло-
булинов. В иммунной системе они определяют процессы распознавания, адгезии и свя-
зывания. Молекулы членов суперсемейства представляют собой полипептидную цепь состо-
ящую из аминокислотных остатков. Определенная последовательность аминокислотных ос-
татков создает компактную структуру, называемую доменом. Домен содержит 70-110 амино-
кислот.
Иммуноглобулины или антитела вырабатываются в организме в ответ на введение антиге-
на и направлены против нейтрализации последных. Антитела связывают чужеродный агент
(антиген) попавший в организм. Образующийся антиген-антительный комплекс захватыва-
ет фагоцит (макрофаг) с помощью Fc – рецептора, поглошает и переваривает.
Антитела (при фракционировании с помощью электрофореза) относятся к γ (гамма) –гло-
булинам, а по международной классификации имеют название – иммуноглобулины. Анти-
тела и иммуноглобулины являются синонимами. Антитела составляют 1/3 всех белков крови.
Продуцентами антител являются В-лимфоциты и в результате их дифференциации сформи-
рованные плазматические клетки. Уникальным свойством антител является – специфично-
сть. Специфичность антител имеет не только медицинское, но общебиологическое значение.
Каждому микробу, каждому антигену соответсвует только для него специфически характе-
рное антитело. Антитело связывается только с той специфической структурой антигена, про-
тив которой оно выработалось.
С помощью рецепторов иммуноглобулиновой природы (антител) организм отличает «свое»
от «чужого», что является основой сохранения биологической индивидуальности.
Все белки, входящие в суперсемейство иммуноглобулинов, можно пдразделить на 3 фун-
кциональные группы:
белки, связанные со специфическим распознаванием антигенов;
белки, участвующие в иммунных реакциях в качестве регуляторных молекул,
помошников;
белки, участвующие в межклеточных взаимодействиях между лимфоцитами.
К первой группе принадлежат: поверхностные иммуноглобулины В-лимфоцитов и гумо-
ральные антитела; антигенраспознающие рецепторы Т-лимфоцитов; молекулы I, II и III
класса главного локуса гистосовместимости (МНС).
Вторая группа представлена рецепторным комплексом Т-лимфоцитов, имеющим один до-
мен - CD3 молекулой, которая участвует в переносе антигенной информации от мембраны
внутрь клетки, в цитоплазму.
Третья группа белков представлена молекулами, обладающими адгезивными свойствами.
Они принадлежат к CD2 – рецепторам. Основная функция адгезивных белков – обеспечение
межклеточных контактов среди лимфоцитов.
Антитела (иммуноглобулины) отличаются тем, что несмотря на схожесть строения моле-
кул, по специфичности они существенно отличаются друг от друга. Лимфоидная система мо-
жет вырабатывать антитела не только против естественных антигенов, но и против искусстве-
нно синтезированных антигенов. Это свидетельствует об огромном потенциале иммунной си-
стемы. Условно установлено, что у организма есть способность и возможность выработать
(синтезировать) огромное количество антител самых различных специфичностей – прибли-
зительно 10-12 миллионов.
Синтез антител осуществляется в плазматических клетках, которые представляют собой ко-
нечный этап дифференцировки В-лимфоцитов. Синтез и сборка молекул антител происхо-
дит на полирибосомах, откуда они проникают в цистерны эндоплазматического ретикулума.
Из цистерн антитела транспортируются в аппарат Гольджи. В итоге собранные молекулы ан-
тител занимают свое место на мембранах В-лимфоцитов (плазмоцитов), как антигенраспо-
знающие рецепторы или покидают поверхность плазмоцитов и циркулируют в сыворотке
крови как свободные гуморальные антитела.
Белковая часть антител состоит из 4-х полипептидных цепей – 2-х тяжелых-Н-цепь (англ.
Неаvy chains) и 2-x легких- L-цепей (Light chains). Тяжелые и легкие цепи состоят из струк-
турных единиц (доменов), включающие аминокислотные остатки (70-110). Легкая цепь сос-
тоит из 2 доменов, а тяжелая – из 4 или 5 доменов. Типовая структура антитела представлена
на ристунке.
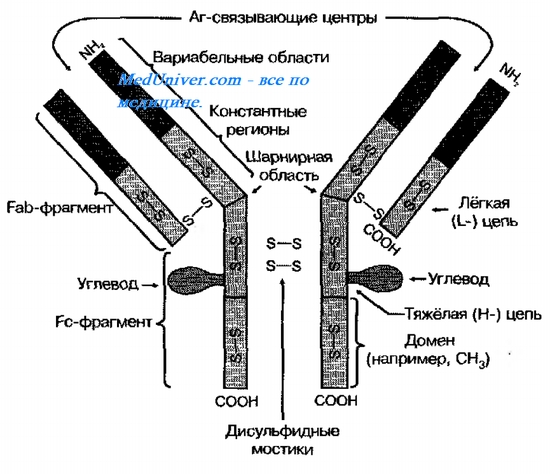
Рис. 1. Молекула антитела.

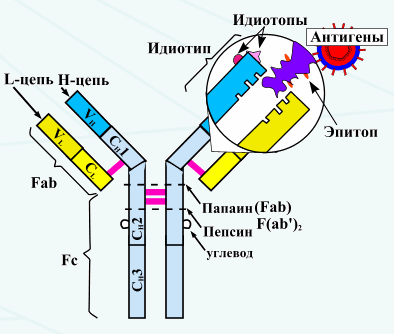

V-домены содержат изменяющиеся участки, называемые гипервариабельными участка-
ми. Тяжелые и легкие цепи с помощью гипервариабельных участков создают антитела прак-
тически с неограниченным количеством специфичностей. Гипервариабельные участки между
тяжелыми и легкими цепями создают так называемые активные центры (паратопы), с по-
мощью которых антитела захватывают (связывают) соответствующие антигенные детерми-
нанты (эпитопы). Активный центр антител представляет собой пространство (углубление,
полость, ямка), глубина которой равна 1,2 нанометра. Указанное углубление точно повторяет
конфигурацию антигенной детерминанты, против которой от выработан. Таким образом, ак-
тивный центр антител характеризуется высокой специфичностью и с большой точностью со-
ответствует антигенной детерминанте, что является основой их прочного связывания.
Протеолитические ферменты вызывают разрушение структуры молекулы антител. Напр.,
под действием пепсина молекула антитела распадает на две части: 1) F(ab1)2 - антигенсвя-
зывающий фрагмент (Fragment antigen binding) и 2) Fc - фрагмент (Fragment crystalline).
Под действием папаина молекула антитела распадает на 3 части: Fab1; Fab2 и Fc- фрагме-
нты.
Антитело, как белковое вещество, сам может выступать в роли антигена и можно получить
против него антитела в высоких титрах. По антигенным детерминантам, тяжелые и легкие це-
пи делятся на классы, изотипы и аллотипы. Изотипами тяжелых цепей являются: γ (га-
мма), α (альфа), µ (миу), δ (дельта), έ (эпсилон). В соответствии с изотипами, различают 5 кл-
ассов иммуноглобулинов: IgG, IgA, IgM, IgD и IgE. Выделяют также субклассы иммуно-
глобулинов – IgG1, IgG2 и т.д. Легкие цепи обладают κ (каппа) и λ (лямбда) изотипами.
Известно, что последовательность аминокислот каждой (Н и L) полипептидной цепи имму-
ноглобулинов кодируется двумя разными – V- и C –генами. Центральной проблемой имму-
нологии является изучение механизмов иммунологической специфичности, в частности, вы-
работки великого множества специфических антител и разновидностей рецепторов Т- и В-
лимфоцитов, которые обеспечивают иммунный ответ на попавшие в организм естественные
или искусственные антигены. Комбинированное количество генов определяет 10 миллионов
типов иммуноглобулиновых рецепторов. В результате соматических мутации их число увели-
чивается в 100 раз. Это вполне достаточно для того, чтобы была абсолютно обеспечена имму-
нная защита организма.
Наряду с изотипными вариантами на поверхности клеток представлены аллотипические ва-
рианты. Они представляют собой генетически детерминированные индивидуальные антиген-
ные маркеры, с помощью которых осуществляют дифференцировку аллотипических имму-
ноглобулинов.
Антитела (мономеры) могут связываться друг с другом и образовать димеры и полимеры.
К мономерам относятся иммуноглобулины IgG и IgЕ, к пентамерам – IgM, а иммуногло-
булины класса IgA - могут быть в виде мономеров, димеров и тетрамеров. Мономеры мо-
гут быть связаны друг с другом соединительной цепью, так называемой J- цепью (англ.
Joining – соединительный).
Классы иммуноглобулинов отличаются друг от друга биологическими свойствами. В пер-
вую очередь это относится к связыванию антигена. Молекула антитела имеет 2 антигенсвязы-
вающих участка (2 активные центры), обуславливающие ее бивалентность (двухвалентно-
сть). Каждый активный центр антитела связывается с одним эпитопом (антигенной детерми-
нантой) поливалентного антигена. Это приводит к образованию так называемой сетевой
структуры, которая в результате утяжеления, выпадает в осадок.
Существуют одновалентные антитела, которые известны под названием неполных анти-
тел. Они могут связываться с антигеном одним активным центром (имеют только адин акти-
вный центр), однако они не образуют сетевую структуру (т.н.решетку) из-чего комплес – не-
полное антитело-антиген не выпадает в осадок. Исследование неполных антител проводят
реакцией Кумбса.
Иммуноглобулины характеризуются аффинностью и авидностью. Под аффинностью ан-
титела имеется ввиду его схожесть, близость с антигеном, а авидность определяет силу и ста-
бильность связывания антитела с антигеном. Авидность определяется аффинностью антитела
к антигену. Выраженной авидностью характеризуются иммуноглобулины класса- IgM (пен-
тамеры).
Иммуноглобулины, кроме того, что играют важнейшую роль в иммунных регуляциях, вы-
полняют целый ряд функций, в частности, преципитация антигена (в основном раствори-
мые антигены); агглютинация или лизис корпускулярных антигенов (микроб, эритро-
цит, нормальная и опухолевая клетка и др.); фиксация комплемента; прохождение через
плаценту; нейтрализация токсина; участие в ревматоидных, аллергических и анафила-
ктогенных процессах и др.
Иммуноглобулин IgG класса составляет 70-80 % всех иммуноглобулинов сыворотки крови
человека. Его молекулярный вес равен 160000 кD, скорость седиментации – 7 S. Антитела
класса IgG совместно с комплементом и другими гуморальными факторами обеспечивают
иммунную защиту организма от бактериальной и вирусной инфекций, инвазирования пара-
зитами (гельминтами) и патогенными грибами. Они нейтрализуют эгзо- и эндотоксины, уси-
ливают фагоцитоз и др. IgG характеризуется высокой авидностью (быстрая и прочная связь
с антигеном). Это единственный класс иммуноглобулинов, который свободно проходит че-
рез плаценту и проникает в организм плода и защищает его от инфекций. Его содержание до-
ходит до минимума на 3-4 –й месяц после рождения ребенка, затем уровень IgG повышается
за счет выработки собственных антител. Их уровнь достигает нормы (для взрослых) по до-
стижении 7 лет.
IgA – в организме представлен в виде сывороточных иммуноглобулинов класса A и секре-
торных SIgA – иммуноглобулинов. Его молекулярный вес составляет 170000 кD. Секретор-
ный иммуноглобулин обладает боковым белком, с помощью которого он прикрепляется к по-
верхности слизистой оболочки. SIgA – антитела играют важнейшую роль в местном иммуни-
тете, поскольку мешают мешают микробам адгезироваться (прикреплятся) к поверхности
слизистых оболочек. Общее количество IgA -иммуноглобулинов составляет 15-20 %. Они в
основном обнаруживаются в слюне, моллозиве, молоке, в желчном соке, в секретах моче-по-
ловой системы, в слезе и трахео-бронхиальных выделениях.
IgM – составляет 10 % от общего количества иммуноглобулинов. Его молекулярный вес
достигает 900000 кD. По молекулярной массе они значительно превосходят антитела всех
других классов. Это связано с тем, что антитела M – класса представляют себя пентамер, т.е.
состоят из 5 молекул антитела класса IgG. Иммуноглобулины M – класса – первые антитела,
которых синтезирует организм плода, а также первыми появляются в сыворотке крови чело-
века при иммунизации (вакцинации) антигенами. Из-за огромной величины они не могут
проходит через плаценту. IgM – классу антител относятся изогемагглютинины крови.
IgD – антитела составляют 1 % от общего количества иммуноглобулинов. Его молекуляр-
ный вес равен 180000 кD. IgD- антитела тоже не проходят через плаценту, не связывают ком-
племент. В организме функция этих иммуноглобулинов не конца ясна. Предполагают, что D -
антитела синтезируются В-лимфоцитами и принимают участие в противомикробной защите
верхних дыхательных путей.
IgЕ – антитела в организме содержатся в незначительных количествах. Его молекулярный
вес составляет 190000 кD. IgЕ- иммуноглобулины синтезируются плазматическими клетка-
ми в бронхиальных и перитонеальных лимфатических узлах, в лимфатических скоплениях
слизистой оболочки желудочно-кишечного тракта. Они участвуют в реализации реакций по-
вышенной чувствительности (гиперчувствительности) немедленного типа. Антитела IgЕ –
класса называют также реагинами, поскольку они участвуют в реакции анафилаксии.
Иммуноглобулины, также как и другие белки организма, обладают антигенными свойства-
ми. Антиглобулиновые антитела, полученные иммунизацией животных антителами (сыворо-
ткой, иммуноглобулином, моноклональными антителами), широко применяются для выявле-
ния и характеристики антител различных видов и специфичностей. При некоторых патологи-
ях организм теряет толерантность к антигенам собственных клеток и тканей. В результате
этого синтезируются антитела против собственных иммуноглобулинов, вызывающие разли-
чные нарушения в организме. Например, при ревматоидном артрите, системной красной во-
лчанке и некоторых других заболеваниях в организме образуются IgM – антитела, направле-
нные против собственных IgG – антител. Указанное аутоантитело (IgM) называется ревма-
тоидным фактором и его выявление в сыворотке крови пациента имеет диагностическое
значение. Участок активного центра антител имеет молекулярные структуры – идиотипы,
обладающие антигенными свойствами. Поскольку до иммунизации эти структуры почти не
наблюдаются, к ним нет и толерантности. После выработки антител против идиотипиче-
ских структур образуются антиидиотипические антитела II –го ряда. Затем против антииди-
отипических антител вырабатываются анти- антиидиотипические антитела III –го ряда, ко-
торые представляют собой зеркальное отражение антиидиотипических антител. Это отраже-
ние представляет собой повторение структуры определенного антигена (бактериальный, ви-
русный и т.д.). Использование зеркальных вакцин (на основе антител) является весьма пер-
спективным, поскольку мы избавляемся от возможных аллергических реакций, вызванных
бактериальными антигенами (при их использовании). Антительные вакцины являются моно-
клональными антителами (гомологичными) и не вызывают аллергических реакций.
Рецепторы антигенреактивных лимфоцитов. Взаимодействие лимфоцитов с антигенами
осуществляется через рецепторы, находящиеся на поверхности клеток. Рецепторы предста-
вляют собой молекулы гликопротеидов, состоящих из полипептидных цепей, скрепленных
дисульфидными связями.
Антигенраспознающие рецепторы В-лимфоцитов в основном представляют иммуноглобу-
лины M- и D- классов. После антигенной активации на мембранах лимфоцитов могут экс-
прессироваться (возникнуть) антитела других классов. Одна клетка - В-лимфоцит содержит
200 – 300 тыс. одинаковых рецепторов, специфичных к одному антигену.
Рецепторы Т-лимфоцитов представляют собой две полипептидные цепи, состоящие из ва-
риабельных и константных доменов. Определенный участок константного домена проходя
через мембрану клетки, погружен в цитоплазму. Общее количество рецепторов на Т- лимфо-
цитах составляет 10-20 тысяч.
Иммуноглобулиновые рецепторы Т-лимфоцитов тесно связаны с другими мембранными
рецепторами. В частности, это СD3 молекулы, являющиеся маркером Т-лимфоцитов и выя-
вление которых осуществляется моноклональными антителами. Кроме того, на поверхности
Т- клеток экспрессированы гликопротеиновые молекулы, обеспечивающие распознавание
I- или II- класса молекул (антигенов) главного комплекса гистосовместимости (МНС).
Соответственно, этими молекулами являются СD8+ и СD4+, которые являются маркерами
цитотоксических и хелперных субпопуляции Т-лимфоцитов.
VI. Возрастные особенности иммунитета.
Процесс закладки и развития иммунной системы начинается в эмбриональном периоде и
заканчивается, когда окончательно формируется гормональный статус взрослого человека.
У женщин и детей в определенные периоды закономерно возникают критические состояния,
связанные с морфо-функциональными изменениями иммунной системы, с резким сдвигом
функции эндокринной и других систем организма. Критический период у женщин проявля-
ется при специфических физиологических состояниях – беременности, родах, грудном
вскармливани и менопаузе.
В онтогенезе иммунной системы человека различают несколько периодов (таблица 1).
Основные периоды онтогенеза иммунной системы
Таблица 1
-
Перио-ды
Х а р а к т е р и с т и к а
С р о к и
I
Закладка первичных органов и начальная дифференциация клеток иммунной системы
6 недель – 9 месяцев (эмбрион – плод)
I I
Усовершенствование и формирование зрелой иммунной системы
от рождения до 16 – 18 лет
I I I
Максимальная функциональная активность взрослой иммунной системы.
от 16-18 лет до 55-60 лет.
IV.
Снижение фукции иммунной системы, старение
55-60 лет и выше
В процессе эмбрионального развития, на 6-8 неделе начинается закладка Т- и В- системы
иммунитета, а в последующем периоде ее функциональное развитие. Лимфоидная ткань и
клетки эмбриона и плода весьма чувствительны к действию повреждающих факторов хи-
мической (лекарства, наркотики, алькоголь и т.д.), биологической (бактерий, вирусы, гри-
бки, риккетсии, токсины и т.д.) и физической (радиация, механическое воздействие) при-
роды. Результат повреждения может проявиться в виде приобретенной иммунопатологии
(иммунодефициты, аллергия, аутоиммунные реакции).
Важным, как с теоретической, так и с практической стороны, является вопрос иммунно-
го взаимоотношения организмов матери и плода.
Во время беременности в иммунной системе женщины протекают существенные физиоло-
гические изменения, обусловленные развитием плода и эндокринными сдвигами.
На сегодня, исходя из иммунологических позиции, все еще окончательно не выяснен воп-
рос – почему организм матери не отторгает оплодотворенное яицо и развитый из него эм-
брион (16-75-ий день), поскольку в их составе содержаться чужеродные для матери антиге-
ны, в частности, антигены полученные по отцовской линии, а также эмбриональные антиге-
ны.
Развитие толерантности в отношении эмбриона и плода имеет несколько объяснений:
- Факторы местной защиты слизистых оболочек (плодных путей) женщины инертно реаги-
руют на половые клетки мужчины –сперматозоиды;
- Факторы системного иммунитета – сывороточные антитела и Т-киллеры, не эффективны
против плода, поскольку половые пути женщины изолированы от общего кровообраще-
ния;
- Трофобласт, как плацентарный барьер, обеспечивает полную изоляцию кровообращения
организмов матери и плода;
- Клетки плаценты и плода вырабатывают белковые и небелковые вещества, которые акти-
вно подавляют отторжение плода;
- В организме матери развивается цитокиновая регуляция иммунной системы, в результате
которой в организме имеет место выборочная супрессия иммунной системы в отношении
чужеродных (плода) антигенов. В месте с тем, в организме матери сохранена иммуноло-
гическая реактивность в отношении других антигенов, в том числе бактерийных и вирус-
ных агентов;
- Плацента препятствует проникновению Т- и В-лимфоцитов в кровообращение плода и
тем самым защищает его от повреждения.
Вместе с тем, организмы матери и плода не являются пассивными в отношении друг-другу.
Напр., антитела матери (IgG) свободно проходят через плаценту и циркулируют в организме
плода. Остальные антитела (IgM, IgA, IgE, IgD) лишены способности проникать в кровоток
плода. Клеточные рецепторы трофобласта (плаценты) связываются с Fc – фрагментом анти-
тела – IgG, поглощает его путем пиноцитоза и начинается транспортировка его в кровоток
плода. Специфичность антител, полученных от матери, является многообразным и дает по-
лную защиту плода от инфекционных агентов.
Иммунная система плода начинает синтез собственных антител начиная с 10-ой недели
(IgM), с 12-ой недели (IgG), с 30 –ой недели (IgA) и характеризуется низкой интенсивно-
стью в течение периода развития плода. Несмотря на это, защита новорожденных в осно-
вном обеспечивается материнскими антителами.
Определенный интерес представляет реакция иммунной системы матери на аллоантигены
плода, которые нередко попадают в организм матери. В частности, эритроциты, лейкоциты и
тромбоциты плода проходят через плаценту и проникают в кровоток матери. Против этих
клеток иммунная система матери вырабатывает антитела (IgM), которые не представляют
опасности для плода, поскольку они не способны проходит через плаценту. Повреждение
плода могут вызвать только антитела IgG – класса, наличие которых может вызвать
гемолитическую болезнь, аллоиммунную нейтропению, тромбоцитопеническую
пурпуру (болезнь Верльгофа) и др.
При попадании возбудителя инфекций в организм плода происходит выработка IgM –анти-
тел. Повышение указанных антител в пуповинной крови указывает на наличие инфекций,
т.е. антигенной стимуляции организма плода в внутриутробном периоде.
Второй период развития иммунной системы (после рождения) характеризуется ее последо-
вательным совершенствованием под воздействием внешних и внутренних факторов. Для по-
лного созревания иммунной системы особое значение имеет стимуляция организма микроб-
ными антигенами и другими эгзо – и эндогенными агентами.
Постоянно осуществляется адаптация отдельных звеньев иммунной системы к изменяю-
щимся условиям внешней среды, а также координация иммунных механизмов и нейроэндо-
кринных функций.
Иммунная система у детей очень чувствительна к повреждениям какой-нибудь другой си-
стемы организма, что выражается в нарушении функции иммунокомпетентных клеток и сни-
жении синтеза цитокинов.
Воздействие неблагоприятных химических, биологических и физических факторов на им-
мунную систему подростков (до 16 – 18 лет) вызывает более глубокие нарушения, чем у вз-
рослых.
В иммунной системе детей, от рождения до зрелого возраста, закономерно протекают кри-
зисные морфо-функциональные сдвиги. Эти этапные моменты в онтогенезе иммунной
системы совпадают с переходными периодами развития детского организма.
Первый иммунный кризис во времени совпадает с рождением ребенка, когда организм
впервые попадает в непривычную среду и становиться объектом действия большого количе-
ства антигенов. Лимфоидные ткани и клетки, которые обеспечивают неспецифическую рези-
стентность, с первых же часов получают коллосальный антигенный стимул для развития.
Осуществляется микробная колонизация желудочно-кишечного и дыхательного путей. Бо-
льшое значение имеет качественный состав естественной (природной) микрофлоры. Если
быстро произойдет формирование нормальной микрофлоры организма, тогда развитие им-
мунной системы осуществляется правильным путем. В лимфатических узлах новорожден-
ных интенсивно размножаются плазматические клетки, синтезирующие антитела различной
специфичности.
Некоторая отсталость в развитии иммунной системы отмечается у детей, родившихся в ре-
зультате кесарева сечения. Их микрофлора отличается от микрофлоры детей, родившихся в
результате обычных родов. Такие дети (родившиеся путем кесарева сечения) менее резисте-
нтны и относительно часто болеют бактериальными и вирусными инфекциями.
Т- и В- лимфоциты иммунологическую реактивность проявляют только после рождения
ребенка. Однако, в иммунных реакциях превалирует супрессорный компонент, поскольку
синтез антител и цитотоксические реакции Т- клеток недостаточно развиты.
Несмотря на то, что содержание Т- и В- лимфоцитов в крови новоржденных в количестве-
нном отношении почти такое же как у взрослых, функционально они не полноценны, о чем
свидетельсвует слабый иммунный ответ на антигены. Недостаточно развиты также естестве-
нные киллеры (NK), на низком уровне и синтез цитокинов. Можно сказать, что слаженная ра-
бота клеток иммунной системы зависит с одной стороны, от многообразия и совершенства
цитокинов, с другой стороны – от чувствительности и адекватности лимфоидных клеток –
дать соответствующий иммунный ответ вторгшемуся в организм микробу (антигену).
Для новорожденных характерен слабый иммунный ответ на антигены. Это обусловлено не
зрелостью Т- и В- лимфоцитов, слабостью системы фагоцитоза. Слабое функционирование
макрофагов объясняется снижением процессинга антигена. В крови отмечается низкий уро-
вень гамма-интерферона. У новорожденных иммунологическая память еще не функциониру-
ет.
У новорожденных и детей ранего возраста основную защитную функцию выполняют пас-
сивно полученные (от организма матери) антитела. Вместе с материнским молоком в боль-
шом количестве дети получают секреторные иммуноглобулины (SIgA) из желудочно- кише-
чного тракта.
Слабые иммунные реакции и низкая резистентность у новорожденных в отношении бакте-
рии определяют опасную тенденцию – генерализацию гнойно-воспалительных процессов
и развитие сепсиса.
Второй критический период иммунного статуса приходится на 3-6 –ой месяц от рождения
ребенка. Этот период характеризуется постепенным ослаблением пассивного гуморального
иммунитета из-за уменьшения количества иммуноглобулинов, полученных от организма ма-
тери. Полное исчезновение антител (пассивного иммунитета) в организме ребенка наступает
позднее. Высокочувствительными методами доказано, антитела полученные от матери в ор-
ганизме ребенка циркулируют до 18 месяцев. Это имеет определенное диагностическое зна-
чение. В частности, решение вопроса о происхождении антител против вируса СПИД-а в кро-
ви ребенка.
Во втором критическом периоде у детей часто наблюдаются вирусные инфекций. В крови
детей до 1 года возраста циркулируют антитела класса IgM. Для получения активных анти-
тел класса IgG против столбняка, дифтерий, полиомиелита и коклюша, необходимо провести
2-3 –кратную вакцинацию детей в отношении указанных инфекций. У детей интенсивно ра-
звивается иммунная система и к одному году многие ее звенья функционируют нормально,
однако синтез полноценных (совершенных) антител (иммуноглобулинов) начинается с 4 – 6
летнего возраства. Вместе с тем, местный иммунитет дыхательных путей и системы пищева-
рения, обусловленный секреторными антителами (SIgA) и неспецифическими гуморальными
факторами (лизоцим, пероксидаза, лактоферин, ионы тиоцианата), окончательно формируе-
тся в 7 – 8 летнем возрасте.
Клинические иммунологи у детей дополнительно выделяют критические зоны. Это дет-
ский возраст – 2 года и 4-6 лет. Дети в двухлетнем возрасте уже не обладают факторами пас-
сивного иммунитета, а собственный иммунитет еще несовершенный для эффективной борь-
бы с патогенами из окружающей среды. В указанном периоде проявляются врожденные де-
фекты иммунного статуса, что может стать причиной возникновения различных заболеваний.
Напр., аутоиммунный диатез, болезнь иммунных комплексов. Таким образом, у детей, особе-
нно с врожденным иммунным дефектом, в возрасте 2-х и 4-6 –лет существует высокий риск
возникновения инфекционных и аллергических заболеваний.
Развитие третьего иммунного кризиса у всех детей и подростков связано с резкими гор-
мональными изменениями. У девочек этот этап начинается с 12-13 лет, а у мальчиков – с 14 –
