
РАЗОБРАННЫЕ БИЛЕТЫ
.pdf
Билет 1. сжать
1.Геномика и протеомика: предмет изучения и основные направления исследований. Основные методы геномики и протеомики.
|
|
Геномика |
|
|
|
Протеомика |
|
|
|||
|
|
|
|
Предмет изучения |
|
|
|
|
|||
Исследует |
геномы |
|
организмов. |
Исследует совокупность белков организма – |
|||||||
Транскриптомы. |
|
|
|
протеома. |
|
|
|
|
|||
|
|
|
|
Направления |
|
|
|
|
|||
Картирование, секвенирование, анализ |
Характеризация всех белков организма или |
||||||||||
генома. |
|
|
|
|
исследование структуры и функции белка. |
||||||
|
|
|
|
|
Разделы |
|
|
|
|
|
|
Структурная |
геномика: |
изучение |
Структурная |
протеомика: |
изучение |
||||||
структуры всех генов и их организации |
структуры всех белков и их распределение в |
||||||||||
на хромосоме |
|
|
|
|
клетке |
|
|
|
|
||
Функциональная |
|
геномика: |
Функциональная протеомика: исследование |
||||||||
исследование функции всех генов и их |
функции всех белков, их взаимодействие |
||||||||||
роли в регуляции метаболизма клетки |
|
друг с другом и другими биомолекулами |
|||||||||
|
|
|
|
|
|
Экспрессионная |
протеомика: |
изучение |
|||
|
|
|
|
|
|
качественного и количественного уровней |
|||||
|
|
|
|
|
|
экспрессии белков в клетке на различных |
|||||
|
|
|
|
|
|
стадиях развития и в различных условиях |
|||||
|
|
|
|
|
Методы |
|
|
|
|
|
|
1. Прямое секвенирование генов и |
1. |
Выделение |
|
|
|
белков, |
|||||
|
полигеномное секвенирование |
|
|
электрофоретическое |
|
разделение, |
|||||
2. |
Конструирование |
|
и |
|
расщепление на мелкие фрагменты, |
||||||
|
идентификация |
экспрессионных |
|
масс-спектрометрия для определения |
|||||||
|
фрагментов |
|
|
|
|
последовательностей, |
идентификация |
||||
3. |
Анализ и интерпретация данных |
|
по стандартным базам данных |
||||||||
|
секвенирования |
|
при |
2. |
Предсказание |
и |
идентификация |
||||
|
использовании |
баз |
данных |
и |
|
пространственной структуры белков |
|||||
|
программного обеспечения. |
|
3. Исследование |
экспрессии белков и |
|||||||
4. |
Эволюционный |
|
анализ |
– |
|
экспрессионных профилей клеток на |
|||||
|
выяснение |
функций |
и |
|
микрочипах (микроэрреи) |
|
|||||
|
взаимодействия генов в пределах |
|
|
|
|
|
|
||||
|
генома. |
|
|
|
|
|
|
|
|
|
|
2.Анализ сложных белковых смесей: гель электрофорез и двумерный гельэлектрофорез. Принцип метода и его применение.
Электрофорез – метод разделения макромолекул (белков и нуклеиновых кислот) в свободном водном растворе и пористом матриксе, в качестве которого можно использовать полисахариды, например, крахмал или агарозу.
Биомолекулы обычно несут суммарный положительный или отрицательный заряд, обусловленный наличием на их поверхности положительно или отрицательно заряженных групп аминокислот. Если белковые молекулы поместить в электрическое поле, они начинают перемещаться со скоростью, которая определяется их суммарным зарядом, а также формой и размерами.
Агарозный: разрешение не такое большое, но бОльшие фрагменты – до 1000 о.н. • прочность • крупнопористость (позволяющая разделять особенно крупные молекулы, в частности нуклеиновые кислоты); • приготовление агарозного геля значительно проще, чем крахмального и полиакриламидного; • относительно небольшая продолжительность электрофореза (сильно варьирует в зависимости от варианта метода); • относительная дешевизна метода.
Полиакриламидный: разделение небольших фрагментов ДНК (до 500 о.н), но большое разрешение
Гель-электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия (ДСН-ПААГ). При использовании данного метода белки мигрируют в инертном матриксе-полиакриламидном геле с высоким содержанием поперечных сшивок. Обычно гель готовят полимеризацией мономеров непосредственно перед использованием. Размеры пор геля могут быть подобраны произвольно с тем, чтобы гель мог замедлить миграцию определенных молекул. При этом белки находятся в растворе, содержащем мощный, отрицательно заряженный детергент – додецилсульфат натрия или ДСН (SDS). Связываясь с гидрофобными участками белковой молекулы, этот детергент вызывает развертывание белковых молекул в длинные вытянутые цепи. Каждая молекула белка связывает значительное количество молекул детергента, приобретая суммарный отрицательный заряд. По этой причине белок после того, как будет приложено напряжение, начнет двигаться в направлении положительного электрода. Белки одного размера ведут себя сходным образом, поскольку, во-первых, их природная структура полностью нарушена ДСН так, что их форма идентична, во-вторых, они связывают одинаковое количество ДСН и приобретают одинаковый негативный заряд. Крупные белки, обладающие большим зарядом, подвергаются действию значительных электрических сил, а также более существенному торможению. В порах полиакриламидного геля, действующего как молекулярное сито, большие молекулы тормозятся значительно сильнее, чем малые, поэтому оказываются ближе к стартовой линии. Смесь молекул делится на ряд полос, расположенных в соответствии с их молекулярной массой. Выявить эти полосы можно путем окрашивания соответствующим красителем. Например, белки идентифицируются красителем кумасси синим. Известно, что близко расположенные полосы в геле могут перекрываться. Этот эффект препятствует выявлению большого количества белков (не больше 50) с помощью одномерных методов их разделения.
Электрофорезные гели калибруют с помощью смеси молекул с известной массой и, используя полученные калибровочные кривые, устанавливают размер молекул исследуемого вещества.
Гель-электрофорез применяют не только для определения молекулярной массы отдельного вещества, но и для определения чистоты полученного препарата: если в образце имеются примесные белки, то на картинке электрофореза будут наблюдаться несколько зон или полос.
Двумерный: объединены две различные процедуры разделения, позволяет идентифицировать более 1 000 белков.
Первое измерение — разделение белков на основе их электрического заряда методом изоэлектрического фокусирования. Второе измерение — разделение белков на основе их молекулярного веса.
Результаты при этом получают в виде «двумерной» белковой карты. При работе данным методом на первом этапе белки разделяют по их заряду. Для этого образец помещают в небольшой объем раствора, содержащего неионный (незаряженный)
детергент – меркаптоэтанол, и в качестве денатурирующего агента – мочевину -
денатурация и диссоциация всех без исключения полипептидных цепей; при этом изменения заряда цепей не происходит. Диссоциированные полипептидные цепи разделяют затем методом изоэлектрического фокусирования, основанном на изменении заряда белковой молекулы при изменении рН окружающей среды. Каждый из белков может быть охарактеризован изоэлектрической точкой – значением рН, при котором суммарный заряд белковой молекулы равен нулю, и, следовательно, белок не способен перемещаться под действием электрического поля. При изоэлектрическом фокусировании белки подвергаются электрофорезу в геле, в котором с помощью специальных буферов создается градиент рН. Под действием электрического поля каждый белок перемещается в ту зону градиента, которая соответствует его изоэлектрической точке и остается в ней. Так происходит разделение белков в одном направлении двумерного гель-электрофореза. На втором этапе гель, содержащий разделенные белки, снова подвергается электрофорезу, на этот раз в направлении, перпендикулярном тому, что был на первом этапе. В этом случае электрофорез ведут в присутствии ДСН, и белки разделяют по их молекулярной массе, как в одномерном ДСН-ПААГ. Исходный гель пропитывают додецилсульфатом натрия и, поместив его на блок ДСН-ПААГ-геля, проводят электрофорез, в ходе которого каждая из полипептидных цепей мигрирует сквозь блок геля и образует в нем отдельную полосу. Неразделенными в результате остаются только те белки, которые неразличимы как по изоэлектрической точке, так и по молекулярной массе; такое сочетание встречается очень редко.

Билет 2.
1.Основные признаки и общая структура прокариотического гена. Структура эукариотического гена.
Ген – транскрибируемый фрагмент ДНК/РНК, кодирующий полипептид или функциональные РНК (рРНК, тРНК, мРНК, малые ядерные РНК).
Устойчивость генетического материала обеспечивается: диплоидным набором хромосом; двойной спиралью ДНК; вырожденностью генетического кода; повтором некоторых генов; репарацией нарушенной структуры ДНК.
Обязательные структурные признаки гена – наличие промотора и терминатора.
Центральная догма молекулярной биологии —правило реализации генетической информации: информация передаётся от нуклеиновых кислот к белку, но не в обратном направлении
Транскрипция: ДНК -> РНК (ДНК-зависимой РНК-полимеразой – мРНК) Обратная транскрипция: РНК -> ДНК (обратной транскриптазой, ревертазой) Трансляция: РНК -> белок (мРНК на рибосомах)
Общая структура гена:
Промотор – сайт инициации транскрипции РНК-полимеразой. С него начинается синтез РНК.
У прокариот опероны (гены белков, функции которых в метаболизме связаны) с общим промотором и регулятором, у эукариот каждый ген имеет свой промотор и несколько регуляторов
Оператор с сайтом посадки белка-репрессора (выключает и включает работу генаэкспрессию). Оператор сободен – транскрипция идет, нет – транскрипция невозможна, т.к РНК-поллимераза не может соединиться с промотором.
Структурные гены – наличие стартового кодона ATG (Met) и стоп-кодона (ограничение рамки считывания)
Экзоны – кодирующие участки Интроны – некодирующие внутригенные вставки, удаляемые при созревании мРНК
– сплайсинге в ядре. У прокариот практически отсутствуют
Терминатор – находится за структурной частью и сигнализирует об остановке транскрипции
5’->3’,
N-конец -> С-конец
Прокариоты |
Эукариоты |
Есть опероны – несколько генов, |
Практически нет оперонов, вместо них – |
собранные под единый промотор таким |
экзонно-интронный механизм. С гена |
образом, что у них есть единая |
синтезируется при-РНК, потом сплайсинг |
регуляторная область в начале и в конце. С |
– вырезаются интроны (сплайсинг) – |
оперона считывается единая иРНК. С этой |
образ-ся зрелая РНК. Благодаря |
РНК синтезируются несколько разных |
механизму альтернативного сплайсинга |

белков, для каждого из них в иРНК есть |
можно получать разные изоформы белка |
свои старт- и стоп-кодоны. |
с одного гена |
ДНК лежит прямо в цитоплазме клетки => |
Сопряжение трансляции и транскрипции |
возможно сопряжение транскрипции и |
невозможно, так как ДНК лежит в ядре, а |
трансляции, более того, с одной РНК |
также есть механизм сплайсинга |
возможен одновременный синтез сразу |
|
нескольких копий белка разными |
|
рибосомами. (это удобно, например, в |
|
ответе на какой-нибудь стресс, когда мы |
|
должны разом запустить разные механизмы |
|
ответа) |
|
До 90% ДНК это гены, кодирующие белки |
Гены, кодирующие белки – 1-2% от ДНК |
Рибосомы 70S |
Рибосомы 80S |
Могут быть гены-регуляторы – они могут |
|
лежать далеко от самого оперона, и с них |
|
синтезируется белок-репрессор, который |
|
при связывании с опероном прекращает |
|
синтез иРНК. |
|
2.Современные методы установления пространственной структуры белковых молекул (3D). Один из методов подробно.
Любая белковая молекула характеризуется уникальностью структуры (наличием определенных связей, геометрического расположения атомов), которая
определяет уникальность ее функции
1.Рентгеноструктурный (кристаллографический) анализ – основан на получении кристаллов белка и восстановлении структуры электронных плотностей по рентгеновской интерференционной картинке. Позволяет определить пространственные координаты всех атомов исследуемого объекта. При наличии данных о положении отдельных атомов можно вычислить межатомные расстояния, валентные углы, углы вращения вокруг связей, распределение поверхностного заряда и другие детали молекулярной геометрии.
2.Ядерно-магнитный резонанс – для белков в растворе, небольших белков (до 30кДа). ЯМР - резонансное поглощение электромагнитных волн, обусловленное квантовыми переходами атомных ядер между энергетическими состояниями с разными ориентациями спина (магнитного момента) ядра. Преимуществом ЯМР является то обстоятельство, что метод позволяет получать информацию о структуре и динамике молекул в растворе (в таком состоянии они находятся в живом организме) - что принципиально важно для исследований биологических молекул.
3.Криоэлектронная микроскопия – фотографии крупных белковых комплексов (более 120кДа)
4.Компьютерное моделирование (AlphaFold2). На основе известных структур пытаются максимально подобрать подходящую структуру (она выходит усредненной).
*мембранные белки плохо кристаллизуются, потому что очень сильно мешают липиды. Поэтому довольно сложно изучать структуру мембранных каналов или рецепторов, а это очень важная часть современной биологии.
Этапы рентгеноструктурного анализа:
1.Выделение и очистка белка. Необходимо много очень чистого растворимого белка (10-50 мг)
2.Кристаллизация. Необходимо наличие пересыщенного раствора – за счет постепенного испарения растворителя, либо исходя из температурной зависимости растворимости (развести в теплом, остудить – растворимость уменьшится); добавление веществ, понижающих растворимость, изменение pH и др. Для каждого конкретного белка подбираются свои условия кристаллизации. Кристаллы могут расти от нескольких дней до недель. Кристаллы 0,2-0,6 мм, без дефектов и с хорошей огранкой используют на следующем этапе.
Не из всех белков можно вырастить кристалл, поэтому этот этап является ограничителем рентгеноструктурного метода.
3.Рентгеновский эксперимент. В качестве источника рентгеновских лучей – синхротронный ускоритель. Его преимущества: мощность пучка (скорость; разрушение кристаллов под действием x-лучей – можно успеть пока он не разрушился), возможность получить желаемую длину волны (рентгеновские трубки дают пучок фиксированной длины).
Когда x-луч падает на кристалл, рассеяние в кристалле происходит на плоскостях в решетке из атомов. Появляются картины дифракции. Дифракционная картина представляет собой набор точек - рефлексов. Для каждой точки можно определить ее интенсивность и положение.
4.Интерпретация карт распределения электронной плотности. Построение приближенной атомной модели – на основе характеристик связей в исследуемой молекуле и факторов, влияющих на взаимное расположение аминокислотных радикалов.
5.Уточнение структуры математическими методами – последний этап. Цель – улучшить предварительную модель. Этот этап может быть довольно длительным (от нескольких месяцев до года), т.к. необходимо много раз проверять модель. Для этого в основном используются компьютерные программы. Когда атомная модель белка получена, ее оформляют в соответствии со стандартами и помещают в банк белковых структур.
6.Помещение в банк белковых структур – Protein Data Bank.
РСА позволяет:
•Исследовать кристаллизованные белки и их комплексы с другими веществами
•Точнее других методов определять взаимное расположение атомов в кристалле
Трудности:
•Не все белки можно кристаллизовать
•Нужно очень много материала
•Чаще всего необходим синхротрон
•Структура белка в кристалле может быть не природной
Этапы ЯМР-исследования:
1.Выделение и очистка белка
2.Осаждение белка в растворе. К раствору белка добавляется соль (например, сульфат аммония), осаждается осадок с помощью центрифугирования, отбирается супернант, дальше работа с ним. Фильтрация белка, измерение концентрации на спектрофотометре. Может быть стадия очистки белка на гельфильтрационной колонке.
3.Анализ одномерных спектров образца, не обогащенного изотопами – делаются выводы о стабильности образца (анализ изменений с течением времени) при различных температурах и времени жизни образца.
4.После подбора оптимальных условий эксперимента переходят к образцам, меченными по ядрам азота. Из анализа дисперсии сигналов в спектрах 1 и 2 опытов делаются выводы об упорядоченности белка, т.е. о наличии участков с вторичной структурой. Наличие участков со вторичной структурой в виде спиралей или β-складок приводит к тому, что химические сдвиги сигналов атомов этих участков сильно отличаются от неупорядоченных частей белка за счет характерных различий в химическом окружении.
5.После того, как все условия подобраны, переходят к подготовке и анализу образца белка, обогащенного изотопами углерода и азота и регистрации трехмерных спектров. На основе полученных спектров (от 5-6 экспериментов, продолжительность каждого ~ 1 день), производится отнесение сигналов, и получают таблицу химических сдвигов ядер, т.е. информацию о резонансной частоте каждого ядра.
За счет того, что структура и химический состав аминокислотных остатков различны, это приводит к отличиям в химических сдвигах ядер атомов их функциональных групп. Наиболее характерными являются сигналы глицина, трионина и серина.
Криоэлектронная микросокпия:
Электронный микроскоп — это аналог оптического микроскопа, использующий пучок быстрых электронов вместо света. Разрешающая способность обычных микроскопов ограничена длиной волны света и составляет около 200 нм; применение быстрых электронов позволяет повысить разрешение до 0,05 нм. Чтобы получить изображение, молекулы нужно зафиксировать, а вокруг образца создать высокий вакуум. Для этого объект замораживают при температуре жидкого азота, что и называется криоэлектронной микроскопией. Если заморозку провести достаточно быстро, то удастся получить любую макромолекулу в естественном окружении — в растворе, в
отличие от кристаллографических методов или методов негативного контраста, когда высушенный образец обрабатывается антителами или другими агентами.
При исследовании биомолекул электронным микроскопом получается набор двумерных изображений, соответствующих различным ориентациям молекулы. Если ранее эти двумерные изображения и были финалом исследования, то сейчас появились вычислительные методы анализа двумерных проекций молекулы, восстановления трехмерного распределения электронной плотности и, следовательно, получения трехмерной структуры белка или нуклеиновой кислоты. Набирает сумасшедшую популярность в последние 2–3 года, особенно в применении к мембранным белкам большого размера.
Метод имеет только один существенный недостаток: им нельзя работать с «маленькими» объектами массой менее 60 000 атомных единиц — из-за низкой контрастности изображений и сложности анализа проекций.
Компьютерный анализ позволяет предсказать или определить:
-Клеточную локализацию по наличию молекулярного адреса (секретируемый, митохондриальный, мембранный, ЭР и т.д.)
-Предсказание продуктов расщепления протеазами
-Предсказать физико-химические параметры: Mr, pI и др.
-Профиль гидрофильности /гиброфобности, трансмембр уч-ки.
-Посттрансляционные модификации (фосфорилирование,
гликозилирование и т.д.)
-Функциональные домены, принадлежность к опр. белковым функциональным семействам.
-Фолдинг
Билет 3.
1.Технологии рекомбинантных ДНК. Рестрицирующие эндонуклеазы и другие ферменты для молекулярного клонирования.
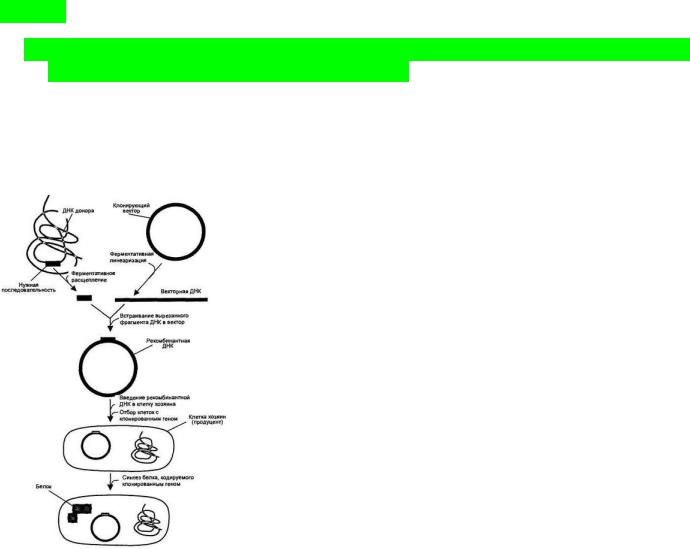
Технология рекомбинантных ДНК (также молекулярное клонирование или генная инженерия) – это совокупность экспериментальных процедур, позволяющих осуществлять перенос генетического материала (ДНК) из одного организма в другой, где он будет успешно работать.
Молекулярное клонирование ДНК включают следующие этапы:
1.Получение нужной последовательности. ДНК для клонирования может быть получена химико-ферментативным синтезом, обратной транскрипцией мРНК и путем непосредственного расщепления геномной ДНК нужной рестрикционной эндонуклеазой. Но самый распространенный путь – синтез ДНК методом ПЦР.
2.После отработки рестриктазами полученный ген соединяют с клонирующим вектором с образованием новой, рекомбинантной молекулы – конструкция «клонирующий вектор – встроенная ДНК».
3.Полученную рекомбинантную конструкцию вводят в
клетку -мишень, где она реплицируется и передается потомкам. Этот процесс – трансформация (прокариоты, дрожжи) и трансфекция (эукариоты). Процесс встраивания фрагмента в плазмиду и трансформация плазмиды в клетке приводит к появлению трех типов клеток: не содержащие плазмиды, содержащие плазмиду без встройки и содержащие плазмиду со
встройкой.
4.Используя селективный маркер, идентифицируют и отбирают клетки, несущие рекомбинантную ДНК. Маркером может служить устойчивость к антибиотикам. Клетки, не содержащие плазмидную конструкцию, не способны расти на среде с антибиотиками и погибают. Этот метод позволяет эффективно отделить трансформированные клетки от нетрансформированных, но не позволяет отделить клетки, несущие плазмиду с целевым геном, от клеток с «пустой» плазмидой.
5.Получают специфический белковый продукт, синтезированный клетками-хозяевами, что служит подтверждением клонирования искомого гена.
Конструирование рекомбинантных молекул осуществляется с помощью ряда ферментов.
ДНК для клонирования может быть получена химико-ферментативным синтезом, обратной транскрипцией мРНК и путем непосредственного расщепления геномной ДНК нужной рестрикционной эндонуклеазой. Но самый распространенный путь сейчас – синтез ДНК методом ПЦР.
Рестриктазы.
1 класс |
2 класс – используется в ГИ |
3 класс |
узнают |
|
определённую |
узнают |
определённую |
узнают |
|
нужную |
||
последовательность |
нуклеотидов и |
последовательность |
и |
разрезают |
последовательность и разрезают |
||||
разрезают двухцепочную молекулу |
двойную спираль ДНК в определённой |
двухцепочную молекулу |
ДНК, |
||||||
ДНК |
неподалёку |
от |
этой |
фиксированной точке |
|
внутри этой |
отступив |
определённое |
число |
последовательности в произвольной |
последовательности. |
|
|
нуклеотидных пар от её конца |
|||||
точке и само место разреза не строго |
|
|
|
|
|
|
|||
специально |
|
|
|
|
|
|
|
|
|
Каждый фермент рестрицирующих эндонуклеаз «опознает» в ДНК специфическую последовательность из 4-6 нуклеотидов. ДНК бактерии в сайтах рестрикции модифицирована метилированием, так что фрагмент рестрикции не может порезать собственную ДНК (а ДНК вирусов не защищена, и ферменты ее расщепляют). Многие рестрицирующие эндонуклеазы вносят разрывы в две цепи ДНК со смещением на несколько нуклеотидов, располагаясь наискось друг от друга. В результате образуются одноцепочечные комплементарные концы с «хвостами» из 4-х нуклеотидов в каждом («липкие» концы). Кроме рестриктаз, расщепляющих нуклеотидную цепь с образованием липких концов, существуют рестриктазы, вносящие разрывы в цепи строго друг против друга с образованием ДНК с «тупыми концами».
ДНК-лигаза. Используется для устранения разрыва между двумя объединившимися фрагментами ДНК. Катализирует образование фосфодиэфирных связей между концами полинуклеотидных цепей, которые удерживаются вместе при спаривании липких концов. ДНК-лигаза сшивает и тупые концы. ДНК-лигаза бактериофага Т4.
ДНК-полимеразы синтезируют полинуклеотидные цепи ДНК на основе одноцепочечных ДНК. Они используются в генной инжерении для полимеразной цепной реакции и связанных методов. Есть термостабильные типы (Taq-полимераза).
РНК-зависимая ДНК-полимераза (ревертаза) осуществляет синтез ДНК на матрице РНК. В генной инженерии используется для целенаправленного синтеза на матричных РНК комплементарных молекул ДНК.
Полинуклеотидкиназа осуществляет перенос гамма-фосфатных групп ATP на 5'-OH группы ДНК или РНК. Используется для введения радиоактивной метки в ДНК или РНК для получения радиоактивно меченных зондов или секвенирования нуклеиновых кислот.
Фосфатаза катализирует удаление 5'-фосфатных групп ДНК или РНК, а также расщепление макроэргических связей РНК и ДНК. Их используют при подготовке фрагментов нуклеиновых кислот к введению 5'-концевой радиоактивной метки.
Нуклеазы. Экзонуклеазы отщепляют концевые нуклеотиды от полинуклеотидной цепи путем гидролиза связей между ними. Есть 3’- и 5‘-концевые. Эндонуклеазы расщепляют фосфодиэфирные связи в середине полинуклеотидной цепи. Нуклеазы часто используют в генной инженерии для создания рекомбинантных ДНК. Специфичны к ДНК или РНК, или к тому и другому.
