
РАЗОБРАННЫЕ БИЛЕТЫ
.pdf3.Сорбция, в том числе на аффинных и ионных сорбентах (хроматографические методы – ниже)
4.Использование молекулярных сит.
Молекулярные сита — кристаллические алюмосиликаты, имеющие трёхмерную структуру из тетраэдров оксида кремния и оксида алюминия и характеризующиеся точным и однородным размером пор. Поры в молекулярных ситах достаточно велики, чтобы пропускать небольшие молекулы, но в то же время они задерживают более крупные молекулы, что определило их использование в качестве осушителей и адсорбентов.
Основные методы разделения:
1.Хроматография – распределение компонентов между подвижной и неподвижной фазами
2.Гель-электрофорез – основан на различии в скорости движения белков в электрическом поле, белки разделяются по размеру
3.Двумерный гель-электрофорез – изоэлектрическое фокусирование (сначала делятся по изоэлектрической точке в pH градиенте, а после по массе). Можно разделить до 2000 белков единовременно.
4.Масс-спектрометрия – основана на ионизации молекул веществ, разделении образующихся ионов и их регистрации. Зависимость интенсивности ионного тока (количества) от отношения массы к заряду молекул.
5.Хромато-масс-спектрометрия: разделение сложной смеси на отдельные компоненты путем хроматографии; масс-спектрометрия; идентификация веществ при помощи набора библиотек спектров веществ.
Очистку проводят также хроматографией, либо вымыванием из геля.
Билет 8.
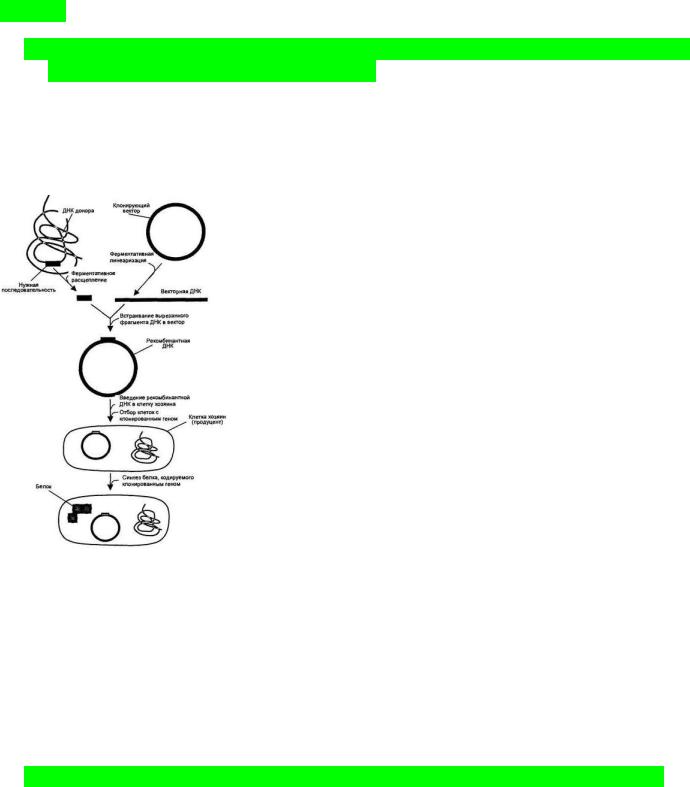
1.Общая схема молекулярного клонирования на примере трансформации бактерий плазмидным рекомбинантным вектором.
Технология рекомбинантных ДНК (также молекулярное клонирование или генная инженерия) – это совокупность экспериментальных процедур, позволяющих осуществлять перенос генетического материала (ДНК) из одного организма в другой, где он будет успешно работать.
Молекулярное клонирование ДНК включают следующие этапы:
1.Получение нужной последовательности. ДНК для клонирования может быть получена химико-ферментативным синтезом, обратной транскрипцией мРНК и путем непосредственного расщепления геномной ДНК нужной рестрикционной эндонуклеазой. Но самый распространенный путь – синтез ДНК методом ПЦР.
2.После отработки рестриктазами полученный ген соединяют с клонирующим вектором с образованием новой, рекомбинантной молекулы – конструкция «клонирующий вектор – встроенная ДНК».
3.Полученную рекомбинантную конструкцию вводят в
клетку -мишень, где она реплицируется и передается потомкам. Этот процесс – трансформация (прокариоты, дрожжи) и трансфекция (эукариоты). Процесс встраивания фрагмента в плазмиду и трансформация плазмиды в клетке приводит к появлению трех типов клеток: не содержащие плазмиды, содержащие плазмиду без встройки и содержащие плазмиду со
встройкой.
4.Используя селективный маркер, идентифицируют и отбирают клетки, несущие рекомбинантную ДНК. Маркером может служить устойчивость к антибиотикам. Клетки, не содержащие плазмидную конструкцию, не способны расти на среде с антибиотиками и погибают. Этот метод позволяет эффективно отделить трансформированные клетки от нетрансформированных, но не позволяет отделить клетки, несущие плазмиду с целевым геном, от клеток с «пустой» плазмидой.
5.Получают специфический белковый продукт, синтезированный клетками-хозяевами, что служит подтверждением клонирования искомого гена.
2. Доменная архитектура белков, ее связь с экзон-интронной структурой генов.
Домен — это элемент третичной структуры белка, представляющий собой достаточной стабильную и независимую подструктуру белка, чей фолдинг происходит независимо от остальных частей. Один домен может появляться во множестве разных белков. Поскольку они независимы друг от друга, домены можно «поменять» с помощью генной инженерии между одним белком и другим, чтобы получить химерные белки.
функциональный |
|
структурный |
|
|
эволюционный |
|
||
Минимальная |
|
часть |
Обособленная |
|
в |
Непрерывный |
участок |
|
полипептидной |
цепи, |
пространстве |
часть |
белка, |
полипептидной |
цепи, |
||
способная к |
самосборке в |
способная |
к самосборке в |
эволюционирующий |
||||
нативную |
структуру |
и |
нативную |
|
структуру, |
существенно |
медленнее |
|
обладающую той же целевой |
имеющую |
сравнительно |
других участков, является |
|||||
функцией, что и в составе |
мало контактов с другими |
эволюционной единицей в |
||||||
полноразмерного белка |
|
частями |
|
белка |
и |
перетасовке доменов. |
||
|
|
|
собственное |
гидрофобное |
|
|
||
|
|
|
ядро. |
|
|
|
|
|
Выделяют пять классов структурных доменов:
•исключительно α-спирали,
•почти исключительно βструктура,
•α-спирали, разделенные или альтернирующие вдоль цепи,
•β-структуры, разделенные или альтернирующие вдоль цепи
•домены, не включающие ни α-спирали, ни β-структуры.
Домены – это обычный материал, используемый природой для создания новых последовательностей.
Вотличие от олигомерных белков эти глобулы образованы одной и той же полипептидной цепью. Они соединяются между собой относительно гибкими пептидными перемычками, а также слабыми нековалентными связями, как протомеры в олигомерных белках. Как правило, домены формируются на той полипептидной цепи, которая содержит не менее 200 аминокислот.
Вотличие от олигомерных доменные белки кодируются одним геном. При взаимодействии такого белка с лигандом последний чаще всего располагается между доменами; при этом разные домены в белке могут перемещаться друг относительно друга. Однако каждый из этих доменов может выполнять самостоятельные функции, связываясь со специфическими лигандами. Такие белки называются многофункциональными.
Пример доменного белка – ДНК-полимераза 1. Это непрерывная цепочка, но состоит фактически из двух разных ферментов: собственно Днк-полимеразы (синтезирующей ДНК) и экзонуклеазы (разрушающей ДНК с конца). Эти два домена образуют две независимые компактные частицы, связанные между собою коротким полипептидным мостиком.
Про связь с экзонами интронами Экзоны — участки ДНК, копии которых составляют зрелую РНК. По мнению
некоторых исследователей экзоны соответствуют доменам (структурно автономным
областям) в белке и являются первичными генетическими единицами, перекомбинация которых приводит к возникновению в ходе эволюции новых генов и соответственно новых белков. Экзоны чередуются в структуре гена с другими фрагментами
— интронами.
Интроны – некодирующие участки, экзоны – кодирующие участки.
Соответствия между экзоном и доменом могут быть классифицированы следующим образом:
1.один экзон – один домен
2.несколько экзонов – один домен
3.один экзон – несколько доменов
4.нет точного соответствия (например, домен составлен из частей экзонов). Перетасовка доменов — явление, когда разные гены обмениваются участками,
кодирующими функциональные домены в ходе эволюции. Границы между доменами не всегда совпадают с границами экзонов и интронов. Существуют домены, закодированные более чем одним экзоном и экзоны, кодирующие более одного домена.
Показано, что после перетасовки кодирующая экзонная структура домена белка может изменяться за счет вставок или делеций интронов.
Билет 9.
1.Доставка рекомбинантной ДНК и РНК в клетку. Проблемы экспрессии чужеродных генов и аутентичности рекомбинантных белков.
Существует около 40 способов доставки рекомбинантной ДНК в клетки через плазматическую мембрану. Выбор метода зависит от типа клеток и типа вектора.
Трансформация – поглощение рекомбинантной ДНК компонентными клетками (способными поглощать чужеродную ДНК, их доля в популяции мала, но ее можно повысить, используя питательную среду и химические индукторы), за счет локального разрушения клеточной стенки методом теплового шока (сначла выдерживают с ледяным раствором CaCl2, а затем нагревают до 42гр в течение 1 минуты). Эффективность невысока, и поэтому применяют методы отбора клеток, содержащих рекомбинантную ДНК. Эффективность трансформации зависит от состояния клеток, от качества плазмидной ДНК, ее снижают субъективные ошибки экспериментатора.
Конъюгация. Существуют плазмиды, обладающие способностью создавать межклеточные контакты, через которые они переходят из одной клетки в другую. Конъюгативная плазмида может увлекать за собой обычный плазмидный вектор, находящийся в той же клетке. Таким образом можно трансформировать клетки, с трудом поддающиеся трансформации другими способами. Была продемонстрирована возможность конъюгативного переноса ДНК из бактериальных клеток в культивируемые клетки животных. В процессе конъюгации переносится только одна цепь донорской плазмиды, на которой затем синтезируется вторая цепь. Это приводит к тому, что конъюгативно передаваемая плазмида не подвергается атаке хозяйских рестриктаз. Эффективность этого метода для бактерий сопоставима с трансформацией.
С помощью вирусов. Для внедрения векторов на основе вирусов широко используется природный инфекционный путь заражения клетки-хозяина, который зависит от типа вируса.
Перфорационные методы.
Электропорация – временное создание пор в бислойной липидной мембране под кратким воздействием электрического поля. Является универсальным физическим методом трансформации, методика которого разработана практически для всех типов клеток. наиболее простой, эффективный и воспроизводимый метод введения молекул ДНК в клетки, требующий, однако, специального прибора электропоратора.
Другие перфорационные методы доставки ДНК в клетку: обработка клеток ультразвуком,
соскабливание клеток с субстрата в присутствии экзогенного материала, центрифугирование клеток в среде с ДНК в сочетании с электропорацией, осмотическая перфорация плазматической мембраны, пробой клетки лазерным микролучом, использование порообразующего токсина стрептолизина-O.
Трансфекция. Введение любой чужеродной ДНК в эукариотические клетки с помощью различных химических реагентов. инкубация ДНК с ДЕАЕ-декстраном (он связывается с ДНК и с клеточной мембраной, стимулируя пиноцитоз, хотя сам клетками не захватывается, недостатки – токсичность для некоторых типов клеток, зависимость эффективности от качества препарата, очень малая частота получения стабильных трансфектантов. Кальций-фосфатный метод более эффективен и дешев, но вызывает разрыв молекул ДНК, что переводит кольцевые молекулы в линейную форму, иногда неинфекционную в случае трансфекции вирусов. Кроме того, условия кальций-фосфатной трансфекции приходится подбирать для каждых клеток-мишеней индивидуально. Полимерные катиооны – образуют с нуклеиновыми кислотами комплекы с нейтрализованными зарядами, которые могут с высокой эффективностью транспортировать ДНК и РНК внутрь клетки. Катионный липид – очень эффективен. (подробнее в методичке Марковой на странице 68 и далее)
Липосомы. Доставка на основе фосфолипидных липосом, начиненных ДНК или РНК. Маленькие сферы из искусственных мембран могут сливаться с плазматическими мембранами клеток или поглощаться эндоцитозом, высвобождая содержимое внутрь клетки. Довольно капризные метод и требует тщательного подбора всех условий для эффективной трансфекции конкретных клеток,+ изза обработки ультразвуком для инкапсулирования разрушаются крупные ДНК.
Микроинъекция. Клеточная мембрана прокалывается микроиглой и раствор, содержащий ДНК, вводится в цитоплазму клетки или напрямую в ядро, если ядро достаточно большое (например, ядро яйцеклетки).Очень эффективно, можно вводить любую ДНК в любые клетки, не требуется селективного давления.
Баллистическая трансфекция (биобаллистика) основана на обстреле клеток микросферами покрытых ДНК. Микрочастицы, покрытые ДНК, проходят через клеточные слои и переносят генетическую конструкцию непосредственно в органеллы и ядра клеток. Очень эффективна даже там, где есть толстые клеточные стенки, используется в генотерапии, для получения трансгенных организмов.
Лиганд-опосредованная доставка. Более эффективная и адресная доставка в специфические клетки-мишени нуклеиновых кислот путем введения в структуру синтетических трансфекционных реагентов и липосом различных лигандов для связывания с мембранными белками-рецепторами. Наличие таких адресных групп (лигандов), узнаваемых клеточными рецепторами, позволяет использовать механизмы лиганд-опосредованного эндоцитоза. В качестве таких лигандов используют белки и пептиды, узнаваемые рецепторами; олигосахариды, поскольку на поверхности многих животных клеток присутствуют лектины -белки-рецепторы, специфически их связывающие; полисахариды. Процессы взаимодействия с клетками таких адресных комплексов ДНК(РНК)-трансфекционный реагент имеют сходство с проникновением в клетку вирусных частиц.
После введения рекомбинантной ДНК в эукариотическую клетку, лишь ее малая часть оказывается в ядре, поскольку ядерная мембрана является труднопреодолимым барьером для чужеродной ДНК. В ядре рекомбинантная ДНК может быть интегрирована в хромосому или некоторое время существовать во внехромосомном состоянии.
Стабильная трансфекция |
|
Временная (транзиентная) |
|
|
|||
рекомбинантные ДНК интегрируются в |
молекулы |
рекомбинантной |
ДНК |
||||
хромосомы |
клеток-реципиентов |
и |
существуют и транскрибируются в ядрах |
||||
становятся их неотъемлемой частью |
|
во |
внехромосомном |
состоянии |
|||
|
|
|
непродолжительное время |
|
|
||
Стабильное наследование – основное условие получения трансгенных организмов для хозяйственных целей. Большой процент стабильных трансформантов, также позволяет отказаться от селективных и маркерных генов, являющихся балластными при создании трансгенных организмов.
Чем проще организм, тем проще и дешевле культивирование его клеток. Самым простым вариантом экспрессии является бактериальная экспрессия, но в прокариотических организмах невозможны многие посттрансляционные модификации. Кроме того, часто невозможно обеспечить правильное сворачивание (правильный фолдинг) многих эукариотических белков. Неспособность прокариот синтезировать аутентичные варианты белков обусловлена в основном отсутствием у них адекватных механизмов внесения специфических посттрансляционных модификаций.
Пострансляционные модификации, с которыми возникают проблемы:
1.Образование дисульфидных связей. Эту реакцию катализирует фермент дисульфидизомераза. Неправильно уложенный белок оказывается нестабильным и неактивным.
2.Протеолитическое расщепление предшественника, удаление определенного участка полипептидной цепи с образованием функционально активного белка.
3.Гликозилирование – основная модификация, благодаря которой белки приобретают стабильность, а в некоторых случаях – особые свойства. Наиболее распространенная реакция гликолизирования – это присоединение специфического сахарного остатка либо к серину или треонину (О-гликозилирование), либо к аспарагину (N-гликолизирование).
4.Модификации аминокислот в составе белка: фосфорилирование, ацетилирование, ацилирование, гамма-карбоксилирование, сульфатирование, миристилирование, пальмитоилирование и др.
Клетки дрожжей, млекопит-щих и насекомых могут осуществлять часть или все посттрансляционные модификации синтезируемых рекомбинантных белков, но их использование в качестве биопродуцентов ограничено высокой себестоимостью выхода рекомбинантных белков по сравнению с прокариотическими клетками.
В настоящее время не существует единого алгоритма получения рекомбинантного функционально активного белка в больших количествах. Имеются только самые общие рекомендации по выбору экспрессионной системы в зависимости от размеров, структуры белка, его свойств и наличия у него посттрансляционных модификаций. Общей практикой является эмпирический подбор экспрессионной системы для каждого конкретного белка, когда пробуются все имеющиеся в распоряжении исследователя экспрессионные системы от E. coli до клеток млекопитающих (в случае сложных белков).
Уровень экспрессии чужеродного гена также зависит от конструкции экспрессионной кассеты вектора. Коммерческие векторы обычно содержат в составе экспрессионной кассеты весь необходимый набор регуляторных элементов для высокоэффективной генной экспрессии в конкретной клетке-мишени (или универсальные элементы для нескольких хозяев). Регуляторные элементы чужеродного гена, если таковые у него имеются, должны хорошо работать в клетке-хозяине. Помимо этого, для лучшей экспрессии гена на уровне трансляции мРНК желательно приблизить набор кодонов к типичному для клетки-хозяина. Обычно для этого посредством направленных точечных мутаций заменяют «редкие» кодоны на синонимичные «частые», что не сказывается на первичной структуре белка. В результате экспрессия гена в различных системах может быть усилена до 300 раз. Иногда в структурной части генов могут присутствовать какие-либо нежелательные сигнальные последовательности, например, узнаваемые на уровне мРНК ферментами сплайсинга или деградации в случае эукариотической экспрессии, или терминаторы транскрипции для прокариотической экспрессии, сигналы, узнаваемые ферментами модификации на

уровне белка. Наличие таких скрытых («криптических») сигналов ведет к резкому снижению экспрессии гена в клетке-хозяине, поэтому их обычно удаляют также путем точечных замен оснований.
2. Анализ неизвестного белка по последовательности и возможность установления его функции. Консервативность пространственной структуры белков.
Анализ в большинстве случаев проводится с использованием компьютерных программ и белковых баз данных. Компьютерный анализ позволяет предсказать
или определить:
- Клеточную локализацию по наличию молекулярного адреса (секретируемый, митохондриальный, мембранный, ЭР и т.д.) - Предсказание продуктов расщепления протеазами - Предсказать физико-химические параметры: Mr, pI и др. - Профиль гидрофильности /гиброфобности, трансмембр уч-ки. - Посттрансляционные модификации (фосфорилирование, гликозилирование и т.д.) - Функциональные домены, принадлежность к опр. Белковым функциональным семействам. - Фолдинг
Методы:
•Основанные на гомологии. Белки, имеющие сходные последовательности, как правило, являются гомологичными и, стало быть, имеют сходную функцию. Поэтому в недавно секвенированных геномах белки обычно аннотируют по аналогии с последовательностями схожих белков из других геномов. Однако не всегда близкородственные белки выполняют одну и ту же функцию, например, дрожжевые белки Gal1 и Gal3 являются паралогами с 73 % и 92 % сходства, приобретшие в ходе эволюции очень разные функции: так, Gal1 является галактокиназой, а Gal3 — индуктором транскрипции.
•Основанные на мотивах последовательностей. Можно находить в искомой последовательности уже известные домены для предположения возможных функций. Также, внутри самих белковых доменов содержатся более короткие характерные последовательности, связанные с определенными функциями (так называемые мотивы), наличие которых в искомом белке можно определить поиском в базах данных мотивов, таких как PROSITE. Мотивы также могут быть использованы для предсказания внутриклеточной локализации белка: наличие особых коротких сигнальных пептидов предопределяет, в какие органеллы белок будет транспортирован после синтеза, и было разработано множество ресурсов для определения таких сигнальных последовательностей, например, SignalP, который обновлялся несколько раз по мере развития методов. Таким образом, некоторые особенности функции белков можно предсказать без сравнения с полноразмерными гомологичными последовательностями.
•Основанные на геномном контексте. Основаны не на сравнении последовательностей или структуры, как описанные ранее, а на корреляции
между новыми генами/белками и уже аннотированными: для каждого гена составляется филогенетический профиль (по наличию или отсутствию в различных геномах), которые затем сравнивают для установления функциональных связей (предполагается, что гены с одинаковыми профилями функциональны связаны друг с другом).
Компьютерные программы расчёта 2020 – программа AlphaFold2 с элементами ИИ. Для определения структуры белка – а значит и предположения его функций.
Сейчас разработчики представили вторую, улучшенную версию алгоритма — AlphaFold 2. Конечную последовательность аминокислот в белке он рассматривает в виде графа, где вершины — это аминокислотные остатки, а ребра — связи между ними. Задача алгоритма— определить связи между аминокислотными остатками, учитывая уже известных похожих и эволюционно родственных белков. После этого из получившихся связей выстраивается конечная трехмерная структура белка
Для разработки AlphaFold2 исследователи использовали данные о структурах примерно 170 тысяч белков, а весь процесс обучения занял несколько недель, что, по словам разработчиков, не так много. Точность работы алгоритма: AlphaFold2 занял первое место, набрав 92,4 из 100 возможных баллов (оценка — процент правильно расположенных аминокислотных остатков в цепочке белка). Погрешность расположения остатков в свернутой алгоритмом структуре сопоставима с экспериментальными методами.
Моделирование на основании гомологии.
1.Идентификация структурного шаблона — белка с известной пространственной структурой, гомологичного моделируемому (идентичность последовательностей >30%). Поиск производится с помощью серверов FASTA или PSI-BLAST (или их аналогов) в базе структур белков PDB (едином депозитарии структурных данных для биомакромолекул);
2.Построение выравнивания аминокислотных последовательностей шаблонмодель.
Парное выравнивание служит «инструкцией» программам, осуществляющим моделирование.
Множественное выравнивание может быть полезно для выявления консервативных остатков во всём семействе (показаны звёздочкой) или отдельных подсемействах белков (три верхних последовательности — рецепторы мелатонина). Множественное выравнивание и профили последовательностей позволяют идентифицировать более слабые гомологии, чем «обыкновенное» парное
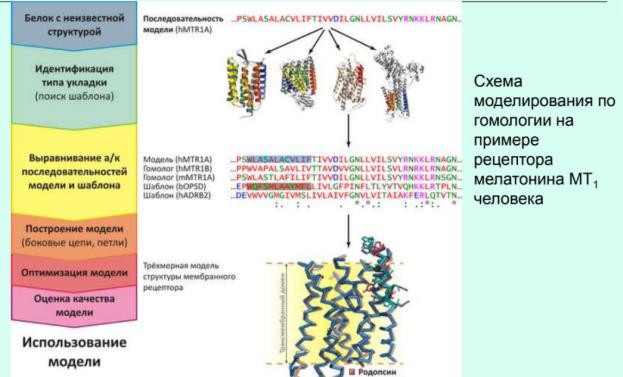
выравнивание. Выравнивание проводят с помощью сервера CLUSTALW (или его аналогов);
3.Построение модели заключается, главным образом, в «натягивании» последовательности моделируемого белка (рецептора мелатонина MT1) на «остов» шаблона (зрительного родопсина) согласно выравниванию. «Петлевые» участки (не имеющие гомологии с шаблоном) достраиваются независимо, положение боковых цепей оптимизируется с помощью методов эмпирических силовых полей. В первом трансмембранном сегменте наложенных структур модели и шаблона показаны боковые цепи остатков, «подсвеченных» на выравнивании. Моделирование проводят с помощью программы Modeller (и аналогичных ей) или сервера Swiss-Model (и ему подобных). В онлайн-базах ModBase и Swiss-Model Repositoryсодержатся автоматически построенные модели для всех белков из базы Swiss-Prot, для которых удаётся найти
структурный |
шаблон; |
4.Оценка качества, оптимизация и использование модели. Самый сложный этап моделирования по гомологии — оптимизировать модель с учётом всей доступной биологической информации по моделируемому белку. Вообще, моделирование структуры по гомологии с белком, выполняющим отличную функцию, не способно автоматически дать модель, пригодную для практически важных задач. Обязательно требуется аккуратная оптимизация, превращающая «заготовку» (которой, по сути, является модель «нулевого приближения») в рабочий инструмент, — задача, зависящая скорее от интуиции и опыта исследователя, чем от конкретных компьютерных методик.
В процессе проводимого уже около 15 лет с двухгодичным интервалом всемирного «соревнования» по предсказанию структуры белков — CASP
