
РАЗОБРАННЫЕ БИЛЕТЫ
.pdf
(Critical Assessment of Techniques for Protein Structure Prediction) — выяснилось,
что эмпирическим «барьером» можно считать 30%-идентичность. То есть, если последовательности белков идентичны более чем на 30% — то, скорее всего, их структуры будут похожими и качество итоговых моделей будет удовлетворительным. Если же гомология низка, то накопившиеся структурные отличия, скорее всего, уже слишком велики для аккуратного моделирования, или
— больше того — реальной гомологии между двумя белками нет никакой, а наблюдаемый уровень идентичности последовательностей является лишь случайным событием.
В случае низкой гомологии часто используют методики поиска по профилям последовательностей, в которых для «запроса» к базе последовательностей используется не одиночная последовательность, а профиль, сконструированный на основе множественного выравнивания — своеобразная метапоследовательность, кодирующая в себе эволюционную вариабельность данного белка. С помощью этой методики иногда удаётся «вычислить» пригодный для моделирования структурный шаблон, несмотря на то, что идентичность последовательностей с ним составляет лишь 10–15%.
Область применения предсказанных структур белков довольно разнообразна, и они оказываются полезными на различных этапах процесса разработки фармацевтических препаратов.
Консервативность пространственной структуры белка.
Высококонсервативные белки часто необходимы для таких фундаментальных процессов, как жизнедеятельность и деление клетки.
Консервативность белковой последовательности можно определить по наличию одинаковых аминокислот в аналогичных частях белков.
Консервативность же белковой структуры определяется наличием функционально эквивалентных, но не обязательно одинаковых аминокислот в аналогичных частях белков. Даже не очень сильного сходства последовательностей достаточно для очень хорошего сходства пространственных структур: как говорят, пространственная структура более консервативна, чем аминокислотная последовательность.
Фолдинг белка – важная тема в биологии, так как очень много нерешенных вопросов. Фолдинг пытаются проводить в лабораториях, а что бы как -то приблизиться к природному механизму сворачивания, исследователи пытаются выделить в последовательности моделируемого белка структурно консервативные фрагменты (аналогичные тем, что в природе сворачиваются первыми и в дальнейшем уже остаются неизменными) и как бы «собирают мозаику» из этих фрагментов.
Билет 10.

1. Понятие о генетически-модифицированных организмах (ГМО). Перспективы создания и сферы применения ГМ-организмов.
Трансгенные, или генетически модифицированные, организмы (ГМО) – это организмы, постоянный генетический материал которых был изменен методами генной инженерии – например, технологиями молекулярного клонирования. При использовании данных технологий молекулы ДНК из различных источников комбинируют в одну молекулу, образуя новый генный комплекс. Такая новая молекула называется рекомбинантной ДНК. Внедрение различными методами рекомбинантной ДНК в живой организм превращает его в генетически модифицированный. При этом рекомбинантные ДНК становятся составной частью генетического аппарата рецепиентного организма и сообщают ему новые уникальные генетические, биохимические, а затем и физиологические свойства. Такая генетическая модификация, проводимая, как правило, в научных или хозяйственных целях для получения желаемых качеств изменяемого организма, отличается целенаправленным изменением генотипа организма, в отличие от случайных изменений, характерных для естественного и искусственного мутагенеза.
В настоящее время практическая генно-инженерная биотехнология развивается по двум основным направлениям:
1 «Молекулярное разведение (селекция)» (molecular breeding) получение новыми методами хозяйственно ценных организмов.
2 «Молекулярное производство» (molecular farming) направлено на использование трансгенных организмов в качестве биореакторов ценных органических соединений.
ГМО-бактерии: первые ГМО организмы – простота орагнизации генома и манипуляций с клетками.
Направления промышленной микробиологии с использованием ГМ микроорганизмов:
1)производство продуктов биосинтеза трансгенных микроорганизмов, например, антибиотиков, гормонов, ферментов и витаминов;
2)использование биомассы микроорганизмов – производство медицинских вакцин, различных дрожжей, белково-витаминных концентратов и заквасок для получения кисломолочных продуктов и силосования кормов, незаменимых аминокислот (лизин), биопрепараты (стимуляторы роста животных и растений, энтомопатогены, удобрения);
3)биотехнологии, основанные на уникальных способностях некоторых бактерий производить органические кислоты, этанол, углеводы и метан, переработка

некоторых отходов с возможностью получения полезных соединений, в первую очередь горючих газов (биотипливо).
4) получение новых продуктов питания путем изменения метаболизма микроорганизмов введением в них чужеродных генов
Трансгенные растения:
1.Устойчивость к гербицидам, например, к раундапу (глифосат). Ген выделен из устойчивого штамма E. coli.
2.Устойчивость к вредителям и болезням, например, Bt-сорта хлопка, кукурузы, картофеля (Bt или
Cry-протоксин из B. thuringiensis).
3.Растения с улучшенными лечебно-диетическими свойствами, например, «Золотой рис» с провитамином А (встроен ген фитоен-синтазы нарцисса), земляника с повышенным синтезом витамина С, соя с повышенным содержанием ненасыщенных жирных кислот (Омега-3 и 6, ген из водорослей), фрукты с суперсладким белком тауматином и т.д.
4.Устойчивость к неблагоприятным факторам среды, засухам, заморозкам, повышенной солености и т.д. Повышенная продуктивность и рост.
5.ГМ-растения для фармакологии, от съедобных вакцин до производства ценных рекомбинантных белков (антитела, промышл. Ферменты и т.д)
6.Повышение декоративных свойств растений
Трансгенные животные:
1.Научные модели
2.Модельные системы для изучения болезней человека
3.Производство фармацевтических белков
4.Трансгенные животные – источники ксенотрансплантантов
5.Трансгенные животные как источники пищи, новые породы
6.Трансгенные домашние любимцы
2.Формирование белками пространственной структуры (фолдинг). Значение нативной структуры белка для его функции. Шапероны.
Фолдинг – процесс пространственной упаковки белковой молекулы, принятия белком строго определенной формы, в которой он выполняет свои функции – когда белок синтезируется в клетке, он появляется в виде длинной и тонкой молекулярной цепочки, а затем сворачивается в свою естественную (нативную, третичную) форму.
* В клетках прокариот отсутствуют многие механизмы фолдинга, характерные для эукариотической клетки Значение белкового фолдинга: он приводит к формированию строго определенной
(нативной) структуры белка, в которой он функционирует. Нативная структура означает для белка все – он может выполнять свои функции только обладая такой структурой, она всегда уникальна. В редких случаях нативными могут быть сразу две конформации белка (т. н. конформеры). Они могут сильно различаться, и даже выполнять различные функции.
Сворачивание полипептидной цепи многих белков начинается уже в рибосоме во время трансляции белка (то есть его синтеза). Созревающий белок выходит из
рибосомы через специальный туннель, который является важным фактором сворачивания цепи. Упаковавшийся белок уже готов к выполнению своей функции, однако поскольку он продолжает активно двигаться в среде, он иногда слегка расплетается и снова упаковывается
Вклетке он может происходить:
•самопроизвольно – информация о трехмерной структуре «заложена» в самой последовательности аминокислот. Таким образом, белку, чтобы принять нативную структуру, требуется лишь «знать», в какой последовательности и какие аминокислотные остатки в нем присутствуют
•при катализе различными ферментами.
•При помощи шаперонов
Фолдинг протекает не одномоментно, а разбит на отдельные стадии:
|
Что |
как |
|
|
|
1 |
энтропийное |
Линейная цепочка, имеющая нулевую энтропию, |
|
сворачивание |
быстро сворачивается |
|
|
с образованием статистического клубка. |
|
|
|
2 |
гидрофобный |
гидрофобные аминокислотные остатки «прячутся» |
|
коллапс |
вглубь молекулы, а гидрофильные — «расселяются» |
|
|
по поверхности. Результат - |
|
|
формирование расплавленной глобулы |
|
|
|
3 |
формирование |
белок переходит в состояние истинной глобулы, при |
|
специфических |
этом свободная энергия резко падает |
|
связей |
|
|
|
|
Нарушения в сборке белка, денатурация белка: нативная структура не может формироваться, белок перестает делать то, что должен – приводит к болезням и тд.
Шапероны - класс белков, главная функция которого состоит в восстановлении правильной нативной структуры белка, а также образование и диссоциация белковых комплексов. Важно, что шапероны не входят в конечный белковый продукт, лишь направляют свои субтсранты по пути правильного фолдинга. Большинство – АТФзависимые. Есть во всех компартментах клетки, гле происходит фолдинг. Могут выполнять транспортную функцию. Очень консервативные белки.
Как работают шапероны при фолдинге?
-связывают и стабилизируют полипептиды, имеющие ненативную конформацию, взаимодействуя с гидрофобными областями молекул
-предоставляют возможность полипептидам, имеющим ненативную конформацию, правильно свернуться в изолированном гидрофобном окружении.
Многие виды шаперонов являются белком теплового шока, то есть белком, экспрессия которого начинается в ответ на рост температуры, а также воздействие некоторых других экстремальных факторов. Тепло сильно влияет на фолдинг белка, а некоторые виды шаперонов участвуют в исправлении потенциального вреда, который возникает из-за неправильного свертывания белка. Другие шапероны участвуют в фолдинге только что созданного белка в тот момент, когда он «вытягивается» из рибосомы. И хотя большинство видов только что синтезированного белка могут сворачиваться и при отсутствии шаперонов, некоторым видам обязательно требуется их присутствие.
Как работают шапероны: созревающая белковая цепочка выходит из рибосомы. Она еще незрелая, а пребывает в так называемом «расплавленном» состоянии. Такие незрелые молекулы подвержены дурному влиянию окружения: они могут взаимодействовать с другими клеточными белками, образуя агрегаты, что может приводить к болезням, например, болезни Альцгеймера или Паркинсона. Но есть и «правильное» русло, по которому может (и должно) быть направлено развитие белка, — тот путь, который приведет расплавленную глобулу в нативное состояние. Тут и помогают шапероны, «подкарауливая» и захватывая белковые цепочки у самого выхода из рибосомного туннеля и таким образом направляя незрелые белки, находящиеся на судьбоносном перепутье, в верное русло.
Важнейшая группа шаперонов — шаперонины. Интересна их структура: они представляют собой бочонки, составленные из двух колец. Сворачивающийся белок попадает внутрь шаперонина, а «вход» закрывается специальной «шапочкой» либо смыканием краев блоков, из которых состоят кольца, чтобы белковая молекула не покинула шаперонин раньше времени. Два кольца шаперонина TRiC работают подобно двухтактному двигателю, — когда одно кольцо замыкается, открывается второе, «выпуская на волю» уже свернувшийся в недрах шаперонина белóк. В таком защищенном состоянии белок может окончательно принять нативную конформацию. Шаперонины принимают участие в сворачивании ≈10% белков, для обретения формы которыми вообще требуются шапероны, и в первую очередь это касается белков со сложной структурой, входящих в состав макромолекулярных комплексов.
Билет 11.
1.Общие принципы конструирования новых хозяйственно ценных организмов (ГМО). Аргументы за и против использования ГМ-организмов.
Генно-модифицированные организмы – организмы, наследуемый генетический материал которых целенаправленно изменен методами генной инженерии. Не обязательно с добавленными генами других организмов, но также с измененными либо удаленными собственными.
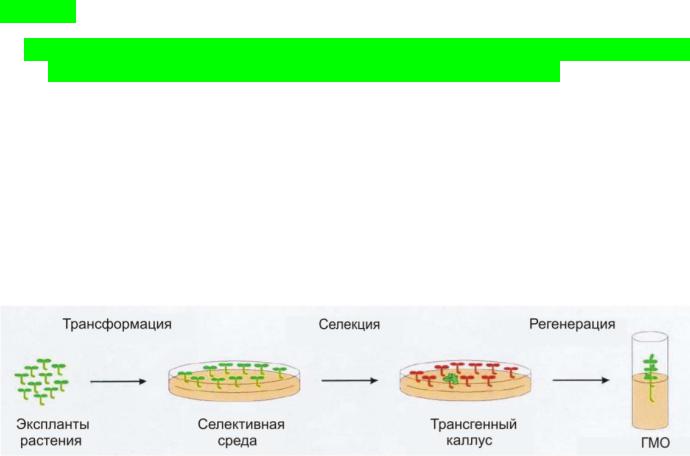
Трансгенные растения получают путем векторной трансформации отдельных соматических клеток. После чего используя селективную среду трансформированные клетки отбирают от нетрансформированных, и регенерируют полноценный организм. Кроме этого, ГМ-растения можно размножать вегетативно – клонировать.
1)Взрослое ГМ-растение может быть получено из отдельной соматической трансформированной растительной клетки
2)Растения можно размножать вегетативно (клонировать)
Трансгенных животных получают многими способами, но клонирование почти невозможно. К этим методам относится микроинъекция, когда модифицированная ДНК вносится в ядро организма; перенос генов ретровирусными векторами; использование модифицированных эмбриональных стволовых клеток; перенос трансформированных ядер генеративных и соматических клеток; использование спермиев и сперматогониев в качестве переносчиков ДНК.
Аргументы за и против использования ГМ-организмов.
За:
1)Целенаправленность и точность изменений в генах. Управление метаболизмом.
2)Внесение точечных изменений, не нарушающих структуру генома.
3)Скорость. Большая скорость создания новых организмов с заданными свойствами.
4)Принципиально новые свойства. Горизонтальный перенос информации между видами, невозможный методами стандартной селекции. Например, антифризный ген рыб для морозоустойчивых растений. Ген Bt-токсина для насекомых из бактерий в растения
5)Управление метаболизмом. Возможность создания организмов – «фабрик», например, ферментов, вакцин, антител
6)Предсказуемость и контроль последствий изменений. Более тщательное тестирование перед запуском в производство.
7)Следствия: интенсификация сельского хозяйства и биотехнологической промышленности, решение проблемы голода

Против:
1)Слабый, преодолеваемый доп маркировкой – аллергия на добавленные белки при поедании ГМ-растений
2)Опасность распространения генов устойчивости к антибиотикам
3)Опасность распространения генов устойчивости к гербицидам среди диких видов в результате перекрестного опыления. Создание суперсорняков. Вариант предохранения – самобесплодность пыльцы.
4)Растения с инсектотоксинами могут быть опасны для пчел-опылителей и других насекомых, которые в свою очередь являются кормом для птиц. Преодолевается использованием раневых промоторов для синтеза инсектотоксинов.
5)В дикой природе устойчивые к неблагоприятным условиям ГМ-растения могут вытеснить другие виды растений
6)Страх людей перед неизвестным
2.Базы данных белковых структур: белков и доменов. Сравнение пространственных структур белков (структурный элаймент), поиск гомологий.
Базы данных белковых структур.
Protein Data Bank, PDB — банк данных трёхмерных структур белков и нуклеиновых кислот. Информация, полученная методами рентгеновской кристаллографии или ЯМР-спектроскопии, и, всё чаще, методом криоэлектронной микроскопии вносится в базу данных биологами и биохимиками со всего мира.
PDB является одним из важнейших ресурсов для учёных, работающих в области структурной биологии. Большинство научных журналов требуют от авторов статей и получателей грантов, чтобы все структурные данные были размещены в PDB. Protein Data Bank содержит в основном первичные данные о структуре биологических молекул, в то время как существуют сотни других банков данных, категоризирующих первичные данные или выявляющие закономерности между строением молекул и эволюционным родством
UniProt (Universal Protein Resource) – один из наиболее всеобъемлющих каталогов информации о белках и их функциях, центральное хранилище первичных структур,
объединяет базы UniProtKB/Swiss-Prot, UniProtKB/TrEMBL и PIR – базы первичных структу Swiss-Prot
Swiss-Prot. Основная функция базы данных направлена на обеспечение надёжности информации о белковых последовательностях, обусловленной высоким, детальным уровнем аннотации, выполненной вручную. Она включает описание функции белка, его доменной структуры, пост-трансляционных модификаций, различных вариантов последовательности и т. д., причём с минимальным уровнем избыточности и высоким уровнем интеграции с другими базами данных.
TrEMBL. База данных «Библиотека данных Нуклеотидных последовательностей» (TrEMBL) была разработана в 1996 году как аннотированное компьютерное приложение к Swiss-Prot. Решение о создании TrEMBL было принято в ответ на увеличение потока данных в результате появления геномных проектов, а затратный по времени и трудоемкий процесс ручной аннотации в UniProtKB / Swiss-Prot превышал возможности Swiss-Prot для того, чтобы включить все доступные белковые последовательности. TrEMBL предоставляет возможность автоматизированной аннотации для трансляции имеющихся нуклеотидных последовательностей и превращения их в белковые последовательности вне Swiss-Prot.
PIR-PSD (protein information resource). Является наследником старейшей базы данных последовательностей белков, а именно, созданным Маргарет Окли Дейхофф «Атласом последовательностей белка и структуры», впервые опубликованным в 1965 году. PIR поддерживает несколько белковых баз данных, а именно: главную базу белковых последовательностей (PIR-PSD), базу данных, связанную с классификацией белков по структуре и функциям (iProClass), а также другие базы данных белковых последовательностей и курируемых семейств белков.
Catalytic Site Atlas – база данных для аннотации сайтов связывания лигандов и активных сайтов фермента в новых белковых последовательностях.
Pfam — база данных семейств белковых доменов.
PROSITE – база данных мотивов (характерные последовательности, связанные с определенными функциями)
Пространственное выравнивание — способ установления гомологии между двумя или более полимерными структурами на основании их трёхмерной структуры. Этот процесс обычно применяется к третичной структуре белков, но может также использоваться и для больших молекул РНК. В противоположность простому наложению структур, когда известно по крайней мере несколько эквивалентных аминокислотных остатков, пространственное выравнивание не требует никаких предварительных данных, кроме координат атомов.
Пространственное выравнивание подходит для сравнения белков с непохожими последовательностями, когда эволюционные отношения не могут быть установлены стандартными методами выравнивания последовательностей, но в этом случае необходимо принимать во внимание влияние конвергентной эволюции.
Пространственное выравнивание позволяет сравнивать две и более молекулы, для которых известны трехмерные структуры. Два основных метода их получения —
рентгеноструктурный анализ и ЯМР-спектроскопия. Для пространственного выравнивания можно также использовать структуры, полученные методами предсказания структуры белка. Пространственные выравнивания особенно важны для анализа данных, полученных методами структурной геномики и протеомики, они также могут использоваться для оценки выравниваний, полученных путём сравнения последовательностей
Методы, основанные на гомологии. Белки, имеющие сходные последовательности, как правило, являются гомологичными и, стало быть, имеют сходную функцию. Поэтому в недавно секвенированных геномах белки обычно аннотируют по аналогии с последовательностями схожих белков из других геномов. Однако не всегда близкородственные белки выполняют одну и ту же функцию, например, дрожжевые белки Gal1 и Gal3 являются паралогами с 73 % и 92 % сходства, приобретшие в ходе эволюции очень разные функции: так, Gal1 является галактокиназой, а Gal3 — индуктором транскрипции.
Моделирование на основании гомологии.
1.Идентификация структурного шаблона — белка с известной пространственной структурой, гомологичного моделируемому (идентичность последовательностей >30%). Поиск производится с помощью серверов FASTA или PSI-BLAST (или их аналогов) в базе структур белков PDB (едином депозитарии структурных данных для биомакромолекул);
2.Построение выравнивания аминокислотных последовательностей шаблонмодель.
Парное выравнивание служит «инструкцией» программам, осуществляющим моделирование.
Множественное выравнивание может быть полезно для выявления консервативных остатков во всём семействе (показаны звёздочкой) или отдельных подсемействах белков (три верхних последовательности — рецепторы мелатонина). Множественное выравнивание и профили последовательностей позволяют идентифицировать более слабые гомологии, чем «обыкновенное» парное выравнивание. Выравнивание проводят с помощью сервера CLUSTALW (или его аналогов);
3.Построение модели заключается, главным образом, в «натягивании» последовательности моделируемого белка (рецептора мелатонина MT1) на «остов» шаблона (зрительного родопсина) согласно выравниванию. «Петлевые» участки (не имеющие гомологии с шаблоном) достраиваются независимо, положение боковых цепей оптимизируется с помощью методов эмпирических силовых полей. В первом трансмембранном сегменте наложенных структур модели и шаблона показаны боковые цепи остатков, «подсвеченных» на

выравнивании. Моделирование проводят с помощью программы Modeller (и аналогичных ей) или сервера Swiss-Model (и ему подобных). В онлайн-базах ModBase и Swiss-Model Repositoryсодержатся автоматически построенные модели для всех белков из базы Swiss-Prot, для которых удаётся найти структурный шаблон;
4.Оценка качества, оптимизация и использование модели. Самый сложный этап моделирования по гомологии — оптимизировать модель с учётом всей доступной биологической информации по моделируемому белку. Вообще, моделирование структуры по гомологии с белком, выполняющим отличную функцию, не способно автоматически дать модель, пригодную для практически важных задач. Обязательно требуется аккуратная оптимизация, превращающая «заготовку» (которой, по сути, является модель «нулевого приближения») в рабочий инструмент, — задача, зависящая скорее от интуиции и опыта исследователя, чем от конкретных компьютерных методик.
В процессе проводимого уже около 15 лет с двухгодичным интервалом всемирного «соревнования» по предсказанию структуры белков — CASP (Critical Assessment of Techniques for Protein Structure Prediction) — выяснилось,
что эмпирическим «барьером» можно считать 30%-идентичность. То есть, если последовательности белков идентичны более чем на 30% — то, скорее всего, их структуры будут похожими и качество итоговых моделей будет удовлетворительным. Если же гомология низка, то накопившиеся структурные отличия, скорее всего, уже слишком велики для аккуратного моделирования, или
— больше того — реальной гомологии между двумя белками нет никакой, а наблюдаемый уровень идентичности последовательностей является лишь случайным событием.
