
МЕХАНИЗМЫ МЕТОДИЧКА
.pdfМИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ
РОССИЙСКОЙ ФЕДЕРАЦИИ
Российский химико-технологический университет имени Д. И. Менделеева
В. Н. Сапунов
МЕХАНИЗМЫ ОРГАНИЧЕСКИХ РЕАКЦИЙ
Утверждено Редакционным советом
университета в качестве учебного пособия
Москва
2017
УДК 54.04 ББК 24.2
С19
Рецензенты:
Доктор химических наук, профессор, заведующий кафедрой химической технологии углеродных материалов Российского химико-технологического университета
Т. В. Бухаркина Доктор химических наук, профессор Ярославского государственного технического
университета Г. Н. Кошель
Сапунов В. Н.
С19 Механизмы органических реакций: учеб. пособие/ В. Н. Сапунов – М.: РХТУ им. Д. И. Менделеева, 2017. – 136 с.
ISBN 978-5-7237-1459-5
Рассмотрены основные типы органических реакций в зависимости от природы реагентов и субстратов. Подробно изложены механизмы и условия, влияющие на ход реакций.
Приведены основные понятия органической химии (химическая реакция; гомогенные и гетерогенные реакции и др.), объясняется влияние различных параметров на скорость химической реакции (температура, давление), а также представлены некоторые теории, уравнения и принципы, с помощью которых описывают наблюдаемые в ходе химических процессов явления.
Пособие составлено в качестве дополнительного материала для закрепления лекций по курсу «Механизмы органических реакций» для студентов-бакалавров кафедры Химической технологии основного органического и нефтехимического синтеза РХТУ им. Д.И. Менделеева, а также для самостоятельного изучения аспектов органической химии.
УДК 54.04 ББК 24.2
ISBN 978-5-7237-1459-5 © Российский химико-технологический университет имени Д. И. Менделеева, 2017
© Сапунов В. Н., 2017
Оглавление
Предисловие………………………………………………………………...…................4
1.Общие понятия……………………………………………………………………….5
2.Нуклеофильные реакции………………………………………………………...….35 2.1. Механизм нуклеофильного замещения при насыщенном атоме
углерода................................................................................................................. |
36 |
2.2. Нуклеофильное замещение при атоме углерода в ароматическом |
|
ядре….................................................................................................................... |
46 |
2.3.Механизм реакций отщепления………………………………………………..48
2.4.Некоторые реакции нуклеофильного присоединения………………………..54
2.4.1.Нуклеофильное присоединение по ненасыщенным связям углерод– углерод………………………………………………………………………54
2.4.2.Нуклеофильное присоединение к α‒оксидам и другим гетероциклическим соединениям………………………………………….56
2.4.3.Нуклеофильное присоединение по карбонильной группе…………….61
2.4.4.Нуклеофильные реакции карбоновых кислот и их производных….…65
3.Электрофильные реакции…………………………………………………………...69
3.1.Электрофильное присоединение по двойным связям………………………...69
3.2.Электрофильное замещение в ароматических соединениях
(SEAr)…………………………………………………………………………….77
3.3.Механизм электрофильного замещения в алифатическом ряду……………86
4.Радикальные реакции……………………………………………………………….89
4.1.Зарождение цепи, термическое и химическое зарождение цепи…………....91
4.2.Реакции фотолиза и радиолиза…………………………………………….......95
4.3.Продолжение и обрыв цепи……………………………………………………96
4.4.Радикальные реакции замещения, расщепления и присоединения…..…….101
4.5.Кинетика неразветвленных и разветвленных цепных реакций…………….110
5.Реакции, катализируемые комплексами металлов…………………………….....113
Заключение……………………………………………………………………………..133 Библиографический список…………………………………………………………...135
3
ПРЕДИСЛОВИЕ
Учебное пособие по механизмам органических реакций предназначено для студентов второго курса кафедры «Химической технологии основного органического и нефтехимического синтеза» РХТУ им. Д.И. Менделеева. Предлагаемый курс дает основу для дальнейшего изучения технологических курсов, изучаемых студентами в следующих семестрах как бакалавриата, так и магистратуры:
-введение в промышленную органическую химию;
-теория технологических процессов;
-промышленный катализ;
-технология продуктов основного органического и нефтехимического синтеза. Курс «Механизмы органических реакций» читается почти одновременно с
курсом «Органической химии», что в значительной степени помогает студентам получить фундаментальные знания в области органической химии, особенно в области усвоения закономерностей протекания различных реакций.
Основная цель данного пособия состоит в том, чтобы студенты научились понимать пути реализации химических процессов, научились ориентироваться во множестве возможных вариантов протекания химической реакции и выделить среди них общие закономерности.
Предлагаемый курс основан на переработке и дополнении материалов, ранее входивших в курсы «Теория технологических процессов основного органического и нефтехимического синтеза» (1975 год) и «Теория химических процессов основного органического и нефтехимического синтеза» (1984 год), изложенных в одноименных учебниках авторов Лебедева Н.Н., Манакова М.Н. и Швеца В.Ф.
К работе над настоящим учебным пособием привлекались студенты, обучающиеся на кафедре «Химической технологии основного органического и
нефтехимического синтеза» РХТУ им |
Д.И. Менделеева |
- Филатова Д.С., |
Гладышева А.А., Кутлугильдина К.Р. и |
Дягилева А.И. |
Студенты помогали |
выявить основные неясные моменты в изучении курса, акцентировать внимание на некоторых деталях его изложения, которые, зачастую, ускользают от преподавателей.
Пособие построено путем изложения трех основных типов реакций: электрофильных, нуклеофильных и радикальных, а также процессов металлокомплексного катализа, которые можно рассматривать как четвертый характерный тип органических реакций.
4
1. ОБЩИЕ ПОНЯТИЯ
1.1. Химические реакции и вещества, участвующие в них
Химическая реакция – процесс превращения одних веществ (исходные соединения) в другие (продукты реакции). Причем следует обозначить отличие от «ядерной химической реакции», когда происходят превращения ядер атомов. Исходные соединения в химических реакциях иногда называют «реагентами», однако чаще (особенно в органической химии) термин «реагент» используют по отношению к одному, наиболее активному исходному соединению, определяющему направление химических реакций. Обычно, реагенты различают по своим основным свойствам:
-нуклеофил – молекула или ион, предоставляющий для реакции с реагентом свою электронную пару; поскольку нуклеофилы отдают электроны, они являются основаниями (основания Льюиса): [OH]-, NH3, H2O, амины, Cl-, Br- и т.д.
-электрофил – молекула или ион, принимающий для реакции от реагента его электронную пару; поскольку электрофилы принимают электроны, они являются кислотами (кислоты Льюиса): [H]+, AlCl3, R3C+ и т.д.
-радикал – частицы с неспаренными электронами, могут быть нейтральными или заряженными (ион-радикал), иметь один или более неспаренных электронов:
Н3С*, Сl*, O2** и пр.
В зависимости от природы реагента различают нуклеофильные,
электрофильные и радикальные реакции.
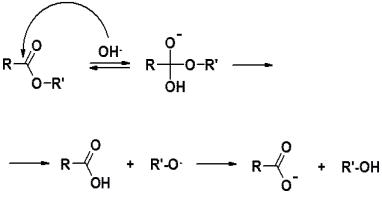
Второй участник реакции в этом случае называется «субстрат». Пример нуклеофильной реакции (гидролиз сложных эфиров):
Пример электрофильной реакции (образование сложных эфиров):
5
Пример радикальной реакции:
Для описания химических реакций используют химические уравнения, в левой части которых указывают исходные вещества, в правой – продукты. Обычно, обе части уравнения соединяются стрелкой (в случае необратимых превращений) или прямой и обратной стрелками (для обратимых реакций). На основании закона сохранения вещества устанавливают, в каких соотношениях нужно взять исходные реагенты, чтобы завершить реакцию для получения конечных продуктов. Эти соотношения показывают баланс одинаковых атомов и электронов левой и правой частей химических уравнений, а полученные коэффициенты называют
стехиометрическими коэффициентами.
стехиометрические
коэффициенты
6
Для осуществления реакций часто требуются определенные условия: температура, давление, облучение (УФ-излучение), наличие определенного растворителя или катализатора и т.д. В этом случае уравнения дополняют указанием агрегатного состояния веществ, наличием особого растворителя, определенной температуры и другими условиями.
Молекулярность элементарной реакции – число частиц, которые, согласно экспериментально установленному механизму реакции, участвуют в элементарном акте химического взаимодействия.
Мономолекулярные реакции – реакции, в которых происходит химическое превращение одной молекулы (изомеризация, диссоциация и т. д.):
H2S → H2 + S
Мономолекулярные реакции эндотермичны, поскольку для разрыва связи нужна энергия, т.е. для начала реакции необходима активация частиц. Самопроизвольно осуществляется превращение только тех из них, которые обладают запасом энергии, достаточным для преодоления энергетического барьера.
Бимолекулярные реакции – реакции, элементарный акт которых осуществляется при столкновении двух частиц (одинаковых или различных):
СН3Вr + КОН → СН3ОН + КВr
Бимолекулярные реакции – наиболее распространённый класс химических реакций. К ним относятся как простые (одностадийные) реакции между двумя молекулами (в приведённом примере), так и большинство элементарных реакций, являющихся составной частью сложных реакций. В случае сложных реакций в бимолекулярное превращение, наряду с молекулами, могут вступать атомы, радикалы и ионы. Скорость бимолекулярных реакций, выражаемая числом элементарных актов реакции за единицу времени в единице объёма, будет тем больше, чем чаще сталкиваются между собой частицы исходных веществ. Частота столкновений между частицами пропорциональна произведению их концентраций. Поэтому и скорость бимолекулярных реакций пропорциональна произведению концентраций частиц, вступающих в реакцию.
Химические реакции могут осуществляться как один элементарный акт
(стадия) или через последовательность отдельных стадий, составляющих в совокупности механизм реакции. Протекание химической реакции сопровождается рядом физических и физико-химических признаков:
7
Признаки химических реакций
Выделение (поглощение) |
|
|
|
|
|
|
|
Выделение газа |
|
Изменение цвета |
|
|||
|
|
|
||
тепла или света |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Выпадение (растворение) |
|
|
|
Изменение запаха |
|||
осадка |
|
||
|
|
||
|
|
|
|
|
|
|
Различают реакции, проходящие в закрытой и открытой системе. В первом случае это означает, что процесс проводится в локализованном пространстве (реакторе) с одной и той же реакционной системой, взятой в момент времени, называемый началом реакции. Далее реакционная система остается изолированной, без подачи реагентов или вывода части реакционной системы из реактора.
Если реакция происходит в открытой системе, т.е. при непрерывной подаче с постоянной скоростью исходных веществ и с непрерывным удалением продуктов реакции, то говорят, что реакция протекает стационарно. Каждое промежуточное вещество тогда образуется и расходуется с одинаковой скоростью, так что его количество в системе не изменяется со временем.
1.2. Гомогенные и гетерогенные реакции, простые и сложные,
элементарные и неэлементарные, мономолекулярные, бимолекулярные, последовательные, параллельные и цепные реакции
Помимо классификации химических реакций по природе реагента (нуклеофил, электрофил и радикал), существует множество других способов классификации химических реакций, но мы рассмотрим лишь наиболее общие.
Гомофазными называются реакции, все компоненты которых (кроме катализаторов) находятся в пределах одной фазы: газовой (газофазные процессы) или жидкой (жидкофазные процессы).
8
Гетерофазными являются реакции, компоненты которых находятся в двух или более фазах (системы газ–жидкость, две несмешивающихся жидкости и др.).
Гомогенные и гетерогенные реакции различают по зоне протекания самой химической реакции:
гомогенные осуществляются в объеме какой-либо фазы; гетерогенные – на поверхности раздела фаз.
С этим связана и классификация катализаторов. При гомогенном катализе реакция протекает в объеме, где находится и сам катализатор, при гетерогенном катализе – на поверхности контакта фаз.
Понятия фазового состояния компонентов реакции и зоны ее протекания совсем неоднозначны. Для более точного отображения условий протекания реакции или процесса используют двоичную комбинацию из понятий гомогенные и гетерогенные реакции (т.е. определяется зона, где протекает реакция), и гомофазные и гетерофазные процессы (т.е. определяются фазы, где находятся реагенты).
Примером гомогенных гомофазных реакций могут служить реакции ионного обмена, например, нейтрализация кислоты и щелочи в растворе:
NaOH(раств.) + HCl(раств.) → NaCl(раств.) + H2O(жидк)
Примером гетерогенных гетерофазных реакций может служить реакция солей угольной кислоты (карбонатов) с кислотами Бренстеда:
CаСO3(тверд) + 2HCl(раств.) → СаCl2(раств.) + CO2(газ) + H2O(жидк)
Примеры гомогенной гетерофазной реакции: сульфирование бензола, когда реагенты находятся в двух несмешивающихся фазах, но их взаимодействие идет в объеме одной из фаз, а также образование хлорида аммония из газообразных хлороводорода и аммиака:
NH3(газ) + HCl(газ) → NH4Cl(тверд)
Примеры гетерогенных гомофазных реакций – множество газофазных реакций на твердом катализаторе, например, реакция синтеза аммиака из водорода и азота:
N2(газ) + 3H2(газ) → 2NH3(газ) (катализатор Pt)
Простыми называются реакции, в которых не образуются количества других веществ, кроме тех, что фигурируют в стехиометрическом уравнении:
γAA + γBB + … ↔ γYY +γZZ
9

Простые реакции могут быть элементарными и неэлементарными. Элементарные реакции протекают при непосредственном взаимодействии исходных веществ, т.е. вообще отсутствуют (их пока не удалось обнаружить) какие-либо микростадии, через которые идет такая реакция.
Сложные (неэлементарные) реакции имеют ряд химических микростадий, в которых участвуют промежуточные комплексы или частицы, не фигурирующие в стереохимическом уравнении, например:
А→ А* +Y А* → B + Z
→Y
Каждая из промежуточных стадий, составляющих неэлементарную реакцию, является элементарной. При этом совокупность элементарных стадий, способов образования, природы и дальнейшего взаимодействия промежуточных комплексов и частиц и составляет механизм реакции.
Простые реакции могут быть обратимыми и необратимыми.
Сложные реакции состоят из двух или более химических макростадий, они дают ряд макропродуктов и представляют собой совокупность простых реакций. Реакции, идущие сразу по нескольким направлениям, получили название
параллельных.
Me + HNO3 → Me(NO3)n + [NH4NO3, N2, NO, NO2] + H2O
Очень часто, особенно в органической химии, исходные вещества реагируют сразу по нескольким направлениям, причем в каждом – со своей скоростью. Например, при нитровании фенола в основном получаются два изомера: орто- и пара-:
Последовательные реакции протекают через ряд последовательных стадий. Механизм такой многоступенчатой реакции неизвестен, поэтому составляют вероятностную схему протекания реакции по стадиям. Опираясь на эту схему, получают общее кинетическое уравнение суммарной реакции. Если это уравнение
10
