
МЕХАНИЗМЫ МЕТОДИЧКА
.pdf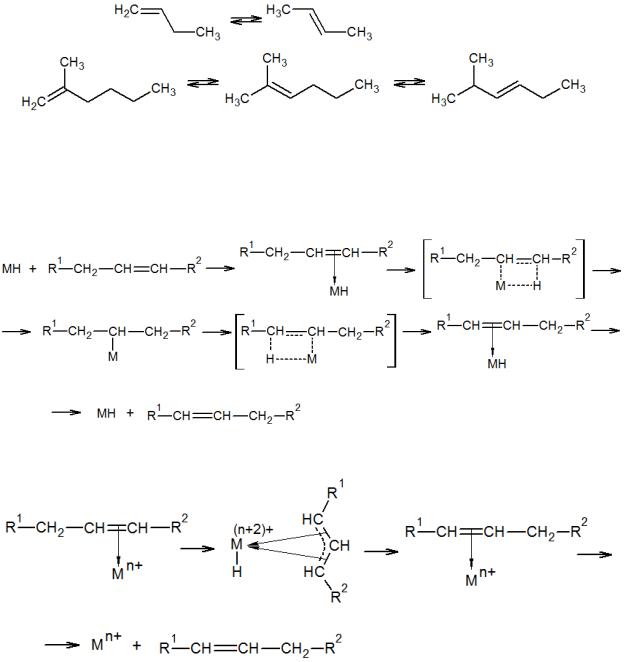
Миграция двойной связи может происходить как в неразветвленной, так и в разветвленной цепи:
Рассматривают два механизма миграции двойной связи, которые включают промежуточное образование металл–алкильного или металл–аллильного комплексов.
Общая схема изомеризации по металл–алкильному механизму:
Общая схема изомеризации по металл–аллильному механизму:
Обычно, под скелетной изомеризацией подразумевают миграцию метильной группы по длине основной цепи молекулы. Длина основной цепи при этой изомеризации может оставаться неизменной или меняться:
121
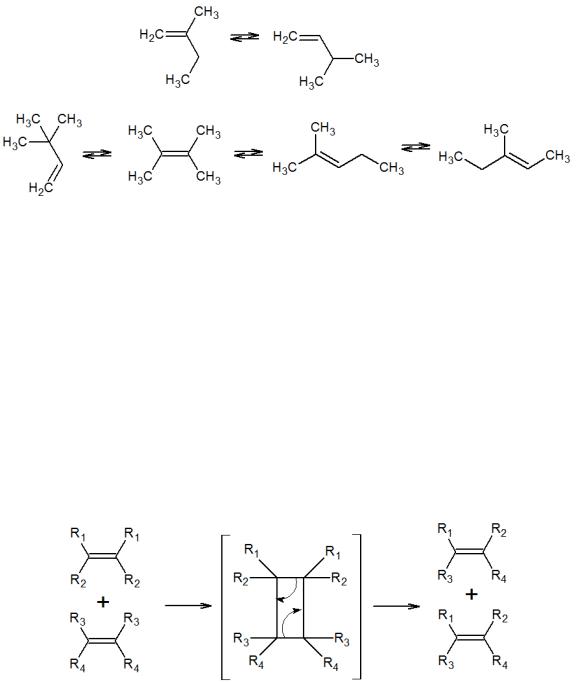
Обычно этот тип изомеризации осуществляют на кислотных гетерогенных катализаторах.
5.4. Метатезис олефинов
Метатезис олефинов — химическая реакция двух олефинов, в процессе которой при двойных связях алкенов, участвующих в реакции, происходит перераспределение заместителей:
СН2=СН2 + PhCH=CHPh 2PhCH=CH2
Сущность реакции заключается в одновременном разрыве старых и образовании двух новых двойных связей:
Реакция протекает обычно через стадию образования карбеновых комплексов металла с олефинами. В качестве катализаторов выступают алкильные комплексы переходных металлов VI и VII групп – продукты взаимодействия WCl6, МоСl5, W(CO)6, ReCl5 и других с алкильными производными металлов – AlR3, LiR, SnR4, RMgX и др. Активация катализатора метатезиса происходит при превращении алкильных комплексов в карбеновые:
СH 3CH 2W VI Cl5 СH 3CH(H)W VI Cl5 СH 3CH W IVCl 4 HCl
122
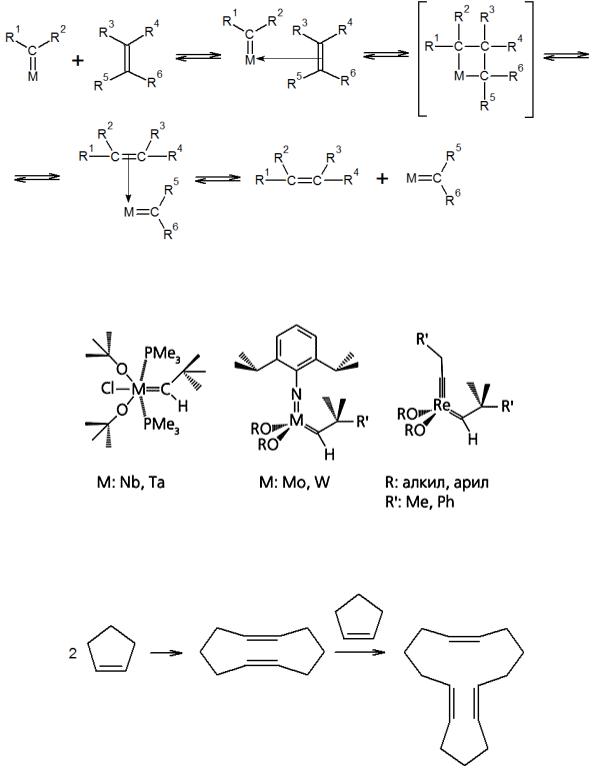
Далее следует каталитический цикл:
Известен ряд других катализаторов, включающих уже устойчивые карбеновые комплексы:
Особый интерес реакция метатезиса на таких катализаторах представляет при получении олигомеров и полимеров из циклических алкенов:
или
123
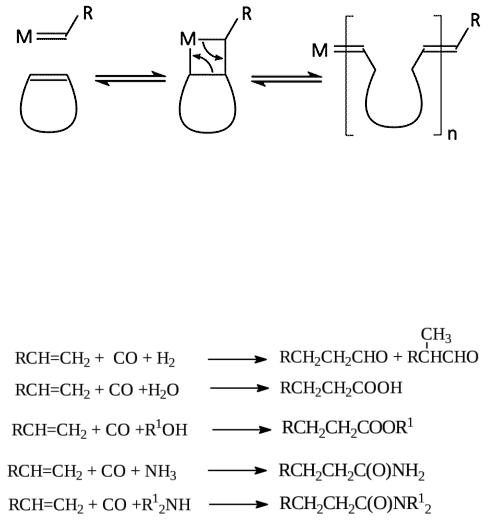
5.5. Синтезы на основе монооксида углерода
Одними из промышленно важных процессов, в которых металлокомплексный катализ незаменим, являются синтезы на основе монооксида углерода (СО). Некоторые примеры промышленно важных процессов приведены ниже.
Известные в настоящее время синтезы на основе окиси углерода можно разделить на несколько групп, основные из которых:
-гидроформилирование олефинов;
-карбонилирование олефинов и ацетилена;
-карбонилирование спиртов.
Гидроформилирование олефинов (оксосинтез) – взаимодействие ненасыщенных соединений с монооксидом углерода и водородом в присутствии катализатора с получением альдегидов, имеющих на один атом углерода больше, чем исходный олефин. Альдегиды получаются как линейного, так и разветвленного строения.
Катализаторами являются карбонилы металлов VIII группы периодической системы (обычно кобальта, никеля). Сейчас разрабатываются новые каталитические системы на основе родия, например, HRh(CO)(PPh3)3. В промышленном синтезе уже нашли применение в качестве катализаторов гидридные комплексы только двух металлов – CoI и RhI, – модифицированные различными лигандами. Чаще
124
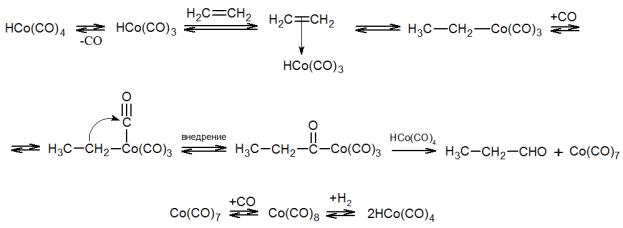
всего применяют октакарбонил кобальта (Co2(CO)8), который в условиях реакции превращается в гидридотетракарбонильный комплекс:
Co2 CO 8 H2 2 HCo(CO)4
Каталитический цикл состоит в отщеплении СО, координации с олефином по освободившемуся вакантному месту, внедрении олефина по связи Со–Н, присоединении СО, внедрении его по связи Со–С, расщеплении последней под действием гидрокарбонила и регенерации исходной формы катализатора из карбонилов кобальта под действием водорода:
Карбонилирование алкенов и алкинов. Кроме альдегидов, в зависимости от реагентов и условий реакции, на основе СО получают много других ценных продуктов. Если заменить водород в процессе гидроформилирования на воду, получают карбоновые кислоты:
RCH CH 2 CO H2O Ni(CO)4 RCH 2CH 2COOH RCH(COOH) СH3
Идентичная реакция протекает с ацетиленом и метилацетиленом:
CH CH CO H2O кат. CH2 CHCOOH
СН3C CH CO H2O Ni(CO)4 CH2 C(CH3 )COOH
Заменой воды на спирт получают сложные эфиры:
Ni(CO) 4
СН3CН CH CO CH3OH СН3CH2C(CH3 )COOCH3
В присутствии кислот идет образование сложных ангидридов:
125
СН2 CH2 CO CH3СОOH кат. СН3СН2С(О)ОС(О)СН3
Карбонилирование спиртов (в частности, метанола) протекает по следующему суммарному уравнению:
CH3OH CO RhCl3 *H2OHJ CH2COOH
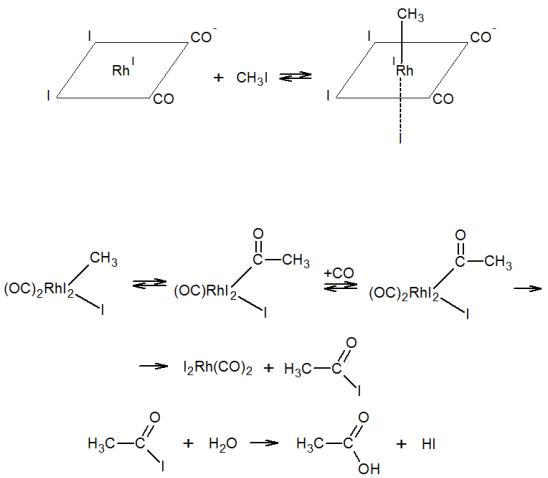
Этот способ в современной промышленности является основным для получения уксусной кислоты. Катализатором данной реакции служит анионный комплекс родия [Rh(CO)2I2]-, который образуется в реакционной массе из RhCl3 и HI под давлением СО. Реакция протекает в присутствии промотора СН3I.
Механизм карбонилирования спиртов заключается в следующем: соли родия в условиях карбонилирования превращаются в карбонильный комплекс, который на стадии, определяющей скорость реакции, присоединяет метилиодид по окислительному механизму с образованием комплекса трехвалентного родия
[RhIIII3(CH3)(CO)2]-:
За этой стадией следует внедрение СО по связи Rh-C, присоединение СО и восстановительное элиминирование СН3-С(О)I с регенерацией катализатора:
126
Отличительной особенностью реакции карбонилирования спиртов является тот факт, что протекает карбонилирование не спирта, а его производного – иодистого метила с образованием иодангидрида кислоты.
5.6. Присоединение НХ к олефинам и ацетиленам
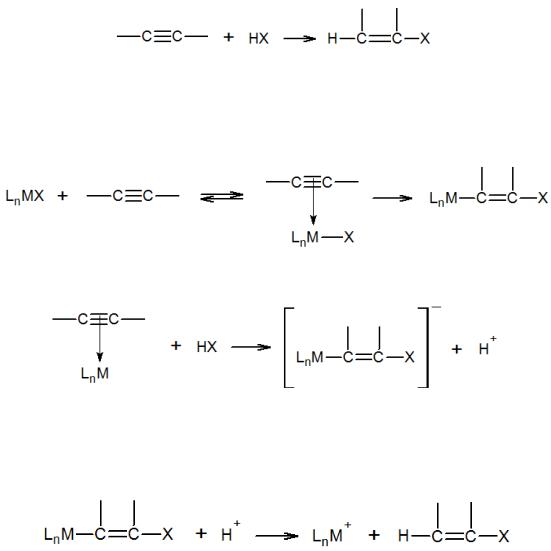
Помимо рассмотренных ранее реакций нуклеофильного, электрофильного и радикального присоединения фрагментов молекулы X–Y к олефинам и ацетиленам, существует класс промышленно важных реакций присоединения, катализируемых комплексами металлов. Металлокомплексный катализ присоединения НХ наиболее характерен для ацетиленовых соединений. В присутствии комплексов Hg(II), Cu(I), Zn(II), Cd(II), Rh(I), Pd(II) легко протекает реакция:
,
где Х= -OH, -OR, -OC(O)R, -NR2, -Cl, -Br, -F, -CN, -SiR3 и др.
Присоединение НХ к ацетиленам включает промежуточное образование комплексов, за которыми следует внедрение по связям М–Х:
или внешняя нуклеофильная атака:
Образование продукта реакции и регенерация катализатора происходят в результате протолиза промежуточного металлоорганического соединения (внешняя электрофильная атака):
127
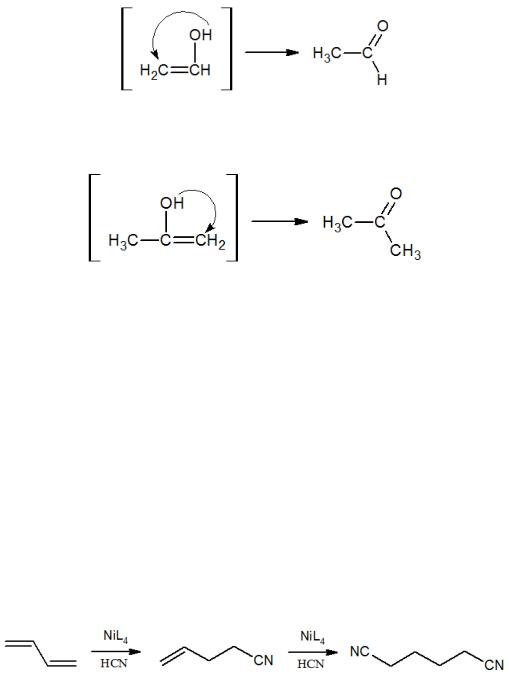
Например, в описанной выше реакции гидратации ацетилена (реакция Кучерова, см. раздел 3), катализируемой солью ртути, интермедиатом является неустойчивый непредельный спирт, который легко изомеризуется в уксусный альдегид:
Аналогично протекает реакция гидратации замещенных ацетиленов с образованием кетонов (см. раздел 3):
Эти реакции проходят по так называемому правилу Эльтекова: ненасыщенные спирты с группой -ОН у атома углерода, при котором находится двойная связь (енолы) неустойчивы и превращаются в карбонильные соединения – альдегиды и кетоны.
Реакции присоединения Н–Х к олефинам эффективно катализируются протонными и апротонными кислотами (электрофильное присоединение), поэтому в реакции присоединения Н–Х редко используют металлокомплексный катализ. Однако существует ряд важных промышленных процессов, катализируемых комплексами металлов.
Гидроцианирование – образование нитрилов в результате присоединения HCN к алкенам и алкинам. Наиболее важный каталитический процесс, нашедший промышленное применение (компания Du Pont) – синтез адипонитрила из бутадиена и HCN в присутствии [{(ArO)3P}4Ni]:
Получаемый адипонитрил, или 1,4-дицианобутан, является важным промышленным полупродуктом, который используется для получения найлона-66, необходимого для производства синтетических волокон.
Механизм этой реакции включает известную последовательность: координация олефина на катализаторе, внедрение и восстановительное элиминирование с
128
образованием координационно ненасыщенного катализатора NiL2, окислительное присоединение НСN:
|
|
|
RCH=CH2 |
RCH |
|
|
CH2 |
|
||
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||
|
|
|
HNiL2CN |
|
||||||
|
|
|
|
|
|
|
||||
NiL4 + HCN |
-2L |
HNiL CN |
|
|
|
|
RCH2CH2-NiL2CN |
|||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||
|
|
+2L |
2 |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
HCN |
|
NiL2 |
RCH2CH2CN |
||
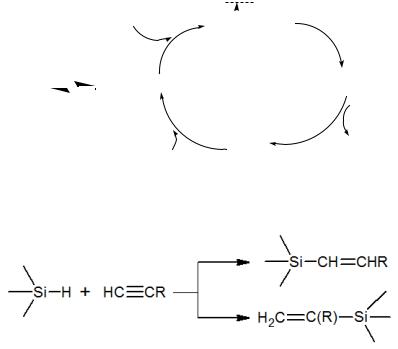
Аналогично протекает другой процесс гидросилилирования – присоединение гидросиланов (R3Si-H) по ненасыщенным связям:
Реакция протекает в присутствии H2PtCl6, RhCl(PPh3)3, Ni[P(OPh)3]4, Co(C5H7O2)
и ряда других комплексов металлов.
5.7. Окисление углеводородов в карбонильные соединения
Окисление углеводородов при металлокомплексном катализе пока недостаточно изучено. Наиболее изучены реакции окисления ненасыщенных соединений. Большой интерес к окислению алкенов и алкинов объясняется тем, что окисление по гетеролитическому механизму осуществляется внутри координационной сферы металла. Координация насыщенных углеводородов в сфере каталитического комплекса чрезвычайно мала. Тем не менее, развивается целое направление в металлокомплексном катализе – активация алканов.
Примером важного промышленного процесса является окисление этилена кислородом воздуха до ацетальдегида в присутствии медь-палладиевого гомогенного катализатора – Вакер-процесс, разработанный и внедренный в 1960-е годы компаниями Waker-Chemie и Farbwerke Hoechs. Вакер-процесс быстро вытеснил предыдущий метод получения ацетальдегида по реакции Кучерова.
Получение ацетальдегида осуществляется в водном растворе HCl. Окисление других олефинов в этих условиях приводит к получению кетонов.
129
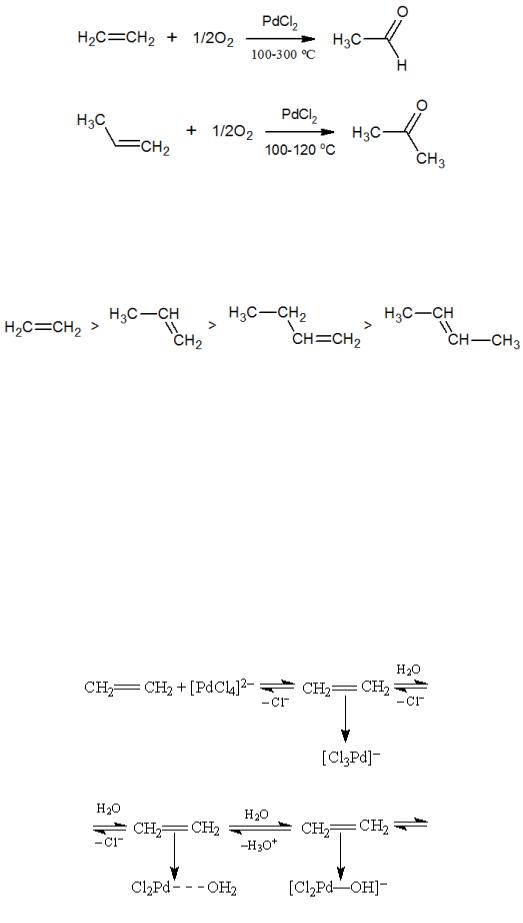
Реакционная способность олефинов изменяется в последовательности, характерной для катализа комплексами металлов, т.е. в зависимости от экранирования заместителями координированной на центральном атоме металла двойной связи:
Хотя процесс и называется «окислением этилена кислородом», но в реакции кислород попадает в органическую молекулу из воды в результате превращений внутри сферы комплекса Pd(II). В кислом растворе HCl всегда присутствует некоторое количество тетрахлоропалладата(II). На первой стадии один из ионов хлора в [PdCl4]2- замещается на молекулу этилена, при этом образуется комплекс с олефином. Олефин активирует транс-положение в комплексе и происходит транс- замещение еще одного иона хлора на молекулу воды. Далее молекула воды взаимодействует с олефином с образованием оксиэтильной группы, связанной с атомом палладия σ-связью. Последняя стадия – в результате восстановительного элиминирования образуется комплекс Pd(0) и продукт реакции, который, согласно правилу Эльтекова, изомеризуется в ацетальдегид.
130
