
МЕХАНИЗМЫ МЕТОДИЧКА
.pdf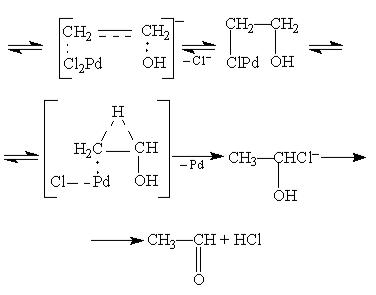
В результате одного цикла Pd(II) восстанавливается в Pd(0). Здесь начинает играть свою роль ион Cu(II), который окисляет палладий, сам превращаясь в Cu(I). Последний, в свою очередь, вновь окисляется кислородом до Cu(II):
Pd + 2Cu2+ + 4Cl- → PdCl2 + 2CuCl
2CuCl + 1/2O2 + 2HCl → 2CuCl2 + H2O
Таким образом, в данном процессе непосредственно окисляется кислородом именно медь, а не сам этилен.
Другим промышленно важным процессом является получение винилацетата окислением этилена в присутствии биметаллической системы – комплексов солей Pd/Cu в уксусной кислоте. В основе процесса также лежит стехиометрическая реакция комплекса Pd(II) с этиленом:
CH2=CH2 + PdCl2 + 2CH3COONa →
→ CH2=CHOOCCH3 + Pd + 2NaCl + CH3COOH
Соединения меди (II) так же, как и в Вакер-процессе, являются окислителями
Pd(0).
5.8. Эпоксидирование олефинов
Эпоксидирование олефинов действием Н2О2 или органических гидропероксидов катализируется комплексами Мо, V, W и Ti, а также пероксимолибденовыми и пероксивольфрамовыми соединениями. Эти реакции являются примером
131
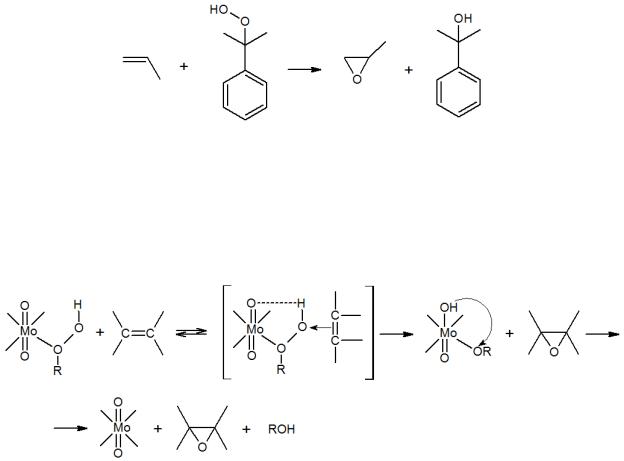
металлокомплексного катализа гетеролитических реакций введения кислорода в органические молекулы. К настоящему времени хорошо разработан так называемый Халкон-процесс – промышленный синтез пропиленоксида эпоксидированием пропилена гидропероксидами этилбензола или кумола:
Реакцию осуществляют с использованием комплексов молибдена. При координации гидропероксида с металлом частично снимается электронная плотность с p-орбитали гидропероксида, один из атомов кислорода приобретает электроноакцепторные свойства и способность взаимодействовать с -электронами олефина, образуя эпоксид:
5.9. Активация алканов
Активация алканов в растворах при металлокомплексном катализе как отдельный раздел промышленной органической химии только начинает развиваться. Пока нет освоенных технологий с получением важных химических продуктов. Сложность заключается в том, что молекула алкана не имеет подходящих орбиталей для образования связи с координационным центром катализатора. Активация метана представляет собой одну из самых сложных химических задач; среди «химических мертвецов» – алканов – метан отличается наиболее высокой прочностью связей С–Н и, как следствие, самой низкой реакционной способностью.
132
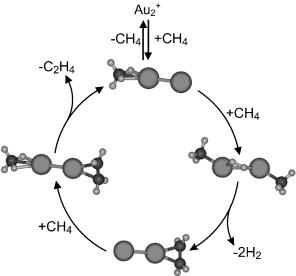
При изучении свойств нано-кластеров золота обнаружили, что положительно заряженные частицы, состоящие из двух атомов благородного металла (Au2+), способствуют селективному преобразованию метана в этилен в газовой фазе. Предполагают, что на первой стадии реакции происходит последовательное окислительное присоединение к двум связанным атомам золота двух молекул метана. Далее происходит реакция восстановительного элиминирования с образованием этана и водорода.
Пристальное внимание привлекают также комплексы платины. Так, в водных растворах в присутствии комплексов [PtCl4]2- и [PtCl6]2- из метана образуется СН3Сl и СН3ОН, а в присутствии комплекса {Ni0-СН4} реагирует с ацетиленом, образуя пропилен.
Таким образом, первые исследования в области активации алканов при металлокомплексном катализе позволяют надеяться на скорое появление новых каталитических процессов селективной переработки алканов в важные химические продукты.
6. ЗАКЛЮЧЕНИЕ
Все множество химических превращений, называемое химическими процессами или химическими реакциями, имеет множество названий, которые характеризуют, например, общий тип превращений – замещения, присоединения, отщепления, изомеризации. При этом часто выделяют группы реакций, характеризующиеся каким-либо общим характером превращений – полимеризация, поликонденсация,
133
окисление, восстановление, гидролиз и алкоголиз, этерификация и т.д. Однако, все реакции все-таки можно объединить по типу взаимодействия одного вещества – реагента – с другим веществом – субстратом. В этом случае речь может идти лишь о типе взаимодействия реагента – нуклеофильные, электрофильные или радикальные реакции. Первые два типа объединяются характером переноса электронов при гетеролитическом разрыве и формировании связи с образованием ионов или иных полярных компонентов реакции, тогда как в последнем случае происходит гомолитический разрыв связи с образованием радикалов. В то же время, каждый из вышеназванных типов взаимодействия включает реакции замещения, присоединения или отщепления.
Основным отличием радикальных реакций от гетеролитических (т.е. нуклеофильных и электрофильных реакций, протекающих через стадию гетеролитического разрыва связи) следует признать меньшую избирательность в получении конкретных продуктов. В свою очередь, гетеролитические процессы также остаются неидеальными. Наличие высокореакционноспособных промежуточных компонентов реакции зачастую приводит к новым, нежелательным превращениям, что уменьшает селективность получения нужного продукта. Наилучшим выходом из такой ситуации является переход к более избирательному металлокомплексному катализу, пределом которого являются ферментативные процессы.
134
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1.Лебедев Н. Н. Химия и технология основного органического и нефтехимического синтеза. М.: Химия, 1988. 589с.
2.Лебедев Н. Н., Манаков М. Н., Швец В. Ф. Теория технологических процессов основного органического и нефтехимического синтеза. М.: Химия, 1975. 478с.
3.Лебедев Н. Н., Манаков М. Н., Швец В. Ф. Теория химических процессов основного органического и нефтехимического синтеза. М.: Химия, 1984. 375с.
135
Учебное издание
САПУНОВ Валентин Николаевич
МЕХАНИЗМЫ ОРГАНИЧЕСКИХ РЕАКЦИЙ
|
Редактор Р. Г. Чиркова |
|
|
Подписано в печать 20.02.17 г. |
Формат 60х84 1/16. |
||
Усл. печ. л. |
Уч.-изд. л. |
Тираж 100 экз. |
Заказ |
Российский химико-технологический университет имени Д. И. Менделеева Издательский центр
Адрес университета и издательского центра: 125047 Москва, Миусская пл., 9
