
МЕХАНИЗМЫ МЕТОДИЧКА
.pdf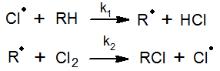
радикалы, участвующие в лимитирующей стадии цепи, и обрыв будет происходить именно на них. Если два радикала присутствуют в реакционной массе в сравнимых концентрациях, то возможен перекрестный или параллельный квадратичный обрыв на обоих радикалах.
4.4. Радикальные реакции замещения, расщепления и присоединения
Большинство радикальных реакций замещения сводятся к замене водорода в органических веществах на какие-либо функциональные группы. Типичным примером являются процессы галогенирования по насыщенному атому углерода:
Для таких реакций характерно общее правило: замещение водорода преимущественно происходит через стадию образования наиболее стабильного радикала. Отсюда следует, что атомы водорода будут легко отрываться от вторичных и, особенно, третичных атомов углерода, а также от таких систем, где образующийся радикал будет стабилизирован π-аллильными группами. Таким образом, ключевую роль играют эффекты сопряжения и сверхсопряжения. Соответственно, с увеличением стабильности промежуточного радикала возрастает и скорость всего процесса замещения. Присутствие заместителя с отрицательным индуктивным эффектом, наоборот, будет сильно тормозить реакцию. Так, например, этилхлорид реагирует в пять раз медленнее этана.
На соотношение получаемых продуктов сильное влияние оказывает и природа галогена. Для наиболее реакционноспособных хлора и, тем более, фтора безразлично, какие атомы водорода атаковать, поэтому реакции замещения с ними идут не избирательно и, как правило, образуется смесь изомеров. Напротив, бром с достаточной селективностью замещает атомы водорода согласно приведенному выше правилу.
101
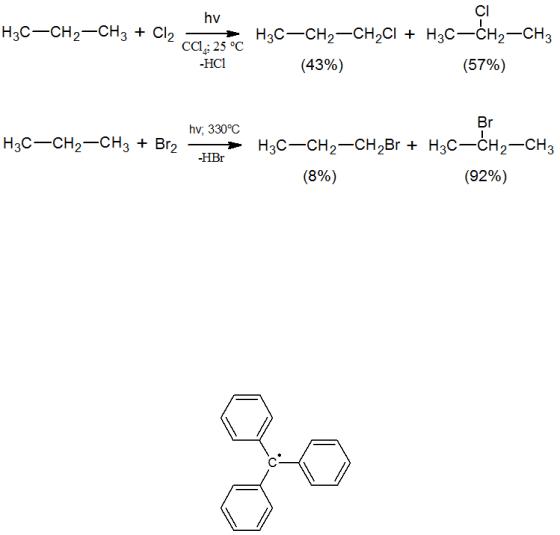
Обрыв цепи, как было описано в предыдущем разделе, протекает преимущественно на тех радикалах, концентрация которых наибольшая. В соответствии с этим обрыв цепи и в данном случае будет зависеть от реакционной способности реагентов. Так, при бромировании обрыв практически всегда осуществляется на малореакционноспособных радикалах Br·. Исключения могут составлять лишь радикалы, сильно стабилизированные эффектами заместителей, например, трифенилметильный радикал:
При хлорировании способ обрыва зависит от строения органического субстрата. Он происходит на углеводородном радикале, если хлорированию подвергаются высокореакционноспособные соединения со значительной долей вторичных и третичных атомов углерода или с наличием нескольких π-систем, поскольку именно такие вещества дают устойчивые радикалы, способные накапливаться в реакционной массе. Напротив, при хлорировании малореакционноспособных соединений (метан, хлорзамещенные углеводороды) образуются очень нестабильные радикалы, склонные быстро вступать в дальнейшие превращения, и в этом случае обрыв, в основном, протекает на хлор-радикале. В других реакциях радикального замещения наблюдаемые закономерности во многом близки к описанным выше.
Процессы окисления также относятся к реакциям радикального замещения, но механизм их протекания может быть более сложным и включать несколько параллельных стадий.
102
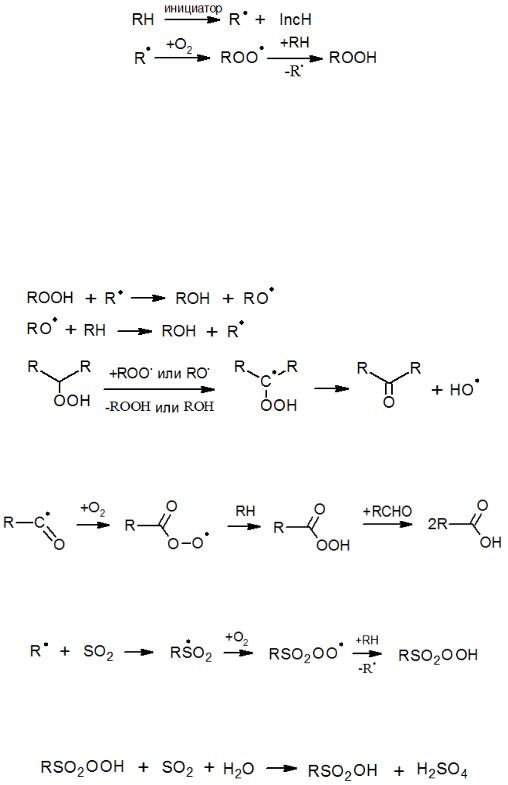
При окислении углеводородов ключевым направлением является образование гидропероксида. Процесс начинается с инициированного (напр., термически) отрыва протона от углеводородной цепи:
Обычно пероксидные радикалы малоактивны, в связи с чем стадия образования гидропероксида довольно медленная. Очевидно, что обрыв цепи при окислении преимущественно протекает на RO2-радикалах. Реакции с участием гидропероксидов (или пероксидных радикалов), которые могут протекать по нескольким параллельным путям, обусловливают появление различных продуктов окисления. В первую очередь, при окислении парафинов образуются спирты и кетоны.
Окисление альдегидов в кислоты осуществляется через образование промежуточного перкислотного радикала:
Еще одним примером реакций замещения является процесс сульфоокисления, который включает следующие стадии:
В свою очередь, алкилсульфокислота образуется из надсульфокислоты по следующей схеме:
103
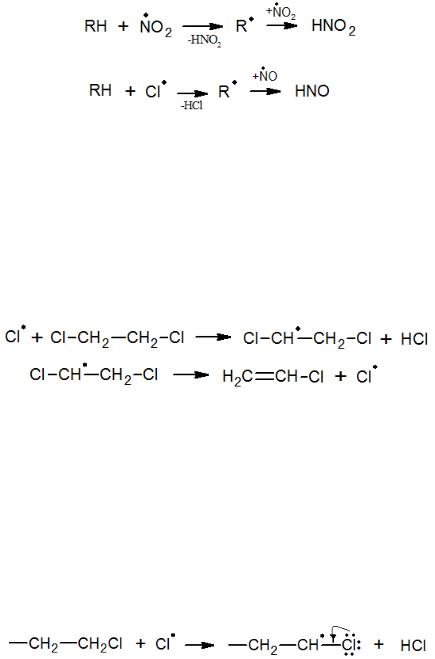
Реакции с участием оксидов азота, как правило, не являются цепными, поскольку они сами являются радикалами и при взаимодействии с ними активных происходит обрыв цепи, которую вели активные радикалы. Например, реакции нитрования и нитрозирования идут следующим образом:
Радикальное расщепление всегда происходит с образованием свободного радикала, чему благоприятствует одновременное образование стабильного органического вещества.
В качестве примера, в первую очередь, необходимо отметить реакцию термического дегидрохлорирования, имеющую промышленное значение. Так, один из самых крупнотоннажных мономеров органического синтеза – винилхлорид – получают путем дегидрохлорирования 1,2-дихлорэтана:
Зарождение цепи происходит при разрыве связи С–Сl в молекуле хлорпроизводного. Затем, образовавшийся хлор-радикал начинает звено цепи. Реакция также может быть инициирована молекулярным хлором.
По такому механизму отщепляют хлорид водорода все α,β-дигалогензамещенные (1,2-ди; 1,1,2-три-; 1,1,2,2-тетра- и пентахлорэтаны; 1,2-дихлорбутен и т.д.). Монохлор- и гем-дихлорзамещенные дают при атаке атомом хлора α- хлоралкильные радикалы, стабилизирующиеся за счет сопряжения с атомом галогена:
Отщепление атома хлора от них невозможно, и поэтому такие хлорпроизводные отщепляют HCl не цепным путем, а по молекулярному механизму:
104

При термическом дегидрировании и пиролизе цепь зарождается за счет расщепления углеводорода по С–С-связи. Образующиеся радикалы отрывают атомы водорода от исходного углеводорода, и далее цепь продолжается следующим образом:
Необходимо отметить, что для разрыва одних и тех же связей в радикалах требуется значительно меньшая энергия, чем в молекулах. Это объясняется одновременным образованием стабильной молекулы олефина, обусловливающим протекание расщепления именно на радикале. Отщепление водорода в молекуле более затруднено по сравнению с радикалами, чем объясняется предпочтительность пиролиза (крекинга) перед дегидрированием, особенно для углеводородов с длинной цепью. Чем стабильнее образующийся радикал, тем менее эндотермична будет реакция. Поскольку энергия активации эндотермической реакции не может быть меньше ее теплового эффекта, можно полагать, что именно эти стадии расщепления являются лимитирующими при продолжении цепи.
Направление расщепления и состав продуктов зависят от стадии отрыва атома водорода, которая идет преимущественно с промежуточным образованием более стабильного свободного радикала. Поэтому обычно соблюдается правило Зайцева (предсказывает образование более замещенного алкена), но радикальные реакции оказываются менее избирательными:
105

Реакция окисления в относительно жестких условиях приводит к расщеплению молекул исходных веществ. При окислении насыщенных и ненасыщенных углеводородов образуются кислородсодержащие продукты с меньшим числом атомов углерода, чем в исходном соединении:
Звено цепи при простом радикально-цепном присоединении по С=С-связи состоит из двух элементарных стадий:
К радикальному присоединению способны такие вещества, как галогены, галогеноводороды, сероводород, хлорзамещенные углеводородов, а также альдегиды и первичные спирты, которые сравнительно легко дают свободные радикалы при отрыве α-атома водорода.
При окислении олефинов одна из возможных реакций – присоединение кислорода по двойной связи с образованием эпоксидных циклов. В качестве реагентов могут выступать как гидропероксиды, так и пероксидные радикалы:
Несимметричные водородсодержащие реагенты (HBr, HSH, RSH) на стадии зарождения цепи расщепляются на два радикала (H● и Br●, H● и HS●, RS● и ●H). Оба
106

радикала взаимодействуют с олефином, образуя соответствующие новые радикалы, способные вести цепь. Эти новые радикалы, взаимодействуя с молекулой реагента, отрывают атом водорода, образуют продукт реакции и новый радикал Br●, HS●, или RS●, которые, далее, продолжают развитие цепи.
HBr |
|
|
h |
|
H* + Br* |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Br* + |
|
|
|
|
|
|
|
|
Br |
|
|
|
|
|
|
* |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Br |
|
|
|
|
* + HBr |
|
|
|
Br |
|
|
|
|
|
|
H + Br* |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
Совокупность элементарных стадий цепи всегда такова, что в развитой цепи всегда происходит отрыв атома водорода.
В случае несимметричного олефина радикал, первично атакующий ненасыщенный атом углерода, присоединяется таким образом, что промежуточно образуется наиболее стабильный из возможных радикалов (аналогично радикальному замещению). Оно схоже с правилом электрофильного присоединения (когда образуется наиболее стабильный карбкатион), но дает совсем другие результаты. Действительно, например, при радикально-цепном гидробромировании пропилена первично присоединяется по двойной связи не водород, а бром:
Этот процесс происходит при гидробромировании олефинов в присутствии кислорода или каталитических количеств пероксидов. Присоединение HBr осуществляется против правила Марковникова – механизм реакции в этом случае радикальный (эффект Караша).
Подобно гидробромированию, по радикальной реакции к олефинам присоединяется сероводород, дающий перв-меркаптаны:
107
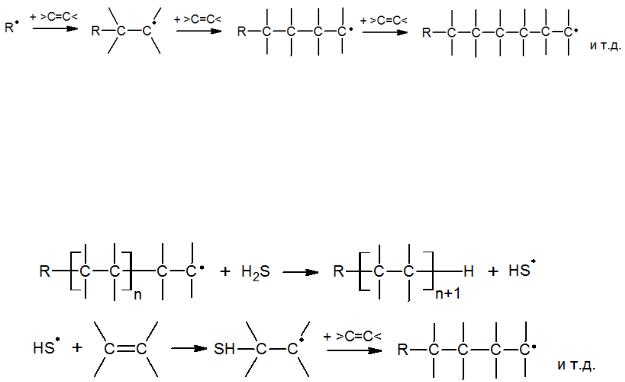
В большинстве реакций радикального присоединения из двух стадий продолжения цепи лимитирующей является вторая, которая восстанавливает первичный радикал в цепи реакций, так как энергетически она наименее выгодна. Это означает, что концентрация участвующего в ней радикала больше, чем второго, и обрыв цепи происходит именно на нем. От этого зависит и реакционная способность олефинов при радикальном присоединении, часто изменяющаяся в противоположном направлении по сравнению с электрофильными реакциями. Действительно, при наличии в олефине электронодонорных заместителей промежуточный радикал стабилизируется ими и оказывается менее реакционноспособным во второй, лимитирующей стадии продолжения цепи. Особенно медленно реагируют по радикальному механизму изоолефины и стирол, промежуточные радикалы которых сильно стабилизированы за счет эффектов сопряжения и сверхсопряжения.
Из реакций радикального присоединения особое значение имеет реакция полимеризации соединений с ненасыщенными связями (этилена, пропилена, винилхлорида, стирола, акрилонитрила, бутадиена). В этих случаях промежуточные радикалы последовательно присоединяются к все новым молекулам ненасыщенного вещества, образуя полимерные цепи:
Цепь обрывается за счет рекомбинации двух радикалов или их диспропорционирования.
При полимеризации часто наблюдаются реакции передачи цепи, при которых радикал отрывает атом водорода (или хлора) от молекулы растворителя, другой молекулы полимера, инициатора или специального вещества, добавляемого в смесь для регулирования молекулярного веса полимеров:
В результате рост материальной цепи полимера прекращается, но кинетическая цепь продолжается дальше, пока не произойдет ее обрыв рассмотренными ранее
108
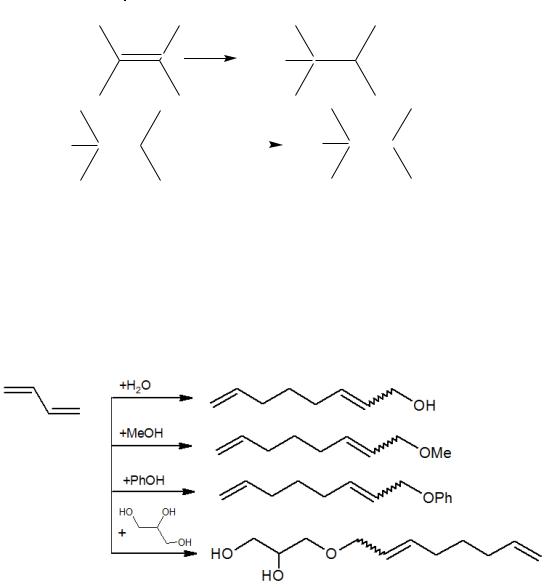
способами. Такая передача цепи при ее значительной скорости позволяет осуществлять процессы олигомеризации, или теломеризации (оборванной, или регулируемой полимеризации). Теломеризация – это цепная реакция внедрения повторяющегося фрагмента мономера М между двумя фрагментами соединения X – Y. Реакция приводит к набору гомологов, или теломеров X – Мn - Y, в которых число n меняется от 1 до 40. В частном случае, это реакция присоединения этилена к молекуле тетрахлорида углерода:
h
CCl4  CCl3* + Cl*
CCl3* + Cl*
CCl3* + |
CCl3 |
* |
|
CCl3 |
|
|
* + CCl4 |
|
CCl3 |
|
|
|
|
Cl + CCl3* |
|
|
|
|
|
|
|
В этом случае оба реагента находятся в реакционной массе в равных количествах, что дает возможность присоединить молекулы в соотношении 1:1. Очевидно, что регулируя доли исходных веществ, можно получить вещества с необходимым количеством мономерных звеньев, т.е. с желаемой молекулярной массой.
Примеры регулируемой теломеризации приведены ниже:
109
4.5. Кинетика неразветвленных и разветвленных цепных реакций
Неразветвленными называют цепные реакции, в которых новообразование свободных радикалов происходит только на стадии зарождения цепи; промежуточные радикалы и молекулярные продукты, образующиеся на стадиях продолжения цепи, не дают начала новым радикалам. К неразветвленным относится большинство рассмотренных выше процессов, за исключением окисления.
Ранее было показано, что при достаточно большой длине цепи скорости стадий продолжения цепи равны. Это означает, что скорости расходования и образования радикалов на стадиях продолжения цепи одинаковы. Поэтому принцип стационарности для концентраций свободных радикалов сводится к равенству скоростей зарождения и обрыва цепи,
2r0 = rt′ + rt′′ +
выраженным по концентрациям свободных радикалов.
Из многих способов обрыва цепи в каждой конкретной реакции, как уже говорилось выше, обычно преобладает один – линейный или квадратичный – на радикале, концентрация которого является более высокой из-за его меньшей реакционной способности. Тогда
2r0 = rt
можно выразить неизвестную концентрацию радикалов, на которых обрывается цепь, через измеряемые величины (концентрации других, более устойчивых компонентов), подставить ее в уравнение скорости лимитирующей стадии продолжения цепи и получить выражение для общей скорости процесса.
При линейном обрыве цепи в результате взаимодействия радикала Х● со стенкой (а) или ингибитором (б) имеем, соответственно:
а) 2 = |
|
|
[ ∙]; |
[ ∙] = |
|
20 |
; |
|
|||
|
|
||||||||||
|
0 |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
б) 2 |
= |
|
[ ∙][ ]; |
[ ∙] = |
|
20 |
. |
||||
|
|
||||||||||
0 |
|
|
|
|
|
|
[ ] |
||||
|
|
|
|
|
|
|
|
|
|
|
|
Если в лимитирующей стадии продолжения цепи радикал Х● реагирует с веществом А, скорость реакции при линейном обрыве цепи будет равна:
а) = [ ∙][ ] = |
2 0 |
[ ]; |
б) = |
2 0 |
|
[ ] |
. |
|
|
[ ] |
|||||
|
|
|
|
|
|
|
|
|
|
|
110 |
|
|
|
|
