
МЕХАНИЗМЫ МЕТОДИЧКА
.pdf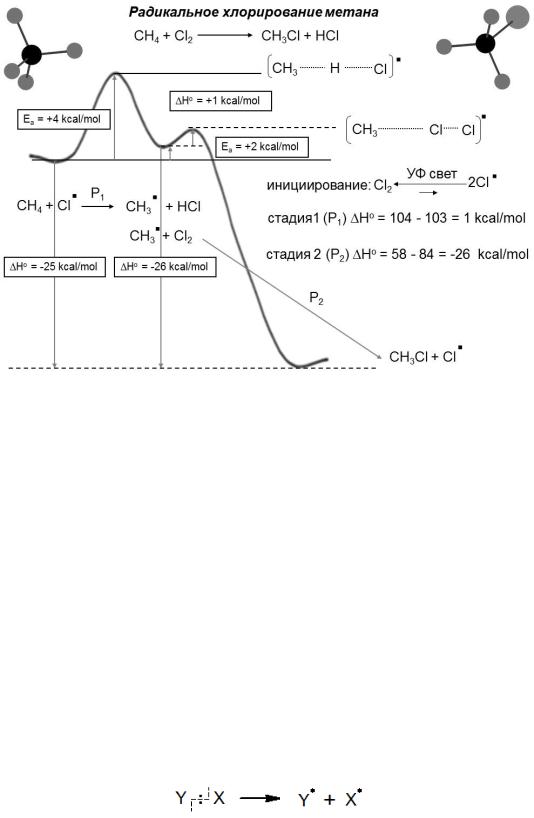
Рис. 4.1 Энергетическая диаграмма радикальной реакции хлорирования метана
На диаграмме (рис. 4.1) показано изменение энергии системы, происходящее по мере прохождения по координате реакции. Видно, что максимальный энергетический барьер соответствует промежуточному образованию метильного радикала, который с уже меньшим энергетическим барьером взаимодействует с молекулой хлора, регенерируя атом хлора и образуя хлорзамещенный продукт;
3) обрыв цепи – исчезновение свободных радикалов.
Cl· + Cl· → Cl2
4.1. Зарождение цепи, термическое и химическое зарождение цепи
Образование свободных радикалов происходит при гомолитическом разрыве какой-либо связи в молекуле:
Энергии связей достаточно велики, и для их разрыва необходим подвод энергии извне в виде тепла или излучения. Необходимо отметить, что намного легче разрыв связи и образование радикалов проходят в тех молекулах, в которых образующаяся
91
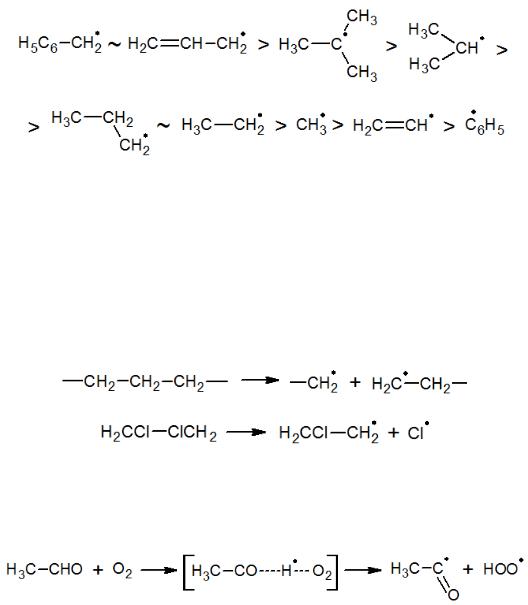
частица может быть стабилизирована за счет эффектов сопряжения и гиперконъюгации (сопряжение с -СН3 группой). Таким образом, свободные радикалы наиболее охотно образуются из разветвленных алканов, олефинов, а также в сопряженных ароматических системах (бензильный радикал). Стабильность алкильных радикалов понижается в ряду третичный > вторичный > первичный. Еще более высокой стабильностью обладают аллильный и бензильный радикалы, тогда как фенильный и винильный радикалы менее стабильны, чем метил-радикал:
Одновременно с этим, чем стабильнее радикал, тем меньшей реакционной способностью он обладает, тем больше будет его концентрация в реакционной массе.
Термическое зарождение цепи проходит под действием тепловой энергии. Обычно, в молекулах углеводородов в первую очередь рвется связь С–С, поскольку является наименее прочной. В молекулах хлорпроизводных цепь зарождается за счет отщепления хлор-радикала.
При термическом окислении карбонильных соединений инициирование осуществляется за счет отрыва α-атома водорода путем одновременного образования водородной связи с кислородом:
Далее для описания радикальных реакций потребуются кинетические уравнения, выражающие зависимость скорости химической реакции от концентраций реагентов. Выводятся они на основе закона действующих масс, который гласит, что скорость элементарной химической реакции пропорциональна
92
произведению концентраций реагирующих веществ в степенях, равных их порядкам в данной реакции. Например, для уравнения реакции вида:
νАА + νВВ + νFF → νDD + νEE ,
кинетическое уравнение записывается следующим образом:
υ = k·C(A)νA · C(B)νB · C(F)νF ,
где υ – скорость химической реакции, k – константа скорости.
Порядок компонента в реакции часто (но не всегда) равен его молекулярности, то есть количеству частиц вещества, участвующих в элементарном акте. Но, в общем случае, порядки определяют вид математических зависимостей и кинетических кривых, описывающих законы протекания того или иного процесса. Различают частные порядки реакции, соответствующие степеням, в которые возводятся каждые из участников реакции, и общий порядок, равный сумме частных порядков. Константа скорости k является коэффициентом пропорциональности в кинетическом уравнении, а физический смысл её вытекает из того же закона действующих масс: k – это скорость химической реакции при равенстве концентраций реагентов 1 моль/л.
Таким образом, обозначив скорость зарождения цепи через r0, при мономолекулярном распаде имеем:
r0 = k0[A],
и при бимолекулярных реакциях зарождения цепи:
r0 = k0[A][Y],
где A, Y – исходные вещества (в квадратных скобках обозначают текущие концентрации реагентов).
Химическое инициирование цепи проходит под действием специальных веществ – инициаторов. Они способны легко расщепляться на реакционноспособные радикалы, причем, обычно это происходит при более мягких условиях (низкая температура), чем требуется для разрыва связей в молекулах основных реагентов. Так можно существенно ускорить процесс зарождения цепи и саму реакцию, что особенно важно в случае использования термически нестабильных веществ.
В качестве инициатора может выступать хлор, обладающий сравнительно невысокой энергией связи, а также азотная кислота и оксиды азота, которые сами являются радикалами:
93
HO NO |
2 |
HO NO |
RH NO |
R HNO |
2 |
|
2 |
2 |
|
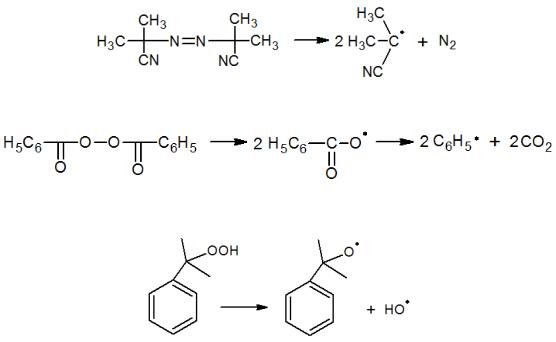
Чаще всего в качестве инициаторов используют специальные вещества, такие как азосоединения (азо-бис-изобутиронитрил – АИБН), органические пероксиды (перекись бензоила, перекись трет-бутила), гидропероксиды (гидроперекись кумола, гидроперекись этилбензола), надкислоты, пероксид водорода, неорганические перекисные соединения (персульфаты, пербораты). Инициаторам свойственно распадаться с достаточной скоростью в определенной области температур, характерной для каждого определенного соединения (АИБН при 80–90 °С, бензоилпероксид при 90–100 °С, трет-бутилпероксид при 150 °С), что, очевидно, необходимо учитывать при проведении инициируемых ими радикальных процессов.
Вначале молекулы инициаторов диссоциируют с образованием специфического для каждого типа инициатора радикала. Например, из АИБН (азо-бис-изо-бутиро- нитрил):
Из бензоилпероксида:
Из гидропероксида кумола (ГПК):
Затем этот радикал взаимодействует с основным реагентом, давая радикал, который будет участвовать в продолжении цепи. Например, при получении ГПК радикально-цепным окислением изопропилбензола, в качестве инициатора используют сам гидропероксид или некоторое количество реакционной массы после окисления:
94
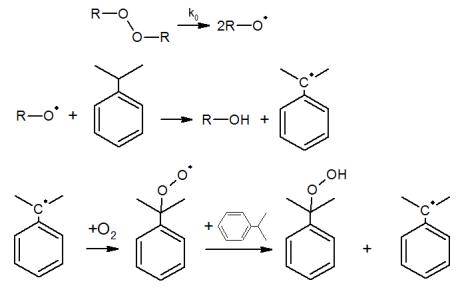
Стадия распада инициатора, как правило, является самой медленной, вследствие чего именно она определяет скорость зарождения цепи. При мономолекулярном распаде:
r0 = kи [Inc2]
Распад пероксидных соединений можно ускорить солями металлов переменной валентности (Mn, Co, Cu, Fe), которые катализируют ряд окислительновосстановительных реакций:
H2O2 + Fe2+ → HO· + HO- + Fe3+
H2O2 + Fe3+ → HOO· + H+ + Fe2+
RCOOOH + Mn2+ → RCOO- + HO· + Mn3+ и т.д.
RCOOOH + Mn3+ → RCOОO + H+ + Mn2+
В отличие от инициаторов, металлы–катализаторы во время реакции не расходуются, и их концентрация остается постоянной. Образующиеся при распаде частицы превращаются затем в стабильные вещества, которые содержатся в продуктах реакции в виде примесей.
4.2. Реакции фотолиза и радиолиза
Иногда радикальные реакции проводят под действием электромагнитного излучения. Различают реакции фотолиза (под действием УФ-облучения) и радиолиза (рентгеновское или γ-излучение). Молекулы исходных реагентов, поглощая кванты энергии, способны переходить в возбужденное состояние. В
95
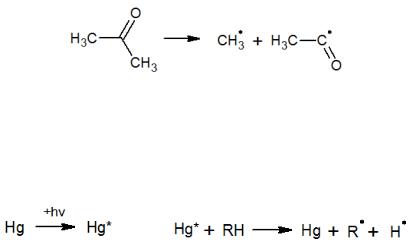
конечном итоге это приводит к разрыву межмолекулярных связей и образованию свободных радикалов, необходимых для развития цепи реакции.
Скорость таких процессов зависит только от интенсивности облучения, что дает возможность проводить их при пониженных температурах. Причем связи в молекуле могут разрушаться при условии, что энергия поглощаемых квантов не меньше энергии этих связей.
При фотохимическом инициировании молекула разрывается по самой слабой связи:
В случае если реагенты слабо или совсем не поглощают свет в приемлемой области спектра, используют так называемые сенсибилизаторы – вещества, которые передают энергию, поглощенную ими в виде квантов, реагирующим молекулам. В качестве такого вещества может служить ртуть:
Высокочастотные рентгеновские и γ-лучи способны разрушать все связи в молекуле с образованием не только радикалов, но даже ионов. Энергия такого излучения значительно превышает энергии связей атомов в молекулах. Тем не менее, преимущественно рваться будут те связи, которых больше в единице объема, или связи, занимающие периферийное положение (С–Н-связи в углеводородах).
Как уже говорилось выше, инициирующее действие излучения зависит от его интенсивности I, равной потоку квантов через единицу поперечного сечения за единицу времени. Этот поток уменьшается при прохождении через реакционную массу в соответствии с уравнением Ламберта–Бера:
dI = ɛI[A]dl,
где ɛ – коэффициент поглощения; [A] – концентрация вещества, поглощающего свет; l – толщина поглощающего слоя.
4.3. Продолжение и обрыв цепи
На стадии зарождения цепи образуются свободные радикалы, которые начинают новую цепь элементарных стадий, приводящую к образованию конечных продуктов
96
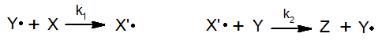
реакции. В этой цепи могут быть реакции замещения, присоединения, расщепления, специфичные для каждого конкретного случая. Например, в реакциях продолжения цепи:
свободный радикал Y· регенерируется на второй стадии и таким образом может принять участие в образовании продуктов не один раз, пока не исчезнет по той или иной причине.
Совокупность таких элементарных стадий, в результате которой образуется радикал, начинавший цепь, называется ее звеном. Число повторяющихся звеньев, составляющих цепь, называют ее длиной. Длина цепи может достигать многих тысяч. По этой причине уже небольшое количество инициатора или поглощенных квантов света приводит к образованию большого количества продуктов, что является одним из доказательств цепного механизма процесса.
В стационарных условиях для простой реакции скорость накопления продукта всегда равна скорости расходования исходного реагента. Отсюда следует, что
скорости всех элементарных стадий должны быть равны между собой. Таким образом, для реакций, описанных выше, имеем:
r1 = k1[Y·][X] = k2[X’·][Y] = r2 или [Y·]/[X’·] = k2[Y]/ k1[X]
То есть отношение стационарных концентраций разных свободных радикалов
обратно пропорционально произведению констант скоростей элементарных стадий и концентраций реагентов, с которыми эти радикалы взаимодействуют. Если одно произведение много меньше другого, то соответствующая стадия продолжения цепи называется лимитирующей. В этой стадии обычно участвует наименее реакционноспособный радикал, находящийся в реакционной массе в подавляющем количестве.
В результате обрыва цепи исчезают свободные радикалы, превращаясь в молекулярные продукты или в стабильные радикалы, не способные к дальнейшим превращениям. Реакции обрыва могут протекать моно- и би-молекулярно, в соответствии с чем различают квадратичный и линейный обрыв цепи.
Под квадратичным обрывом подразумевается бимолекулярное взаимодействие двух радикалов, неспаренные электроны которых образуют новую связь. Причем обрыв на двух различных радикалах носит название перекрестного обрыва.
R● + R● → RR X● + X● → XX |
R● + X● → RX |
97

Квадратичный обрыв иногда может протекать путем диспропорционирования углеводородных радикалов с образованием молекул олефина и парафина:
Рекомбинация свободных радикалов проходит с выделением большого количества тепла, а образующаяся молекула обладает значительной избыточной энергией, следовательно, способна обратно распадаться на свободные радикалы. Этого не происходит только в том случае, если эта энергия передается другой молекуле или стенке. Когда скорость передачи энергии превышает скорость обратного расщепления возбужденной молекулы, обрыв происходит при каждом столкновении радикалов, и его скорость описывается следующими кинетическими уравнениями:
rt = kt[R·]2
rt = kt[R·][X·],
где индекс t соответствует англ. termination (обрыв). Квадратичный обрыв характерен для жидкофазных и низкотемпературных процессов, когда концентрация радикалов и вероятность их столкновения достаточно велики.
Линейный обрыв цепи протекает мономолекулярно, например, на стенке сосуда или любой твердой поверхности:
Но чаще всего линейный обрыв происходит на ингибиторах, т.е. веществах, способных выводить активные радикалы из цепного процесса. Существует несколько видов ингибиторов. К ним относятся, например, соли металлов переменной валентности (Cu+, Fe2+, Mn2+), которые превращают радикалы в ионы за счет окислительно-восстановительных реакций:
HO· + Mn2+ → HO- + Mn3+
ROO· + Cu+ →ROO- + Cu2+
R· + FeCl3 → RCl + FeCl2 и т.д.
Наиболее широко в качестве ингибиторов используют специальные вещества, способные улавливать свободные радикалы, давая мало реакционноспособные радикалы или молекулярные продукты. Это могут быть фенолы, хиноны, амины, сернистые соединения и т.д. Механизм действия многих ингибиторов еще
98
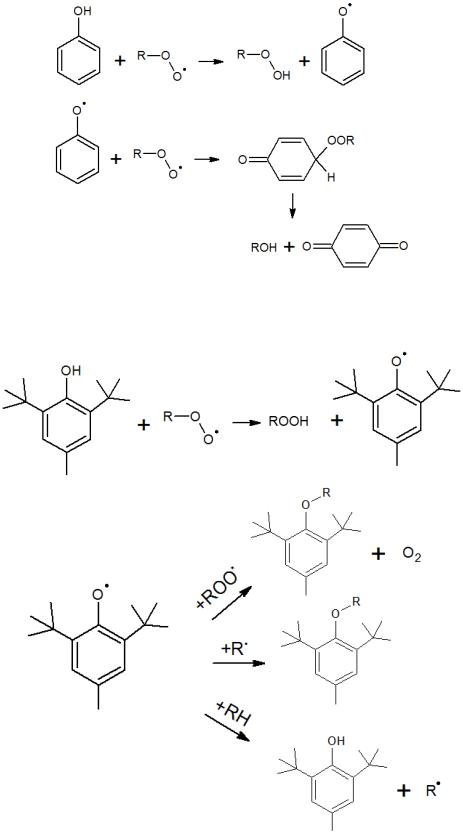
недостаточно изучен. Например, при ингибировании радикальных процессов окисления фенолами образуются спирты и хиноны, предположительно по следующей схеме:
Такие замещенные фенолы, как ионол (2,6-дитретбутил, 4-метилфенол), могут реагировать по нескольким путям:
99
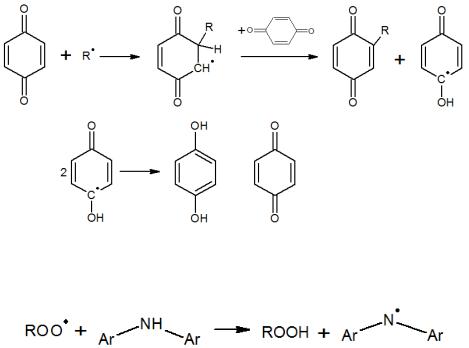
Причем в случае последней реакции отщепления водорода от молекулы исходного вещества следует учитывать крайне низкую константу скорости ввиду малой реакционной способности радикала, что и обусловливает ингибирующее действие ионола.
Ингибирование хиноном обычно представляют следующим образом:
Ароматические амины способны эффективно улавливать радикалы за счет разрыва слабой N–H-связи:
Ингибиторами могут быть стабильные радикалы (например, окислы азота), которые легко образуют с активными радикалами молекулярные продукты:
R· + NO2 → RNO2
Вцелом, в качестве ингибиторов могут выступать любые вещества, образующие стабильные малореакционноспособные радикалы (парафины изо-строения, алкилароматические соединения и пр.). Отсюда очевидно, что при проведении радикально-цепных реакций важным фактором является степень чистоты исходных реагентов. В частности, при получении полимеризационных пластмасс степень чистоты мономеров должна быть не менее 99.8 %, в противном случае не будет образовываться полимер с требуемой молекулярной массой.
Вприсутствии ингибиторов Ing скорость обрыва цепи равна:
rt = kt[Ing][X●]
Обрыв цепи, как правило, протекает на тех радикалах, концентрация и частота столкновений которых друг с другом или с ингибиторами больше. Ранее было показано, что этому условию удовлетворяют наименее реакционноспособные
100
