
1770
.pdfИ.Л.ЧУЛКОВА
ФИЗИЧЕСКАЯИКОЛЛОИДНАЯ ХИМИЯ
ВСТРОИТЕЛЬНОМ МАТЕРИАЛОВЕДЕНИИ
Омск - 2011
УДК 661
ББК 38.300
Рецензенты:
Директор по производству А.С.Парфенов (ООО «ЖБИ-Миллениум»), доктор технических наук, профессор В.М.Валов (ФГБОУ ВПО СибАДИ)
Работа |
одобрена |
редакционно-издательским советом академии в |
|
качестве учебного пособия |
для |
бакалавров, студентов, магистрантов и ас- |
|
пирантов, обучающихся |
по |
специальности 270106 – Производство |
|
строительных |
материалов, изделий и конструкций, направление 270800 |
||
«Строительство».
Ч89 Чулкова И.Л. Физическая и коллоидная химия в строительном материаловедении: учебное пособие. – Омск: СибАДИ, 2011. - 179 с.
Учебное пособие состоит из 8 глав, 25 приложений, содержит тесты и задачи. Приведены основы физической и коллоидной химии необходимые для понятия протекания процессов в строительном материаловедении. Предназначено для широкого круга читателей по специальности «Строительство»: бакалавров, студентов-специалистов, магистрантов, аспирантов, для инженерно-технических и научных работников промышленности строительных материалов и строительства.
ISBN 5 – 93204-275-3 |
© ГОУ «СибАДИ», 2011 |
Министерство образования и науки Российской Федерации Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
«Сибирская государственная автомобильно-дорожная академия (СибАДИ)»
И.Л.Чулкова
ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ В СТРОИТЕЛЬНОМ МАТЕРИАЛОВЕДЕНИИ
Учебное пособие
Омск
СибАДИ
2011
Введение
Более двухсот лет тому назад один из основоположников физической химии – гениальный русский ученый Михаил Васильевич Ломоносов – дал следующее определение этой науки: «Физическая химия – наука, которая должна на основании положений и опытов физических объяснить причину того, что происходит через химические операции в сложных телах». С тех пор физическая химия как наука прошла долгий путь, непрерывно развиваясь, усложняясь и охватывая все большее число химических объектов и методов исследования, однако, определение М. В. Ломоносова не утратило своего значения и даже сейчас поражает точностью формулировки.
Физическая химия характеризует связи между физическими и химическими явлениями, между физическими и химическими свойствами веществ. Установленные закономерности этих связей позволяют сформулировать общие принципы протекания химических реакций, необходимые для достижения конечной цели – предсказания направления реакции и получения нужного продукта.
Возникновение и развитие физической химии диктовалось прежде всего необходимостью создания теоретических и практических основ важнейших технологических процессов, определяющих прогресс цивилизации. Управление современными процессами с целью получения продуктов с заданными характеристиками потребовало создания современных физи- ко-химических методов исследования, анализа и производственного контроля веществ и их смесей. Глубокое изучение характеристик веществ и обобщение химических явлений привели к сильному проникновению в химию физики с ее уже развитым математическим аппаратом и наиболее прогрессивным объяснением сложных химических превращений на атом- но-молекулярном уровне.
Коллоидная химия выделилась в самостоятельный крупный раздел физической химии благодаря бурному развитию в последние десятилетия этой области науки, ее большой роли практически во всех процессах, связанных с жизнедеятельностью организмов, и во многих природных процессах. Изучение физической и коллоидной химии дает возможность получить более глубокие знания об окружающем мире и, в частности, позволяет на более высоком уровне решать проблемы, связанные с развитием научных основ ведения сельского хозяйства. Физико-химический подход позволяет понимать процессы, идущие в такой сложной системе, как почва, улучшать производство новых удобрений, внедрять более эффективные методы разработки и вводить химические средства борьбы с вредителями и болезнями растений. Исследования фотохимических реакций, столь блестяще начатые К. А. Тимирязевым, позволяют глубже понять сущность сложных процессов фотосинтеза. Исследование почвенных коллоидов – необходимое условие повышения плодородия.
3
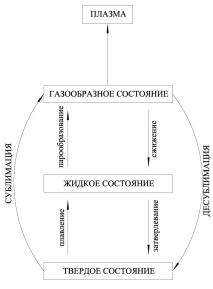
Глава 1. АГРЕГАТНЫЕ СОСТОЯНИЯ ВЕЩЕСТВА
1.1.Классификация состояний
Взависимости от расстояния между частицами и от степени их взаимодействия вещество может находиться в твердом, жидком или газообразном состоянии. Эти состояния называют агрегатными состояниями вещества (рис. 1).
|
Модель |
идеального газа |
была |
|||
|
получена при следующих условиях: |
|||||
|
1) идеальный |
газ |
образован |
|||
|
большим числом молекул или атомов, |
|||||
|
расстояние между которыми намного |
|||||
|
больше, чем размеры самих частиц; |
|||||
|
2) молекулы этого газа характе- |
|||||
|
ризуются определенной массой, одна- |
|||||
|
ко их собственным объемом можно |
|||||
|
пренебречь; |
|
|
|
|
|
|
3) молекулы находятся в непре- |
|||||
|
рывном беспорядочном движении; |
|||||
|
4) столкновения |
молекул |
между |
|||
|
собой, а также молекул со стенками |
|||||
|
сосуда - упругие. Это значит, что кине- |
|||||
|
тическая энергия может |
передаваться |
||||
Рис.1. Различные агрегатные |
от одной молекулы к другой, |
но она не |
||||
состояния |
переходит в |
другие |
формы |
энергии, |
||
например в теплоту; 5) между молекулами не существует взаимодействия, будь то притя-
жение или отталкивание.
1.2. Законы идеального газа
Состояние газа можно охарактеризовать тремя параметрами: температурой, давлением и объемом.
Единицей измерения термодинамической температуры Т в Международной системе единиц СИ является 1 Кельвин (К). Для выражения результатов практических измерений температуры t применяется градус Цельсия (°С) – единица температуры Международной практической температурной шкалы:
1 градус Цельсия (°С)=1 К.
Температура по Международной термодинамической и Международной практической шкалам может быть выражена как в градусах Цельсия, так и Кельвина. Соотношение между данными шкалами выражается уравнением Т= t+273,15, или T≈ t+273.
4
Давление газа р в системе СИ выражается в Паскалях. Паскаль — это давление, при котором на площадь 1 м2 действует сила в один Ньютон
(1Н):
р= 1 Н/1 м2 = Н/м2 = 1 Па (Паскаль).
Вкачестве единицы объема в системе СИ принят кубический метр (м3). Допускается применение дольных и кратных единиц (дм3, см3, мм3). В химии в качестве единицы объема используется литр (л):
л= 1,000028 дм3 = 1,000028 * 10-3м3.
При вычислениях с точностью до четвертого знака можно считать,
что 1 л ≈1 дм3 ≈ 1*10-3м3.
Температура 0°С (273 К) и давление 101325 Па характеризуют нормальные условия для газа (н. у.). Объем, занимаемый газом при этих условиях, обозначают через v0.
В производственных условиях довольно часто приходится иметь дело с газами, находящимися при низких давлениях и высоких температурах. В этом случае при расчетах без больших погрешностей можно использовать простые закономерности, установленные для идеальных газов.
Для данной массы газа при постоянной температуре произведение давления (р) на объем (v) есть величина постоянная (закон БойляМариотта), или при постоянной температуре объемы данной массы газа
обратно пропорциональны давлениям, под которыми находится газ: |
|
р1/р2=v2/v1. |
(1.1) |
Плотности газа ρ и его концентрации С при постоянной температу- |
|
ре прямо пропорциональны давлениям: |
|
ρ1/ρ2= p1/p2; |
(1.2) |
С1/С2=р1/р2. |
(1.3) |
При постоянном давлении объемы данной массы газа прямо пропорциональны абсолютным температурам (закон Гей-Люссака). При постоянном объеме давления данной массы газа прямо пропорциональны абсолютным температурам (закон Шарля):
v1/T1=v2/T2=v3/T3=…=vk/Tk; |
(1.4) |
p1/T1=p2/T2=p3/T3= … =pk/Tk. |
(1.5) |
Плотности и концентрации газа, находящегося под постоянным давлением, изменяются обратно пропорционально абсолютным темпера-
турам: |
|
ρ1/ρ2=Т2/Т1; |
(1.6) |
С1/С2=Т2/Т1. |
(1.7) |
5

Пример. Газ под давлением 1,2-105 Па занимает объем 4,5 л. Ка-
ково будет давление, если, не изменяя температуры, увеличить объем до
0,0055 м3?
Решение. Дано: |
|
|
|
|
|
p1= 1,2*105 Па |
|
Используем формулу закона |
|||
v1 |
= 4,5 л =4,5*10-3 м3 |
|
Бойля-Мариотта (1.1): |
|
|
v2 |
= 0,0055 м3 |
|
p1/p2 = v2/ v1. Откуда |
|
|
t = const |
|
p2 = p1 v1/ v2; |
|
||
|
р2 |
|
1,2 105 4,5 10 3 |
9,8 104 |
Па. |
|
|
||||
|
|
0,0055 |
|
|
|
Пример. При 37° С объем газа равен 0,5 м3. Какой объем займет газ при 100° С, если давление останется постоянным?
Решение. Определяем объем газа, применяя закон Гей-Люссака
(1.4):
v2= v1T2/T1.
В градусах термодинамической шкалы температура равна:
Т1 = 37 +273 = 310 К, Т2= 100+ 273 = 373 К,
v2 0,5 373 0,60м3 310
Пример. При н.у. концентрация метана равна 0,0447 кмоль/м3. Вычислить, при какой температуре и нормальном давлении масса 10 м3 метана будет равна 8 кг?
Решение. Из соотношения (7) определяем Т:
Т=С0Т0/С; Т0=273К.
Число киломолей метана равно 8/16=0,5, а концентрация С=0,5/10 = 0,05 кмоль/м3;
Т = 0,0447 – 273/0,05 = 244 К; t= 244 – 273= – 29°С.
1.3. Уравнение состояния идеального газа
Зависимость между объемами, давлениями и температурами для одной и той же массы газа выражается уравнением
p1vl/Tl = p2v2/T2 = p3v3/Т3 =……, |
(1.8) |
где v1 – объем газа при температуре Т1 и давлении р1 , м3, |
|
v2 – объем газа при температуре Т2 и давлении р2, м3, |
|
или |
|
р1v΄1/T1 = p2v '2/T2 = p3v '3/T3 = ... , |
(1.9) |
6 |
|
где v΄1, v΄2 , v΄3 – удельные объемы газа, м3/кг.
Уравнение (1.9) можно представить следующим образом: p1/ρ1T1= p2/ρ2T2. Следовательно:
2 |
1 |
р2Т1 |
. |
(1.10) |
|
|
|||||
|
|
рТ |
2 |
|
|
|
|
1 |
|
|
|
Уравнение (1.10) позволяет вычислить плотность газа при любых условиях, если известна величина плотности газа при определенных условиях. Уравнение (1.8) часто применяют для приведения объема газа к н.у., если объем его при каких-либо значениях p и t известен:
р0 v0/Т0 = p v/T. |
(1.11) |
В расчетах часто используется закон Авогадро и следствие, вытекающее из этого закона. В равных объемах различных газов при одинаковых температуре и давлении содержится одно и то же число молекул (закон Авогадро). Установлено, что моль любого вещества содержит одинаковое число молекул, равное постоянной Авогадро NА = 6,025·1023 моле- кул·моль-1. Поэтому объем 1 моля любого вещества, находящегося в состоянии идеального газа при одинаковых t и р, имеет одну и ту же величину. Так, при н.у. объем 1 кмоля равен 22,414 м3 (~22,4 м3), а объем 1 моля вещества в газообразном (идеальном) состоянии при этих же условиях со-
ставляет 22,4 л (~0,02240 м3) (следствие закона Авогадро). Плотность газа (кг/м3) при н. у.
ρ0 = М/22,4. |
(1.12) |
Пользуясь формулой (12), можно определить удельный объем любого газа (м3/кг) при н.у.:
v0 = 22,4/М. |
(1.13) |
При расчетах газов и газовых смесей широко пользуются уравнением состояния Менделеева-Клапейрона, выведенным на основе объединенного уравнения (1.8) с применением закона Авогадро:
рV=RT, |
(1.14) |
где V – объем одного киломоля идеального газа при давлении р (Па) и температуре Т (К), м3; R – молярная газовая постоянная, не зависящая от природы газа.
Для п киломолей идеального газа уравнение состояния (1.14) записывается так:
рv=nRT |
(1.15) |
где v = nV – объем п киломолей газа при давлении р и температуре Т; п=т/М, где т – масса газа, кг; М – масса одного киломоля газа;
7
pv = mRT/M. |
(1.16) |
В системе СИ R = 8,314·103 Дж/(кмоль·К) или R=8,314Дж/(моль·К). Газовую постоянную, отнесенную к 1 кг газа, определяют из уравнения
R΄=R/М = 8,314·103/М. |
(1.17) |
Пример. При 22° С и 95 940 Па объем кислорода равен 20 л. Рассчитать объем этого газа при н. у. Какова плотность кислорода при заданных условиях?
Решение. Из уравнения (1.11) определяем объем кислорода при
н.у.:
v0 |
pvT0 |
|
95940 |
20 273 |
17,5л. |
|
101325 |
(273 22) |
|||
|
pT |
|
|||
Плотность кислорода при н. у. согласно (1.12)
р0 = MO2 /22,4 = 32/22,4 = 1,428 кг/м3.
Используем (1.10) для нормальных и заданных условий:
0 |
рТ0 |
1,428 |
95940 273 |
1,252кг/м3. |
|
р0Т |
101325 295 |
||||
|
|
|
Пример. Сколько кубических метров диоксида углерода, измеренных при 22° С и 99 280 Па, можно получить при обжиге 1000 кг известняка с содержанием 90 % СаСО3 (в мас. долях, %)?
Решение. В 1000 кг известняка содержится 900 кг СаСО3 (остальное приходится на долю различных примесей). По уравнению реакции
СаСО3 t СаО + СО2
100 56 44
рассчитываем массу полученного диоксида углерода:
mCO2 = 44 – 900/100 = 396 кг.
Определяем объем СО2 при указанных условиях по уравнению (1.16):
|
mCO2 RT |
396 8,314 103 295 |
|
|||
v |
|
|
|
|
222,3 |
м3. |
MCO2 |
|
|
||||
|
p |
44 99280 |
|
|||
Пример. При 27° С и 106 600 Па масса 380 см3 газа равна 0,4550 г. Определить молекулярную массу (кг) и его плотность при 50° С и том же давлении.
Решение. Из уравнения (1.16), выразив все величины в системе СИ, находим
M |
mRT |
0,4550 10 3 8,314 103 300 |
28,00 кг. |
||
|
|
|
|
||
|
106600 380 10 |
6 |
|||
|
pv |
|
|
||
|
|
|
8 |
|
|
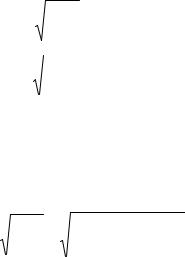
Плотность газа при н.у. согласно (1.12)
ρ0 = 28,00/22,4 = 1,250 кг/м3.
Плотность газа при 50° С рассчитываем по формуле (1.6):
ρ= ρ0Т0/Т = 1,250 – 273/323 = 1,057 кг/м3.
1.4.Скорость движения молекул газа
Молекулы газа, непрерывно сталкиваясь друг с другом и со стенками сосуда, движутся с различными скоростями (u1, u2, u3, ..., uп) и распределяются по скоростям движения в соответствии с законом распределения Максвелла. В кинетической теории газов пользуются величинами средней арифметической иа и средней квадратичной скорости и. Средние скорости uа и и зависят от природы газа, изменяются с температурой и вычисляются по формулам
иа |
|
8RT |
|
, |
(1.18) |
||
|
M |
||||||
|
|
|
|
|
|||
|
|
|
|
|
|
||
u |
3RT |
, |
|
(1.19) |
|||
|
|
||||||
|
|
|
M |
|
|
||
где М – молекулярная масса газа; R - молярная газовая постоянная; Т – абсолютная температура газа.
Пример. Вычислить среднюю арифметическую скорость движения молекул кислорода при 6000С (873 К).
Решение. Используем формулу (1.18):
иа |
8RT |
8 8,314 103 873 |
|
||
|
|
|
760,2 |
м/с. |
|
|
|
||||
|
M |
3,14 32 |
|
||
1.5. Неидеальные газы
Законы идеальных газов, следствия, вытекающие из этих законов, и уравнения состояния (1.15), (1.16) часто используют в различных технохимических расчетах. Однако хорошее совпадение вычисленных результатов с опытными данными наблюдается лишь в ограниченной области температур и давлений. Газы, находящиеся в условиях, для которых неприменимы законы идеальных газов и уравнения газового состояния (1.15), (1.16), называются реальными или неидеальными. Параметры состояния р, V, Т таких газов для 1 кмоль связаны между собой уравнением Ван-дер-Ваальса
|
|
a |
|
|
|
|
р |
|
|
V b RT, |
(1.20) |
V |
2 |
||||
|
|
|
|
|
|
|
|
|
|
9 |
|
