
1770
.pdf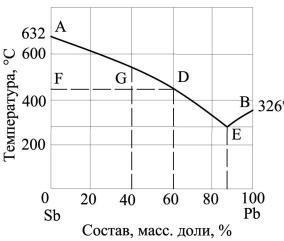
Пример 1.
Воспользовавшись диаграммой состояния Sb–Pb (рис. 3) определить количество выкристаллизовавшейся сурьмы при охлаждении до 430°С 3 кг жидкого сплава с содержанием 40 масс, доли, % свинца.
Решение. Если сплав указанного состава охладить до 430°С, то состояние его на диаграмме будет изображаться точкой G. По мере кристаллизации сурьмы процентное содержание свинца в жидком сплаве
возрастает до 60 масс, доли, %. Обо-
значим массу выкристаллизовав- Рис.3. Диаграмма состояния системы Sb─Pb
шейся сурьмы р, а массу жидкого сплава Р. Согласно правилу рычага (или правилу отрезков) количество выкристаллизовавшейся фазы р так относится к количеству взятого жидкого расплава Р, как отрезок, прилегающий к кривой кристаллизации GD, к отрезку FD, характеризующему состав жидкой фазы при охлаждении до заданной температуры, т. е. p/P=GD/FD.
Отсюда p=P(GD/FD). Из рис. 3 следует, что FD=60, a GD = 60 –
– 40=20. Тогда р = 3 (20/60) =1 кг сурьмы.
Пример 2. Эвтектический сплав сурьмы и свинца содержит 13% (масс, доли, %) сурьмы (см. рис. 3). Какой из металлов и в каком количестве будет находиться в сплаве в виде кристаллов, вкрапленных в эвтектику, если 10 кг жидкого сплава, содержащего 10% (масс, доли, %) сурьмы, охладить до полного его затвердевания.
Решение. Состав сплава: 10% Sb, 90% Pb. Определим количество (кг) каждого из металлов в 10 кг жидкого сплава; свинца 10·0,9=9 кг, сурьмы 10·0,1=1 кг. Так как содержание сурьмы в сплаве меньше, чем содержание ее в эвтектике, то вся сурьма израсходуется на образование эвтектики. Определим массу эвтектического сплава. Согласно условию в 100 кг эвтектического сплава содержится 13 кг сурьмы. Составим пропорцию
13/1 = 100/х, откуда х= (100·1)/13 = 7,7 кг.
Остальная часть сплава представляет собой кристаллы свинца, вкрапленные в эвтектику. Масса их равна 10 – 7,7=2,3 кг.
50
Глава 4. ХИМИЧЕСКАЯ КИНЕТИКА
4.1. Кинетика и механизм реакций. Реагенты и продукты
Известно, что некоторые химические реакции проходят мгновенно, тогда как другие – крайне медленно, и что некоторые реакции начинаются бурно, а затем замедляются, в то время как другие, наоборот, начинаются медленно, а затем ускоряются. Законы протекания химических реакций во времени – предмет кинетического исследования химических реакций.
Вещества, вступающие в процесс химического превращения, называются исходными веществами или реагентами.
Вещества, образующиеся в процессе химического превращения и не перетерпливающие в ходе этого процесса дальнейших химических изменений, называются продуктами реакций.
Вещества, образующиеся в одних стадиях процесса химического превращения и расходующиеся в других стадиях этого же процесса, называются промежуточными веществами, а реакции с участием промежуточных веществ называются промежуточными реакциями.
При изучении кинетики реакций в растворах учитываются следующие физические свойства растворов: окраска, вращение плоскости поляризации, электрическая проводимость, коэффициент преломления, изменение температуры замерзания. Довольно часто продукты образуются в наномолярных (10-9моль) количествах. В подобных исследованиях применяют чувствительные физические методы, такие как газовая хроматография, масс-спектрометрия и изотопные метки.
4.2. Скорость химической реакции
Скорость химической реакции определяется как изменение концентрации веществ в единицу времени и в единице объема.
Кривая, отражающая изменение концентраций какого-либо вещества во времени в ходе химического превращения, называется кинетической кривой.
Рассмотрим подробнее изменение концентрации продукта В
(рис. 5).
Если в моменты времени t1 и t2 концентрации продукта равны С1 и С2, то среднюю скорость vт в интервале времени t1 и t2 можно выразить как
vm |
|
C2 |
C1 |
|
C |
|
t2 |
t1 |
t |
||||
|
|
|
51

Рис. 4 Кинетические кривые |
Рис. 5. Кинетическая кривая |
для реагентов и продуктов |
для продуктов реакции |
реакции |
|
Чтобы выражение для скорости было всегда положительным, при убывающей концентрации реагента необходимо правую часть уравнения записывать с отрицательным знаком:
C vm t .
Если же скорость реакции определяется при увеличивающейся концентрации продукта, то уравнение будет записано с положительным знаком:
C vm t .
Таким образом, в общем случае выражение скорости должно быть представлено в виде
C vm t .
В каждый момент времени мгновенная скорость равна тангенсу угла наклона кривой С=f(t) в данной точке:
|
|
|
|
dC |
tg |
|
|
|
|
|
|
|
|
||
|
|
|
|
dt |
|
|
|
Рассмотрим обратимую (двустороннюю) реакцию |
|
||||||
|
|
|
|
k1 |
,k2 |
|
|
|
|
А+В С+ D |
|
||||
Скорость уменьшения концентрации вещества А при протекании |
|||||||
прямой реакции определяется уравнением |
|
||||||
|
d A |
k A B , |
(4.1) |
||||
|
|||||||
|
dt |
1 |
|
|
|
||
|
|
|
|
|
|
|
|
а скорость возрастания концентрации вещества А при протекании обратной реакции – уравнением
52

d A |
k2 C D . |
(4.2) |
|
||
dt |
|
|
Если в начальном состоянии системы в ней содержатся только вещества А и В, то скорость прямой реакции уменьшается по мере течения ее в соответствии с уменьшением этих концентраций. Таким образом, зависимость этой скорости от времени представляется кривой 1 (рис. 6); если бы не было обратной реакции, эта кривая достигла бы оси абсцисс при израсходовании одного из исходных веществ.
Кривая 2, относящаяся к скорости обратной реакции, начинается в начале координат (так как по условию в начальный момент [С] = [D] =0) и повышается по мере течения прямой реакции с увеличением этих концентраций.
Общая скорость реакции в любой данный момент равна разности скоростей
Рис. 6. Кинетические кривые |
прямой и обратной реакций: |
|
|
|
||
прямой и обратной реакции |
|
d C |
k A B k |
|
C D |
. |
|
|
2 |
||||
|
|
dt |
1 |
|
||
|
|
|
|
|
|
|
При дальнейшем течении реакции кривые 1 и 2 должны где-то пересечься, т. е. должно быть достигнуто такое состояние, при котором скорости прямой v1 и обратной v2 реакций станут равными. После достижения этого концентрации каждого из компонентов реакции будут постоянными. Таким образом, в системе будет достигнуто состояние равновесия, когда скорости прямой и обратной реакций будут равны между собой по абсолютному значению. Следовательно, должны быть равны и правые части уравнений (4.1) и (4.2):
k1 [А] [В] =k2 [С] [D],
откуда
k1 |
|
C D |
||
|
|
|
||
k2 |
A B . |
|||
|
||||
Правая часть этого равенства представляет собой константу равновесия К данной реакции и, следовательно,
Кс = k1/k2,
т. е. константа равновесия равна отношению констант скоростей прямой и обратной реакций.
Этот вывод четко показывает динамический характер равновесия в химических реакциях.
53
Гетерогенные реакции. Когда реакция совершается между веществами, находящимися в различных фазах, то законы кинетики гомогенных реакций уже не могут быть применены.
В гетерогенных реакциях роль промежуточных продуктов обычно играют молекулы, связанные с поверхностью химическими силами, т. е. химически адсорбированные на поверхности. В химическом механизме гетерогенной реакции существенны обычно те или иные адсорбционные стадии (см. гл. 7). Поэтому гетерогенный химический процесс можно подразделить на следующие стадии:
1)диффузия частиц реагентов к реакционной зоне, находящейся на поверхности раздела фаз;
2)активированная адсорбция частиц реагентов в реакционной поверхностной зоне;
3)химическая реакция в этой зоне;
4)десорбция продуктов реакции, образовавшихся в реакционной
зоне;
5)диффузия продуктов реакции из реакционной зоны. Стадии 1 и 5 называются диффузионными, а стадии 2, 3, 4 – кинетическими.
Универсального определения скорости для гетерогенного процесса не существует. Так как суммарная скорость определяется как чисто диффузионной, так и кинетической стадией, то при оценке скорости гетерогенного процесса необходимо точно знать, в какой области – диффузионной или кинетической — совершается данная реакция.
Цепные реакции. Они отличаются от обычных взаимосвязанностью элементарных актов, когда каждый осуществляемый в системе акт генерирует один или несколько других элементарных актов. Цепная реакция протекает благодаря наличию частиц с повышенной химической активностью.
В создании современного учения о цепных реакциях основная роль принадлежит работам лауреатов Нобелевской премии по химии 1956 г. — Н. Н. Семенова и С. Хиншельвуда.
Цепные реакции являются очень распространенными. По цепному механизму, например, могут совершаться многие реакции окисления углеводородов. Процессы сгорания горючего в цилиндрах двигателей внутреннего сгорания во многом обусловлены цепным механизмом. Процессы полимеризации также большей частью протекают по типу цепных реакцией. Значительную роль эти реакции играют в биологических процессах.
Для всех цепных реакций характерны три стадии: 1) зарождение (возникновение) цепи; 2) развитие цепи; 3) обрыв цепи.
Зарождение цепи является первичной реакцией, которая связана с получением в системе или введением в нее химически активных частиц или, как их еще называют, активных центров. Зарождение цепи может происходить под воздействием света, радиоактивного излучения или вы-
54

сокой температуры, а также осуществляться благодаря введению в систему атомов. Например, если в смесь Н2 и С12 ввести пары натрия, то они будут причиной возникновения активных центров. Возникновение цепей может происходить вследствие самого акта химической реакции, при которой образуются радикалы.
В последних своих работах Н. Н. Семенов и его школа сделали открытие (1976), что генерирование активных частиц возможно и в молекулярных реакциях при условии, что реагирующие молекулы обладают избыточной энергией.
Цепи, возникающие при помощи свободных атомов и радикалов, называются химическими или радикальными. Примером может служить фотохимическая реакция образования хлороводорода. Первичными активными центрами данной цепной реакции являются атомы хлора, возникающие в результате расщепления молекул хлора под воздействием квантов света, обладающих высокой энергией. Атомы хлора вступают в реакцию с молекулами водорода; возникающие атомы водорода, в свою очередь, реагируют с молекулами хлора, образуя атомы хлора и т. д.:
Сl2 + hv→2Cl• |
(зарождение цепи) |
H2 + Cl•→HCl + H• |
(развитие цепи) |
Cl2 + H•→HCl + Cl•
…………………………
Cl• + Cl•→ Cl2 (обрыв цепи)
Таким образом, реакция хлора с водородом осуществляется при помощи двух активных центров: атомов хлора и водорода.
Число молекул продукта реакции, приходящееся на одну активную молекулу, называют длиной цепи.
Обрыв цепи может происходить не только при воздействии свободного радикала с другим свободным радикалом в так называемом процессе рекомбинации радикалов. Очень часты взаимодействия свободного радикала с материалом стенки сосуда, где протекает реакция, что также приводит к обрыву цепи.
Если в каждом звене цепи на каждый исчезнувший активный центр приходится не более одного вновь возникающего, то такие реакции называются простыми цепными реакциями. Если в одном звене цепи на один исчезнувший активный центр в среднем возникает больше одного нового центра, то такие цепные реакции называются разветвленными. Таким образом, в разветвленных цепных реакциях один радикал вызывает появление более чем одного нового радикала, так что число радикалов по мере
протекания реакции возрастает в геометрической прогрессии. |
|
В качестве примера рассмотрим реакцию взаимодействия Н2 |
и О2 |
при 923 К. Стадией инициирования реакции является процесс |
|
Н2 + О2 →Н2О+О• |
(4.3) |
55 |
|

Генерированные атомы кислорода приводят к следующим трем реакциям:
(4.4)
(4.5)
(4.6)
Получается разветвленная цепь, поскольку на каждый атом кислорода, возникающий в реакции (4.2), образуется избыточный атом Н• в результате протекания реак-
ций (4.4) – (4.6). Эти ре-
акции дают снова атом кислорода. Если простую цепную реакцию условно можно представить в виде зигзагообразной линии (рис. 7), каждый прямоугольный участок которой обозначает одно звено цепи, а число таких участков – число звеньев, т. е. длину цепи, то разветвленную цепную реакцию можно представить разветвленной зигзагообразной линией. В предельном случае разветвление осуществляется на каждом звене цепи. Такие цепи называют сплошь разветвленными.
4.3. Влияние температуры на скорость химической реакции. Уравнение Аррениуса
На скорость химических реакций существенное влияние оказывает даже незначительное изменение температуры. У большинства гомогенных реакций при повышении температуры на 10°С скорость возрастает в 2–4 раза (приближенное правило Вант-Гоффа). Увеличение скорости реакции при повышении температуры связано с возрастанием константы скоростиреакции; концентрации реагирующих веществ при этом практически не изменяются. Соотношение
kt+10/kt = γ |
(4.7) |
называется температурным коэффициентом скорости реакции, где k – константы скорости при температурах t+10 и t°C. Для различных реакций γ колеблется в пределах от 2 до 4. На основании (110) можно записать, что
kt2 /kt1 |
t2 t1 |
|
10 |
(4.8) |
|
Логарифмируя (111), получим |
|
|
lg(kt2 |
/kt1 |
) |
t2 t1 |
lg , |
(4.9) |
|
|||||
|
|
10 |
|
|
|
|
|
56 |
|
|
|
где k1 и k2 константы скорости при температурах t1 и t2. Более точная зависимость константы скорости (а следовательно, и, скорости реакции) от температуры выражается уравнением Аррениуса t
|
kT |
|
E |
|
|
1 |
1 |
|
|
||
2,203lg |
|
2 |
|
|
акт |
|
|
|
|
|
|
k |
|
R |
|
T |
T |
. |
(4.10) |
||||
|
|
T1 |
|
|
|
|
1 |
2 |
|
|
|
где kT1 и kT1 - константы скорости реакции при температурах Т1 и Т2 (К);
Еакт – энергия активации данной реакции (зависит от природы реагирующих веществ), Дж/моль.
Пример. Используя приближенное правило Вант-Гоффа, вычислить, на сколько нужно повысить температуру, чтобы скорость реакции возросла в 80 раз? Температурный коэффициент скорости принять равным 3.
Решение. Используем уравнение (4.9): |
|
||||||||||||
|
lg(kt2 /kt1 ) |
t2 t1 |
lg ; |
||||||||||
|
|
||||||||||||
|
|
t2 |
t1 |
|
|
10 |
|
|
|
||||
lg80 |
lg3 (t2 t1)0,04771; |
||||||||||||
|
|
|
|||||||||||
|
10 |
|
|
|
|
|
|
|
|
||||
t2 t1 |
|
|
lg80 |
|
1,9031 |
|
39,890 . |
||||||
|
|
|
|
|
|||||||||
|
0,04771 |
0,0471 |
|
||||||||||
Таким образом, чтобы скорость реакции возросла в 80 раз, необходимо повысить, температуру примерно на 40° С.
Пример. Воспользовавшись приближенным правилом Вант-Гоффа, вычислить, при какой температуре некоторая реакция закончится за 25 мин, если при 20° С на это требуется 2 ч. Температурный коэффициент скорости реакции 3.
Решение. Между константами скоростей и временем завершения реакции существует обратно пропорциональная зависимость:
kt |
/kt |
|
1 / |
2 , |
|
2 |
1 |
|
|
где τ1 и τ2 – время завершения реакции при температурах t1 и t2. Тогда уравнение (4.9) можно записать так:
|
|
|
|
|
lg( 1 |
/ 2) |
t2 t1 |
|
lg , |
|
||||
|
|
|
|
|
|
|
|
|||||||
Откуда |
|
|
|
|
|
|
|
10 |
|
|
|
|
||
|
|
|
|
|
|
|
|
10lg( 1 / 2) |
|
|
||||
|
|
|
|
t2 |
t1 |
|
, |
а |
||||||
|
|
|
|
lg |
||||||||||
t |
2 |
|
10lg( 1 / 2) |
t |
|
10lg 120/25 |
|
20 34,280C |
||||||
|
|
|||||||||||||
|
|
lg |
|
1 |
|
|
|
lg3 |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
57 |
|
|
|
|
|
|

Пример. Для одной из реакций были определены две константы скорости, при 443° С 0,00670 и при 497°С 0,06857. Определить константу скорости этой же реакции при 508° С.
Решение. По двум значениям констант скорости реакции, используя (4.10), определяем величину энергии активации реакции:
Еакт 2,303RT1T2 lg(kT2 /kT1 ) ;
T2 T1
Т1=716 К, Т2=770 К,
Еакт 2,303 8,314 716 770lg(0,06857/0,00670) 197400 Дж/моль. 770 716
Рассчитаем константу скорости реакции при t=508° С. Используем в расчетах константу скорости при 497° С и уравнение (113):
|
kT |
2 |
|
E |
|
|
|
1 |
1 |
|
|
|
|
||
2,203lg |
|
|
|
акт |
|
|
|
|
; |
|
Т3=781 К; Т2=770 К; |
||||
k |
|
R |
|
|
T |
T |
|
|
|||||||
|
T1 |
|
|
|
|
|
1 |
2 |
|
|
|
|
|||
|
|
|
lgkT |
|
Еакт |
|
|
T3 T2 |
lgkT ; |
||||||
|
|
|
2,303R |
T T |
|||||||||||
|
|
|
|
|
3 |
|
|
2 |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
2 |
|
lgk |
|
197400 |
|
|
781 770 |
lg0,06857 |
|
1,0247; |
||||||
|
|
|
||||||||||||
2,303*8,314 781*770 |
||||||||||||||
T3 |
|
|
|
|
||||||||||
lgkT3 |
|
Еакт |
|
T3 |
T2 |
lgkT2 ; |
kT 0,1059. |
|||||||
|
|
|
||||||||||||
|
|
|
2,303R T3T2 |
3 |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
58

Глава 5. РАСТВОРЫ
5.1. Образование растворов
Раствором называется однородная смесь, состоящая из двух или большего числа веществ, состав которой в некоторых пределах может непрерывно изменяться без скачкообразных изменений свойств.
Раствор может иметь любое агрегатное состояние – твердое, жидкое, газообразное.
Жидкие растворы делят на две группы: растворы неэлектролитов и растворы электролитов.
Предельную концентрацию насыщенного раствора называют растворимостью.
Смеси, в процессе образования которых отсутствуют тепловые и объемные эффекты, т.е. Нр=0 и ΔVр=0, называются идеальными растворами.
По некоторым свойствам к идеальным растворам близки так называемые бесконечно разбавленные рестворы.
Реальные растворы. Образование реальных растворов сопроваждается тепловыми и объемными эффектами ( Нр≠0,ΔVр≠0). Эти эффекты могут быть значительными; например, при растворении спирта в воде происходит заметное увеличение температуры и уменьшение объема на 3,5%.
5.2. Концентрация растворов
Концентрация – величина, показывающая относительное содержание данного компонента в растворе. В химии чаще всего в расчетах используют концентрации растворов:
1)в массовых долях, т. е. в долях растворенного вещества (г, кг) в 100 г (или 100 кг) раствора (выражают в долях единицы или процентах);
2)числом грамм-эквивалентов растворенного вещества в 1 л <1 дм3)
раствора (нормальность);
 3) числом молей растворенного вещества в 1 л (1 дм3) раствора
3) числом молей растворенного вещества в 1 л (1 дм3) раствора
{молярность);
4)числом молей растворенного вещества в 1 кг (1000 г) растворителя (моляльность);
5)в молярных долях.
Молярная доля показывает, какую часть от общего числа молей раствора составляет растворенное вещество (или растворитель); Если обозначить число молей растворителя через па, а число молей растворенного вещества через nb, то молярная доля растворенного вещества равна
Nb nb / na nb , |
(5.1) |
а молярная доля растворителя
Примечание [ПИ5]: прове-
рить
59
