
Физика_лек_pdf / Модуль 10. Квантовая физика
.pdf2-й постулат Бора: электрон на каждой орбите обладает определенной энергией. Такие орбиты называются стационарными. Движение электронов по стационарным орбитам не сопровождается излучением или поглощением энергии атомом;
3-й постулат Бора: переход электрона с одной стационарной орбиты на другую сопровождается излучением или поглощением атомом кванта энергии. Квант энергии, на основании закона сохранения энергии, равен разности энергий стационарных состояний атома до и после излучения
h ν = E в – Е н , Дж
где E в и Е н — энергия электрона соответственно на верхней и нижней стационарных орбитах, Дж. Очевидно, что частота излучаемых или поглощаемых атомом электромагнитных волн зависит не от частоты вращения электрона в атоме, а от разности энергий разрешенных состояний атома
ν = (E в – Е н )/h , Гц.
Постулаты Н. Бора излагаются также общей формулировкой: атом устойчив только в стационарных состояниях, соответствующих дискретным разрешенным значениям энергии E 1 , Е 2 , Е 3 , ... Переход атома из одного устойчивого энергетического состояния в другое сопровождается излучением или поглощением кванта энергии, определяемого условием частот.
Атом водорода. Дискретность энергетических состояний. Энергетический спектр атомов и молекул
Орбиты или оболочки, которые занимает электрон в атоме, обозначают прописными буквами латинского алфавита, начиная от К , затем L , М , N и т. д. Поэтому электрон, расположенный на ближайшей к ядру оболочке, называют К -электроном. Кроме этого, оболочки нумеруют числами 1, 2, 3... Эти числа, как известно, называют главными квантовыми и обозначают символом n .
В обычном, нормальном — стационарном энергетическом состоянии электрон в атоме водорода находится на первой, ближайшей к ядру, оболочке. Энергия электрона в данном состоянии — Е 1 . Низший энергетический уровень Е 1 соответствует основному состоянию атома водорода. Для перевода электрона на L -оболочку ему необходимо сообщить квант энергии. На второй оболочке электрон будет иметь энергию Е 2 = Е 1 + h ν , Дж. Все состояния атома водорода, в которых электрон находится не на ближайшей к ядру К -орбите, с энергией Е 2 и больше называют возбужденными состояниями. Если связать это понятие с главными квантовыми числами орбит, то возбужденными называют состояния водорода с главным квантовым числом, превышающим единицу. При комнатной температуре почти все атомы водорода находятся в основном состоянии. При более высоких температурах или при электрическом разряде в среде водорода, где происходит множество столкновений между свободными электронами и атомами, многие электроны переходят в возбужденные состояния.
Радиусы атома водорода в различных возбужденных состояниях согласно формуле (23.1) пропорциональны квадрату главного квантового числа. Определим численные значения радиусов электронных орбит в атоме водорода. Для этого проделаем следующие рассуждения.

Момент импульса электрона относительно центра ядра атома равен т e vrn (рис. 23.1). Момент импульса электрона — дискретная характеристика. Ее величина устанавливается условием квантования Н. Бора
т e vrn = n , n = 1, 2, 3, …, = h /(2π ), Дж · с/рад. (23.2)
Здесь rn — радиус п-й разрешенной орбиты, м.
Рис. 23.1
На электрон действует сила притяжения со стороны положительно заряженного ядра, равная с позиций закона Кулона
Для атома водорода z = 1 и F = е 2 /(4πε0 rn 2 ).
Кулоновская сила F , действующая на электрон, сообщает ему центростремительное ускорение ац = v 2 /rn . He вызывает сомнения, что рассматриваемая сила может быть представлена и через второй закон И. Ньютона:
F = т e а ц = те v 2 /rn .
Из изложенного вытекает равенство
те v 2 /rn = е 2 /(4πε0 rn 2 ).
Подставив в него значение скорости электрона на п-й орбите из формулы (23.2) v = nh / (2π те rn ), получим
Откуда
Это соотношение позволяет рассчитать любой из радиусов разрешенных орбит в боровской модели атома водорода.

Ближайшей к ядру орбите соответствует главное квантовое число п = 1, и наименьший радиус первой орбиты равен:
Из (23.3) следует, что r п = п 2 · r 1 и тогда
r 2 = 4·r 1 = 4· 0,529·10–10 ≈ 2,12·10–10 м; r 3 = 9·r 1 = 9· 0,529·10–10 = 4,76·10–10 м;
Рассмотрим теперь расчет энергии Еп электрона на любой из разрешенных орбит. Полная энергия электрона равна сумме кинетической и потенциальной составляющих Е n = Е к + Е p . Так как Ек = mv 2 /2, а потенциальная энергия притяжения электрона к ядру равна произведению потенциала электрического поля ядра θ = е /(4πε0 r п ) на заряд электрона q = –е , то есть Ep = – е 2 /(4πε0 r п ), то
Знак «минус» присутствует в этой формуле потому, что за ноль потенциальной энергии принята энергия такого состояния атома, когда электрон удален от ядра на бесконечное расстояние, то есть атом ионизирован. Преобразуем выражение для скорости с использованием (23.3)
Подставим (23.5) и (23.3) в (23.4)
Вычислим величину энергии электрона на самой низкой орбите в атоме водорода
С учетом полученного значения Е 1 формулу (23.6) можно переписать в виде
Еп = –13,55/п 2 , эВ.
И тогда E 2 = –3,38 , а E 3 = –1,51 эВ и т.д. Отрицательность энергии электрона в атоме объясняется выбором нуля при отсчете его потенциальной энергии. Потенциальную
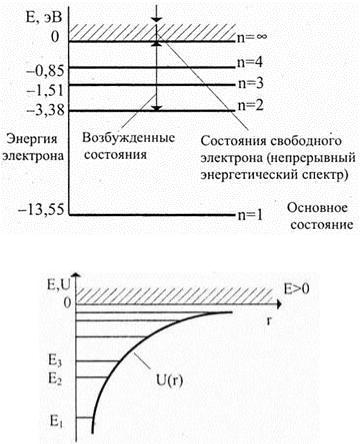
энергию электрона принято считать равной нулю на орбите с главным квантовым числом n = ∞ (Е = 0). И поэтому оказывается, что при 1 ≤ п < ∞ Е p < 0 и En < 0. Такое принятие знака для Еп оказалось удобным тем, что с увеличением главного квантового числа энергия атома водорода возрастает (уменьшается ее отрицательная величина), а энергетические уровни сближаются к границе, соответствующей значению п = ∞. Атом водорода обладает минимальной энергией Е 1 = –13,55 эВ при п = 1 и максимальной E ∞ = 0 при п = ∞, когда электрон покидает атом и становится свободным. Иными словами, значение E ∞ = 0 соответствует положительно ионизованному атому водорода. Энергию, необходимую для ионизации атома химического элемента, называют энергией ионизации. Выше уровня E ∞ = 0 свободный электрон имеет положительные значения энергии в виде непрерывного энергетического спектра. Он изображен на рис. 23.2 заштрихованной областью и соответствует ионизованному атому. Конкретное же значение энергии свободного электрона зависит от электрон-электронных и электрон-фононных взаимодействий в фиксированный момент времени.
Рис. 23.2
Рис. 23.3
Набор дискретных отрицательных значений энергии изображают на схеме энергетических уровней горизонтальными линиями (рис. 23.3). Этот рисунок может быть дополнен потенциальной компонентой U (r ) от полной энергии электрона в атоме, где r
— расстояние между электроном и ядром. Функция U (r ) графически изображена кривой, неограниченно убывающей при уменьшении r , то есть при приближении электрона к ядру и наоборот. Еще раз обратим внимание на то, что величины rn , v и Е n квантуются, то есть они могут принимать только дискретные разрешенные значения. Электрон не может долго находиться в возбужденном состоянии. Он стремится вернуться в свое основное состояние, соответствующее минимальному значению энергии атома. При возвращении на прежнюю орбиту электрон испускает тот же квант энергии — фотон в виде электромагнитного излучения. Подобные переходы в атоме могут происходить и между
другими орбитами. Получается серия частот — линейчатый спектр излучения или поглощения. Атом любого из химических элементов имеет свой, строго определенный спектр частот. Чем сложнее атом химического элемента, тем сложнее его спектр. Этими переходами и обусловлены спектры испускания газов.
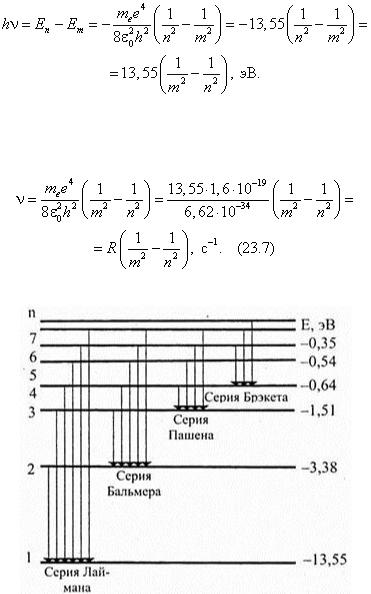
Согласно второму постулату Н. Бора, при переходе атома водорода из стационарного энергетического состояния с большей энергией Еп = – 13,55/п 2 и главным квантовым числом п в стационарное энергетическое состояние с меньшей энергией Ет = – 13,55/m и главным квантовым числом орбиты m испускается квант энергии (23.6):
Знание значений энергии Еп и Ет позволяет рассчитать частоту (длину волны) излучения атома в данном случае, при переходе электрона с орбиты п на орбиту т :
где R = me 4 /(8ε 0 2 h 3 ) = 3,29 · 1015 с–1 — постоянная И. Ридберга.
Рис. 23.4
Формулу (23.7) называют обобщенной формулой И. Бальмера. С помощью этой формулы было дано объяснение ранее открытым эмпирическим спектральным линиям серии Т. Лаймана (ультрафиолетовая часть спектра), которые соответствуют излучению водорода при переходе электрона со 2-й, 3-й, 4-й и других более удаленных орбит на первую (т = 1, п = 2, 3, 4,...); линиям серии И. Бальмера (видимый свет), которые соответствуют излучению при переходе электрона с 3-й, 4-й, 5-й и других более удаленных орбит на вторую (т = 2, п = 3, 4, 5,...); линиям серии Пашена (инфракрасная часть спектра), которые соответствуют излучению при переходе электрона с 4-й, 5-й, 6-н и
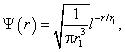
других более удаленных орбит на третью (т = 3, п = 4, 5, 6,...), а также спектральным линиям последующих серий; Брэкета (т = 4, п = 5, 6, 7,...), Пфунда (т = 5, п = 6, 7, 8,...),
Хемфри (т = 6, п = 7, 8, 9,...).
Так как водород состоит из множества различно возбужденных атомов, то в нем совершаются одновременно все возможные типы переходов электрона. Поэтому в спектре излучения водорода (рис. 23.4) представлены линии всех серий.
Понятие о квантовой теории многоэлектронного атома. Принцип Паули. Квантовые числа
Квантовая теория атома в своих построениях использует достижения теории Н. Бора. И, прежде всего, постулаты о том, что, во-первых, электрон может находиться в атоме только в дискретных состояниях, а следовательно, и энергия электрона дискретна. Вовторых, при переходе электрона из одного состояния в другое излучается или поглощается фотон. Квантовая механика расширяет боровские представления об атоме следующим. В атоме не существует определенных орбит электронов. Это значит, что в силу волновой природы движения электрона он не локализован, а как бы распределен — «размазан» в объеме атома и подобен облаку отрицательного заряда переменной плотности. А размеры и форму электронного облака в заданном состоянии атома можно вычислить. Кстати, все это и в том числе то, что постулируется в атомной модели Н. Бора, в квантовой теории является следствием самой теории, так как вытекает непосредственно из решения уравнения Э. Шредингера. Так, например, для основного состояния атома водорода решение уравнения Э. Шредингера дает пси-функцию в виде
где r — расстояние от центра ядра атома до интересующей точки пространства; r 1 — средний радиус электронного облака; Ψ(r ) — волновая функция, может быть интерпретирована в данном случае как функция положения электрона. Волновая функция отрицает возможность установления точного положения электрона в объеме атома. Квадрат модуля волновой функции определяет вероятность нахождения электрона в том или ином месте объема атома. Вероятность обнаружения электрона в различных точках атома различна. В свете изложенного очевидна причина (волновые свойства электрона) отказа квантовой механики от классического представления об электронных орбитах. При r = r 1 функция Ψ(r ) достигает максимума.
Квантовая механика, как и теория Н. Бора, устанавливает для атома водорода тот же набор дискретных значений энергии, определяемый функцией Еп = – 13,55/n 2 , эВ, п = 1, 2, 3... Однако теория Н. Бора предполагала достаточным знание только одного главного квантового числа п . В квантовой же механике задание состояния атома возможно через знание четырех различных квантовых чисел.
1.Главное квантовое число п = ∞ определяет полную энергию состояния атома водорода. Главное квантовое число в многоэлектронном атоме характеризует размер электронного облака.
2.Орбитальное квантовое число l . При заданном п орбитальное квантовое число принимает целочисленные значения от 0 до п – 1:
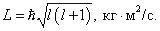
если п = 1, то l = 0;
если п = 2, то l = 0, 1;
если п = 3, то l = 0, 1, 2 и т. д.
Можно считать, что полная энергия электрона в атоме водорода зависит только от п и не зависит от l . Но в многоэлектронном атоме на величину его энергии оказывает влияние главное и орбитальное квантовые числа.
Из квантовой механики следует, что механический орбитальный момент — момент импульса электрона L относительно ядра не может быть произвольным, а принимает
дискретные значения, так как квантуется кратно = h /(2π), Дж·с/рад. Величина момента импульса связана с орбитальным, квантовым числом соотношением
Таким образом, орбитальное квантовое число, кроме вышеизложенного, позволяет определить еще и момент импульса электрона в атоме. По величине l можно также судить
ио форме электронного облака.
3.Магнитное квантовое число т l . При заданном l магнитное квантовое число может принимать целочисленные значения от – l до +l . Например, если l = 2, то т может быть равно –2, – 1, 0, 1, 2. Магнитное квантовое число характеризует ориентацию электронного облака в пространстве.
Из квантовой механики следует, что вектор L момента импульса электрона имеет такие ориентации в пространстве, при которых его проекция Lz на направление z внешнего магнитного поля принимает квантованные по величине и направлению значения, кратные
,
Lz = ml , кг·м2 /с.
Теперь понятно, что магнитное квантовое число определяет проекцию момента импульса L г электрона на заданное направление z , а вектор момента импульса L электрона в атоме может иметь в пространстве (2l + 1) ориентации, то есть от – l до + l . На рис. 23.5 показаны возможные значения L г электрона, находящегося в состоянии с n = 2 и l = 1 и в состоянии с п = 3 и l = 2. В состоянии с п = 1 величины L и L г имеют только нулевое значение.

Рис. 23.5
Дополним понятие магнитного квантового числа следующими рассуждениями. Электрон при своем вращении вокруг ядра создает электрический ток, в результате чего образуется магнитное поле, величина которого характеризуется магнитным моментом. Если атом поместить во внешнее магнитное поле, то направление магнитного момента орбитального тока может оказаться под некоторым углом к этому полю. Как уже отмечалось, проекция орбитального момента на направление внешнего магнитного поля тоже квантуется.
Название магнитного квантового числа т заимствовано из эксперимента: было установлено, что при газовом разряде в магнитном поле энергетический уровень с главным квантовым числом п расщепляется на (2l + 1) подуровней, расположенных близко Друг к другу. Расщепление энергетических уровней в магнитном поле обнаружено голландским физиком П. Зееманом в 1896 г. и называется эффектом Зеемана. Расщепление уровней энергии имеет место и во внешнем электрическом поле — эффект И. Штарка. Таким образом, энергетические уровни в атоме при наличии внешнего энергетического поля расщепляются (рис. 23.6), и, следовательно, энергия атома, находящегося в магнитном поле, зависит не только от п , l , но и от т l . Однако энергетические уровни в атоме слабо зависят от l и т l . Эти квантовые числа основное влияние оказывают на функцию распределения вероятностей электрона в объеме атома. Определенный интерес представляют вертикальные спектральные линии (рис. 23.6).

Рис. 23.6
4. Спиновое квантовое число т s . Тщательные исследования спектральных линий водорода показали, что в действительности каждая линия состоит из двух близких линий. Это явление получило название тонкой структуры. Это число может принимать только
два значения: 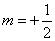 и
и 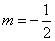 . Из теории Э. Шредингера не следовало существование этих квантовых чисел. Их ввел П. Дирак. И это он показал, что спиновое квантовое число
. Из теории Э. Шредингера не следовало существование этих квантовых чисел. Их ввел П. Дирак. И это он показал, что спиновое квантовое число
— результат релятивистских процессов в атоме. Полагают, что спин не связан с движением электрона в пространстве и вращением электрона вокруг своей оси. Спин электрона, подобно заряду и массе, является его неотъемлемым свойством. Наглядное представление, о спине возникает в том случае, если спин отождествить с вращением электрона вокруг собственной оси. Подобная модель спина дает полную аналогию в строениях атома и Солнечной системы. Но, как зачастую бывает, появляется нежелательное «но». И связано оно с тем, что такое представление о спине противоречит специальной теории относительности. Противоречие выражается в том, что скорости, с которыми должны вращаться точки на оси вращения электрона, превышают скорость света в вакууме. И поэтому спином электрона называют собственный момент импульса, обусловленный его квантовой природой.
Рассмотренные квантовые числа представим для наглядности в таблице 23.1.
Таблица 23.1
Квантовые числа электрона
Рассмотрим значения квантовых чисел атомов гелия и лития, находящихся в
основном состоянии. |
|
|
|
|
Квантовые числа: |
n |
l |
ml |
ms |
1. Атом гелия |
1 |
0 |
0 |
|
(z = 2 ) |
1 |
0 |
0 |
|
2. Атом лития |
1 |
0 |
0 |
|

(z = 3 ) |
1 |
0 |
0 |
|
2 |
0 |
0 |
Об электронах, занимающих в атоме совокупность состояний с одинаковыми значениями главного квантового числа п , говорят, что они принадлежат одной электронной оболочке: n = 1 К-оболочке; при п = 2 L -оболочке и т.д.
В каждой электронной оболочке атома электроны распределяются по подоболочкам. Подоболочка соответствует определенному значению орбитального квантового числа l . Электроны с одинаковым значением l принадлежат одной подоболочке и наоборот. Для обозначения орбитального квантового числа l зачастую вместо цифр используют строчные буквы латинского алфавита, обозначающие подоболочку:
0 1 2 3 4 и т.д. s p d f g и т.д.
Используя буквенные обозначения, хотят подчеркнуть отдельные особенности спектральных линий: s — sharp (резкая); р — principle (главная); d — diffuse (размытая).
Состояние электрона, характеризуемое орбитальными квантовыми числами: l = 0, называют s -состоянием или s -подоболочкой (электрон в этом состоянии называют s - электроном); l = 1 — р -состоянием или р -подоболочкой; l = 2 — d -состоянием или d - подоболочкой; l = 3 — f -состоянием или f -подоболочкой и т. д.
В нижеследующей табл. 23.2 приведено максимальное количество электронов в разных электронных подоболочках и оболочках.
Таблица 23.2
Максимальное число электронов в подоболочках и оболочках
Рассмотрим подробнее систему обозначения состояний электрона, принятую в атомной физике. У невозбужденного атома электроны заполняют ближайшие к ядру оболочки и подоболочки, что соответствует минимальной энергии атома. Состояние атома с указанием фактического распределения электронов называют электронной конфигурацией атома. Электронную конфигурацию атома принято записывать символически с помощью трех знаков: номера оболочки, буквы, обозначающей подоболочку, верхнего числового индекса при букве, указывающего число электронов в
