
терапия єкз
.pdfГеморагічний діатез може виникати як самостійне захворювання, а також розвиватися при інших захворюваннях. У цьому випадку говорять про вторинному геморагічному діатезі.
Також розрізняють:
-вроджений або спадковий геморагічний діатез. Проявляються спадкові геморагічні діатези у дітей і супроводжують людину протягом всього життя. Характерні для таких захворювань як геморагічна телеангіектазії, різні гемофілії, хвороба Гланцмана, тромбоцитопатії у дітей і т.д.
-набутий геморагічний діатез у дітей та дорослих є проявом захворювань, пов'язаних зі згортанням крові та станом судинної стінки.
До них відносяться геморагічна пурпура, спадкова і дезагрегаціонние тромбоцитопатії, геморагічний васкуліт, ураження судин при хворобах печінки, отруєннях ліками, інфекціях.
Типи кровоточивості при геморагічних діатезах Виділяють п'ять типів кровоточивості.
· Гематомний тип кровоточивості – зазвичай спостерігається при гемофілії, при цьому відзначається наявність великих гематом, крововиливів у суглоби, кровоточивість після операцій.
· Капілярний тип кровоточивості – характерний для тромбоцитопенії, спадкової та дезагрегаціонной тромбоцитопатії. При такому типі кровоточивості відзначаються дрібні крововиливи у вигляді петехій або екхімози, в також кровотечі з носа, ясен, маткові і шлункові кровотечі.
· Змішаний тип – характеризується наявністю гематом і дрібних плямистих висипань на шкірі. Спостерігається при прийомі великої кількості антикоагулянтів і тромбогеморрагіческого синдрому.
· Пурпурний тип – характеризується дрібними симетричними висипаннями на нижніх кінцівках. Такий тип кровоточивості проявляється при геморагічних васкулітах.
· Мікроангіоматозний тип кровоточивості – характеризується повторюваними кровотечами. Виникає при спадкових порушеннях розвитку дрібних судин.
Фізіологічна система, яка забезпечує підтримку крові в рідкому стані і попереджає крововтрати, - називається системою гемостазу.
Гемостаз забезпечується трьома функціонально-структурними компонентами: 1. Стінка кровоносних судин.
2. Клітини крові, в основному, тромбоцити.
3. Ферментні та неферментний системи плазми.
До факторів, що підтримує кров у рідкому стані, відносяться наступні: 1) внутрішні стінки судин і формені елементи крові заряджені негативно; 2) ендотелій судин секретує простациклін ПГИ-2 - інгібітор агрегації тромбоцитів, антитромбін III, активатори фібринолізу; 3) фактори згортання крові знаходяться в судинному руслі в неактивному стані; 4) наявність антикоагулянтів; 5) велика швидкість кровотоку.
Згортання крові (гемокоагуляція) - це життєво важлива захисна реакція, спрямована на збереження крові в судинній системі і запобігає загибель організму від крововтрати при травмі судин.
Основні положення ферментативної теорії згортання крові були розроблені А. Шмідтом більше 100 років тому.
В зупинці кровотечі беруть участь: судини, тканина, що оточує судини, фізіологічно активні речовини плазми, формені елементи крові, головна роль належить тромбоцитам. І всім цим керує нейрогуморальний регуляторний

Білет №23
1.Хронічні гепатити. Основні клінічні синдроми.
Хронічний гепатит (ХГ) – поліетіологічний дифузний запальний процес в печінці, тривалістю без покращення більше шість місяців, що проявляється дистрофією і некрозом гепатоцитів, міждольковою і внутрішньодольковою гістіолімфоплазмоцитарною інфільтрацією, гіпертрофією зірчатих ретикулоендотеліоцитів, помірним фіброзом при збереженні архітектоніки печінки.
Клініка.
Основні клінічні синдроми:
-астено-вегетативний ( загальна слабкість, швидка втома, зниження працездатності, нервозність, порушення сну)
-диспептичний ( погіршення апетиту, відчуття гіркоти та сухості у роті, нудота, важкість у правому підребер'ї, здуття живота, розлади випорожнень);
-больовий (тупий, ниючий біль у правому підребер'ї);
-гепатомегалічний, спленомегалічний;
-жовтяничний (жовтушність шкіри і слизових оболонок)
-холестатичний (жовтяниця, шкірний свербіж, ксантоми, ксантелазми);
-спленомегалічний (збільшення селезінки);
-геморагічний (васкуліти, геморагії на шкірі, кровоточивість ясен, носові кровотечі);
-позапечінкові ознаки (судинні зірочки, пальмарна еритема, артралгії, лімфаденопатії тощо).
2. Пневмонії. Діагностичні критерії госпітальної пневмонії. Лікування та прогноз при внутишньолікарняних пневмоніях.
Пневмонія – поліетіологічне вогнищеве інфекційно-запальне захворювання легень із залученням до патологічного процесу респіраторних відділів легень і обовязковим розвитком внутрішньоальвеолярної запальної ексудації.
Нозокоміальна (госпітальна) - пневмонія, що виникла через 48 год і пізніше після госпіталізації хворого до стаціонару за відсутності будь-якого інфекційного захворювання в інкубаційний період на час госпіталізації хворого.
ДІАГНОСТИКА ГОСПІТАЛЬНОЇ ПНЕВМОНІЇ
Для діагностики госпітальної пневмонії запропонована бальна система CPIS (clinical pulmonary infection and score)
КЛІНІЧНА ШКАЛА ЛЕГЕНЕВОЇ ІНФЕКЦІЇ CPIS.
Параметр |
Шифр |
Значення |
Бали |
|
параметру |
||||
|
|
|
||
Температура |
|
36,5-38,4 |
0 |
|
а |
38,5-39 |
1 |
||
тіла, 0С |
||||
|
|
<36,0 або >39,0 |
2 |
|
Лейкоцитоз, |
|
4-11 |
0 |
|
б |
11-17 |
1 |
||
109/л |
||||
|
|
>17 |
2 |
|
|
|
+ |
0 |
|
Секреція |
в |
+ |
1 |
|
|
|
++ |
2 |
|
PaO2/FiO2, kPa |
|
>33 |
0 |
|
г |
<33 |
2 |
||
|
||||
Рентгенологічні |
|
немає |
0 |
|
д |
плямисті |
1 |
||
інфільтрати |
||||
|
локалізовані |
2 |
||
|
|
Клінічну шкалу оцінюють щодня. Пневмонія може бути ретроспективно підтверджена, якщо CPIS >8 і наявна одна з ознак (б-г), чи CPIS >6 і наявні дві ознаки з (б-г). Пневмонію не діагностують за відсутності інфільтратів на рентгенограмі.
ДІАГНОСТИЧНИЙ СКРИНІНГ ОБСТЕЖЕННЯ ХВОРОГО З ПІДОЗРОЮ НА ГОСПІТАЛЬНУ ПНЕВМОНІЮ
(С.В.Яковлєв, 2004)
Діагностичні методи |
Показники |
Рентгенологічне |
Рентгенографія легень в двох |
обстеження |
проекціях |
|
Забарвлення по Граму та |
|
Мікробіологічне |
мікроскопія, культуральне |
|
дослідження мокротиння |
дослідження з кількісною |
|
|
оцінкою виділеного збудника |
|
Гемокультура |
Забір крові з периферичної вени в |
|
два флакони (аероби + анаероби) |
||
|
||
|
Гемоглобін, гематокрит, |
|
Клінічний аналіз крові |
лейкоцити, формула крові, |
|
|
тромбоцити |
|
Біохімічний аналіз крові |
Сечовина, креатинін, електроліти |
|
Кислотно-лужний стан |
рН, РО2, РСО2 |
Критерієм класифікації ГП є термін розвитку захворювання, наявність чи відсутність факторів ризику її розвитку. За цією класифікацією виділяють такі види ГП:
-рання ГП - виникає протягом перших 5 днів з моменту госпіталізації і зумовлена збудниками, які були у хворого ще до надходження до стаціонару, - S. pneumoniae, H. influenzae, метициліночутливий S. aureus (далі
-MSSA) та інші представники нормальної мікрофлори порожнини ротоглотки. Найчастіше ці збудники чутливі до антимікробних препаратів, що традиційно використовуються, а пневмонія має більш сприятливий прогноз;
-пізня ГП - розвивається не раніше 6 дня госпіталізації і спричинена власне госпітальною мікрофлорою з більш високим ризиком наявності високовірулентних і полірезистентних збудників, таких як P. aeruginosa, Acinetobacter spp., представники родини Enterobacteriaceae, метицилінорезистентний S. aureus (далі - MRSA). Така ГП характеризується менш сприятливим прогнозом.
З огляду на тяжкість перебігу захворювання, серйозність прогнозу й особливості ведення реанімаційних хворих виділяють в особливу форму так звану вентилятор-асоційовану пневмонію (далі - ВАП) - пневмонія, яка виникла через 48 год. від початку проведення ШВЛ за відсутності ознак легеневої інфекції на момент інтубації.
Незважаючи на відомі обмеження, клінічне обстеження залишається "відправною точкою" діагностики ГП, а дані інших методів (у тому числі й інвазивних) лише інтерпретують з урахуванням клінічної картини ГП. Для ГП характерна поява нових інфільтративних змін на рентгенограмі органів грудної клітки в поєднанні з такими ознаками інфекційного захворювання, як лихоманка, виділення гнійного мокротиння та/або лейкоцитоз. В зв'язку з цим до числа формалізованихдіагностичних критеріїв ГП відносять:
-появу на рентгенограмі нових вогнищево-інфільтративних змін у легенях
-дві з приведених нижче ознак:
1)температура тіла вище > 38,3° C;
2)бронхіальна гіперсекреція;
3)PaO2/FiO2 (FiO2 - фракція кисню у повітрі, що видихається, %) менше 240;
4)кашель, тахіпное, локальна крепітація, вологі хрипи, бронхіальне дихання;
5)кількість лейкоцитів у крові менше 4,0 х 109/л чи більше 12,0 х 109/л, палочкоядерний зсув більше 10 %;
6)гнійне мокротиння / бронхіальний секрет (більше 25 поліморфноядерних лейкоцитів в полі зору при мікроскопії з малим збільшенням, х 100).
Діагноз ГП - безумовне показання для застосування антибіотиків, які є основою лікування у таких хворих. Антибактеріальне лікування необхідно починати одразу після встановлення діагнозу. Абсолютно неприйнятне є зволікання з терміновим призначенням антибіотиків пацієнтам із тяжким перебігом захворювання через відсутність результатів бактеріоскопії і засіву мокротиння, оскільки затримка введення першої дози антибіотика на 4 год. зумовлює значне підвищення ризику смерті таких хворих.
Найважливішим фактором підвищення виживання хворих на ГП є своєчасне призначення адекватної антибіотикотерапії.
Найбільш виправданим підходом до емпіричної антибіотикотерапії хворих на ГП є лікування в залежності від термінів виникнення пневмонії ("рання", "пізня") та наявності модифікуючих факторів ризику інфікування полірезистентними штамами мікроорганізмів. У хворих на на "ранню" ГП без факторів ризику наявності полірезистентних штамів збудників найбільш ймовірними збудниками захворювання можуть бути S. pneumoniae, H. influenzae, S. aureus (MSSA), грамнегативні бактерії кишкової групи зі звичайною чутливістю до антибіотиків: E. coli, K. pneumoniae, Enterobacter spp. Proteus spp., S. marcescens. Для лікування цих хворих використовують: цефтріаксон або фторхінолон III - IV покоління, або ампіцилін/сульбактам, або меропенем. У хворих на "ранню" ГП з факторами ризику наявності полірезистентних штамів збудників та "пізню" ГП найбільш ймовірними збудниками захворювання можуть бути грамнегативні бактерії (P. aeruginosa, K. pneumoniae (продуценти ESBL) Acinetobacter spp. L. pneumophila) або грампозитивні коки резистентні до метициллину -S. aureus (MRSA). Для лікування цих хворих використовують: цефалоспорин з

антисиньогнійною активністю (цефепім, цефтазидим) або карбапенем (іміпенем, меропенем), або захищений b-лактам (піперацилін/тазобактам) у поєднанні з фторхінолоном із антисиньогнійною активністю або аміноглікозидом (амікацин, гентаміцин, тобраміцин), а також із лінезолідом або ванкоміцином (за наявності факторів ризику MRSA чи високої частоти нозокоміальних інфекцій у даному стаціонарі).
Традиційна тривалість антибіотикотерапії хворих на ГП складає, як правило, 14 - 21 день. Збільшення її тривалості може призвести до суперінфекції полірезистентними госпітальними збудниками, зокрема P. aeruginosa і мікроорганізмами родини Enterobacteriaceae. При ВАП значне клінічне поліпшення спостерігається вже протягом перших 6 днів терапії, а збільшення її тривалості до 14 днів призводить до колонізації P. aeruginosa і мікроорганізмами родиниEnterobacteriaceae.
При нозокоміальних пневмоніях прогноз серйозний, при важкому токсичному перебігу їх, особливо в реанімаційних відділеннях, летальність сягає 40-50%
3.Анемії. Лабораторна діагностика, діагностичні критерії залізодефіцитної анемії.
Анемія – це гематологічний синдром чи самостійне захворювання, для якого характерно зменшення кількості еритроцитів та/чи вмісту гемоглобіну в одиниці об‘єму крові, що призводить до розвитку гіпоксії тканин.
Залізодефіцитна анемія зумовлена дефіцитом заліза у сироватці крові, кістковому мозку і депо, внаслідок чого порушується утворення гемоглобіну, а потім і еритроцитів.
Лабораторна діагностика ЗДА Діагностика ЗДА заснована на аналізі даних клінічних і лабораторних досліджень. 1. Периферична кров.
Загальний аналіз крові з визначенням кількості тромбоцитів та ретикулоцитів, а також визначення:
-середнього об‘єму еритроциту — MCV (mean corpuscular volume –N 75-95мкм3),
-середнього вмісту гемоглобіну в еритроцитах —MCH (mean corpuscular hemoglobin- N 24-33 пг),
-середньої концентрації гемоглобіну в еритроцитах — MCHC (mean corpuscular hemoglobin concentration - N 30-38 %),
-гістограми об‘єму еритроцитів, що оцінює ступінь анізоцитозу — RDW (red cell distribution width).
2. Біохімічні дослідження.
Визначення заліза у сироватці крові, загальної залізозв‘язувальної здатності сироватки крові, насичення залізом трансферину, вміст трансферину, феритину у сироватці крові, десфераловий тест.
3. Кістковий мозок.
Обчислення показників мієлограми, визначення кістковомозкових індексів, кількості сидеробластів. 4. Дослідження вільного протопорфірину в еритроцитах.
На початку захворювання кількість еритроцитів не зменшується, але вони зменшені за розмірами (мікроцити) і недостатньо насичені гемоглобіном (гіпохромія). Рівень зменшення гемоглобіну випереджає зменшення еритроцитів. Спостерігається низький кольоровий показник (0,7-0,5) і зменшення MCHС. У мазках крові переважають невеликі гіпохромні еритроцити, анулоцити (еритроцити з відсутнім гемоглобіном у центрі у вигляді кілець), неоднакового розміру та форми (анізоцитоз, пойкілоцитоз). При тяжкій анемії можуть з‘являтися еритробласти. Кількість ретикулоцитів не змінюється. Але якщо анемія викликана гострою кровотечею, безпосередньо після неї рівень ретикулоцитів підвищується, що є важливою ознакою кровотечі. Осмотична резистентність еритроцитів мало змінюється або дещо підвищена.
Кількість лейкоцитів має нерізко виражену тенденцію до зниження, але лейкоцитарна формула не змінюється. Рівень тромбоцитів не змінюється, лише при кровотечах дещо підвищується.
Рівень феритину сироватки крові визначений радіоімунним методом, зменшується вже на прелатентній стадії ЗДА. В нормі його вміст складає 85-130 мкг/л у чоловіків та 58-150 мкг/л у жінок.
Рівень заліза в сироватці крові здорових людей, який визначається за методом Henry, складає 0,7-1,7 мг/л, або 12,5-30,4 мкмоль/л, при ЗДА він зменшується до 1,8-5,4 мкмоль/л. Загальна залізозв‘язувальна здатність плазми крові (або загальний трансферин сироватки) збільшується (N- 1,7-4,7 мг/л, або 30,6 -84,6 мкмоль/л).
Близько третини (30-35 %) всього трансферину сироватки крові пов‘язано із залізом (показник насичення трансферина залізом). Решта трансферину вільна і характеризує приховану залізозв‘язувальну здатність сироватки крові. У хворих на ЗДА відсоток насичення трансферином зменшується до 10-20, при цьому збільшується прихована залізозв‘язувальна здатність плазми.
У кістковому мозку – еритробластична реакція із затримкою дозрівання і гемоглобінізації еритробластів на рівні поліхроматофільного нормоцита (кількість останніх збільшується). Кількість сидеробластів різко зменшується - <20% (в N 20-50%), сидероцити відсутні. Збільшується співвідношення клітин білого та червоного ростків (N-3:1), кількість останніх переважає. У більшості еритробластів з‘являються дегенеративні зміни у вигляді вакуолінизації цитоплазми, пікноза ядра, відсутність цитоплазми (голі ядра). Для лейкопоезу характерне деяке збільшення кількості незрілих гранулоцитів.
Хворим на ЗДА проводять десфераловий тест – визначають кількість заліза, яке виділяється із сечею після внутрішньовенного введення 500 мг десфералу (комплексон, продукт життєдіяльності актиноміцетів, який зв‘язує залізо). Цей тест дає можливість визначити депо заліза в організмі. У здорових осіб із сечею після введення десфералу виділяється 0,8-1,8 мг заліза за добу. У хворих на ЗДА цей показник зменшується до 0,4 мг і менший вже на прелатентній стадії дефіциту заліза. Якщо ж показник залишається нормальним за наявності клінічних ознак ЗДА, швидше за все причиною патологічного стану може бути інфекційний чи інший запальний процес в організмі. Збільшення кількості виділеного заліза з сечею за наявності анемії свідчить про наявність заліза в депо без його реутилізації (гемосидероз внутрішніх органів).
Для встановлення причин і факторів ЗДА необхідно провести додаткове обстеження : -дослідженні кислотності шлункового соку (рН-метрія); -дослідження калу на наявність паразитів; -дослідження калу на приховану кров;
-рентгенологічне та ендоскопічне (ФЕГДС, за необхідності – іригоскопія, ректороманоскопія, колоноскопія) дослідження травного тракту; -гінекологічне та урологічне обстеження хворих.
Критерії діагностики:
-наявність анемічного та сидеропенічного синдромів; -низький кольоровий показник (<0,85); -гіпохромія еритроцитів;
-мікроцитоз, пойкілоцитоз, анізоцитоз еритроцитів (у мазку периферичної крові); -зменшення середньої концентрації Hb в еритроциті;
-зменшення вмісту заліза в сироватці крові; -збільшення загальної залізозв‘язувальної здатності сироватки
-збільшення ненасиченої залізозв‘язувальної здатності сироватки крові -зменшення кількості сидеробластів в кістковому мозку.
Білет №24
1.Жовчнокам'яна хвороба, хронічний холецистит. Визначення. Етіологія, патогенез. Роль інструментальних методів в діагностиці.
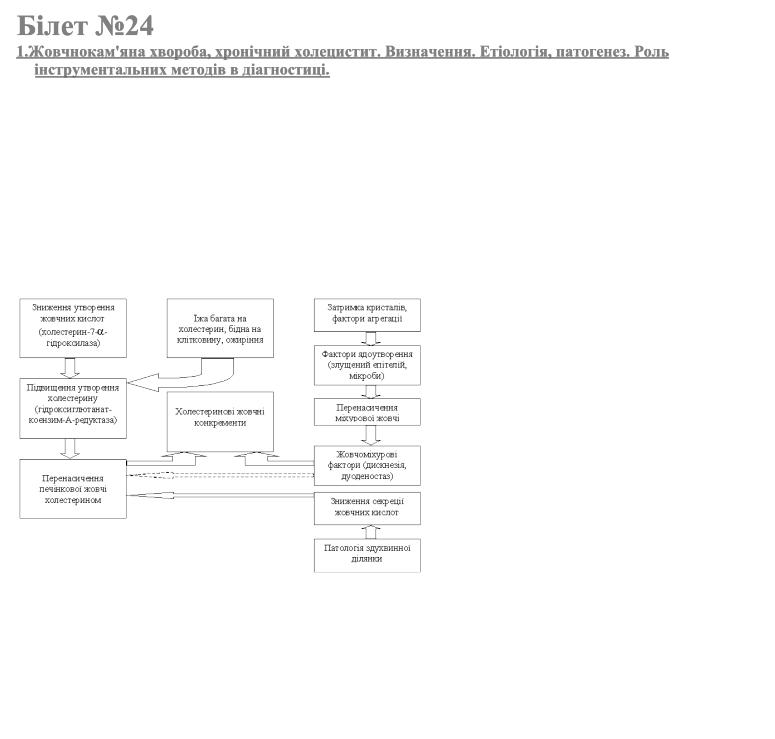
Жовчнокам‘яна хвороба (cholelithiasis) Хронічний калькульозний холецистит – полівалентне захворювання, при якому в результаті уродженого чи набутого порушення метаболізму холестерину і жовчних кислот в асоціації з порушеннями пасажу жовчі по жовчних шляхах і діяльністю інфекційних агентів утворюються жовчні конкременти (жовчні камінці). Клінічні прояви і прогноз у конкретних випадках залежать від стадії конкрементоутворення, первинної локалізації, шляхів міграції, тривалості існування конкрементів, характеру мікрофлори, індивідуальних особливостей організму пацієнта.
Етіологія і патогенез.
Розрізняють холестеринові, пігментні й змішані жовчні конкременти. Усі вони можуть бути кальцифікованими (рентгеноконтрастними) і некальцифікованими. За сучасними уявленнями, утворення жовчних конкрементів є результатом комплексної (сумарної) взаємодії ряду факторів, які можна умовно поділити на три основні групи: печінкові, жовчного міхура і кишкові.
Схема механізму утворення жовчних конкрементів
Печінкові фактори. Пусковими механізмами в послідовному і тривалому процесі жовчного літогенезу слід вважати порушення синтезу і виділення з жовчю печінковими клітинами холестерину, жовчних кислот, фосфоліпідів і некон‘югованого білірубіну. В нормі для утримання холестерину в розчинній формі на одну його молекулу необхідно 2 молекули лецитину (фосфоліпіду) і 6 молекул жовчних кислот. Інтенсивність синтезу холестерину визначається активністю печінкової гідрокси-глютанат-коензиму-А-редуктази, інтенсивність синтезу жовчних кислот залежить від активності ферменту холестерин-7-a -гідроксилази. Порушення кількісного співвідношення в жовчі холестерину, жовчних кислот і фосфоліпідів, як причина літогенезу, можливі в результаті уроджених чи набутих дефектів вищевказаних ферментів. Перші визначають схильність до успадкування жовчнокам‘яної хвороби, другі виникають внасдідок перенесених захворювань печінки різного генезу, неправильного харчування, різних метаболічних порушень (ожиріння, цукровий діабет), захворювань (чи резекції) термінальних відділів тонкої кишки.
Жовчоміхурові фактори. По-перше, порушення кількісного взаємовідношення між холестерином, фосфоліпідами і жовчними кислотами печінкового генезу може посилюватись підвищеною проникністю запаленої слизової оболонки жовчного міхура для жовчних кислот. По-друге, первинне чи вторинне (в тому числі й спровоковане вже наявними конкрементами) запалення слизової оболонки жовчного міхура супроводжується десквамацією епітелію, гіперсекрецією мукоїдних субстанцій, що, у свою чергу, сприяє утворенню центрів кристалізації. По-третє, наявність інфекції в жовчному міхурі (проникає висхідним шляхом із кишечника або гематогенно чи лімфогенно) спричиняє декон‘югацію жовчних кислот. Останні легко реабсорбуються шляхом пасивної дифузії слизовою оболонкою міхура, також приводячи до посилення літогенності. По-четверте, застій міхурової жовчі, що виникає в результаті порушення пасажу останньої через міхурові (набряк, рубцеві зміни) чи позапечінкові (дуоденостаз, вторинна гіпотонія жовчного міхура) протоки, теж інтенсифікує літогенез.
Кишкові фактори. Надмірні порушення абсорбції жовчних кислот (понад 20 %) у результаті різних захворювань тонкої кишки (ентериту, ентероколіту, термінального ілеїту Крона, резекції тонкої кишки) призводять до надмірних втрат жовчних кислот, що не можуть компенсуватись печінковими клітинами. Це теж спричиняє підвищення літогенності жовчі.
Окрім того, певне значення для виникнення умов, які сприяють утворенню холестеринових конкрементів, мають гіповітаміноз А, вагітність, тривале приймання гормональних контрацептивів, порушення
евакуаторної функції жовчного міхура нейрогенного чи ендокринного генезу тощо.
Холецистит (cholecystitis) - запалення жовчного міхура. Причиною запалення є проникнення інфекції (кишкова паличка: стрептококи, ентерококи, стафілококи, протей, синьогнійна паличка, змішана флора, лямблії) в його стінку при порушенні відтоку жовчі, зміні хімічних і фізичних властивостей жовчі, травмуванні стінки жовчного міхура кокрементами, аутолізі панкреатичними ферментами. Виникненню захворювання сприяють вагітність, пологи, звичні закрепи, вісцероптоз, що спричинюють застій жовчі. Проникнення інфекції можливе висхідним шляхом з кишківника, гематогенним і лімфогенним шляхами. Частіше холециститом хворіють жінки.
Хронічний холецистит (cholecystitis chronica) може перебігати без наявності каменів у жовчному міхурі (хронічний некалькульозний холецистит) або з їх наявністю (хронічний калькульозний холецистит). Хронічний некалькульозний (безкам‘яний) холецистит (сholecystitischronica) – хронічне поліетіологічне запальне захворювання жовчного міхура, яке поєднується з моторно-тонічними порушеннями (дискінезіями) жовчовивідних шляхів і змінами фізико-хімічних властивостей і біохімічного складу жовчі (дисхолією). Етіологія. Основними етіологічними факторами хронічного холециститу є наступні: бактерійна інфекція (кишкова паличка, ентерокок, стафілококи, стрептококи, рідко – протей, палички черевного тифу і паратифу, дріжджові грибки, віруси гепатиту В і С, а також змішана мікрофлора). Джерелами інфекції можуть бути захворювання носоглотки (хронічні тонзиліти, синусити), порожнини рота (стоматити, парадонтоз), системи сечовиділення (простатити, уретрити), гінекологічні захворювання, інфекційні захворювання кишечника, вірусні ураження печінки; паразитарна інвазія (лямбліоз, опісторхоз, аскаридоз); дуоденобіліарний рефлюкс; харчові і бактерійні алергени, перенесений гострий холецистит.
Сприяючі фактори: дискінезії жовчовивідних шляхів; психоемоційні стреси; порушення режиму харчування, зловживання жирною і смаженою їжею, гіподинамія, вагітність, що обумовлюють застій жовчі; дисбактеріоз кишечника, порушення обміну речовин, спадкова схильність.
Патогенез. Інфекція проникає в жовчний міхур трьома шляхами: гематогенним, висхідним (з кишечника), лімфогенним.
Мікробне запалення розвивається тоді, коли інфікування жовчі проходить на фоні її застою, зміни фізикохімічних властивостей, що знижує її бактеріостатичну здатність, нейродистрофічних змін стінки, порушення моторики жовчного міхура внаслідок дисфункції вегетативної, гастроінтестінальної систем.
У патогенезі хронічного холециститу значна роль належить алергічним і імунозапальним реакціям. Розвиваються специфічна і неспецифічна сенсибілізація, запалення в жовчному міхурі сприяє надходженню в кров мікробних антигенів і антигенних субстанцій стінки міхура, у відповідь розвиваються імунні і аутоімунні реакції в стінці міхура, що поглиблює і підтримує запалення.
До спеціальних методів дослідження відносять холецистографію, яку проводять після перорального або внутрішньовенного введення контрастної речовини.
В окремих випадках застосовують поєднаний спосіб введення контрастної речовини. Жовчний міхур і протоки краще контрастуються при поєднаному способі і томографії у різних проекціях.
При ХБХ виявляють різні рентгенологічні симптоми ураження жовчного міхура: подовження, звивистість, нерівномірність заповнення або фрагментацію міхурової протоки, її перегини, чергування ділянок розширення із звуженнями, відсутність зображення шийки з безпосереднім переходом тіла у тонку покручену міхурову протоку, деформацію тіні жовчного міхура.
Непрямими симптомами недостатності дренажної функції є: збільшення тіні жовчного міхура, порушення його скоротливої здатності та виникнення болю після вживання пробного сніданку. Проте застосування традиційних методик не завжди дозволяє виявити ті чи інші його форми. Так, у деяких випадках не вдається контрастування жовчного міхура, можлива помилкова діагностика каменів. Діагностичне значення окремих рентгенологі чних симптомів оцінити тяжко. Чим більше їх виявлено, тим достовірніший діагноз ХБХ. При деяких формах ХБХ у фазі ремісії хвороби рентгенологічні симптоми ураження жовчного міхура можуть взагалі бути відсутніми або мінімальними. Таким чином, клініко-рентгенологічний метод, який найчастіше використовується для діагностики ХБХ, не може вважатися абсолютно надійним.
При обстеженні хворих із підозрою на ХБХ за останні роки все частіше застосовують комплексний метод, при якому, крім звичайної холецистоабо холецистохолангіографії, застосовують транспарієтальну холецистохолангіографію, ультразвукове та радіонуклідне сканування, динамічну гепатобілісцинтиграфію, комп'ютерну томографію, лапароскопію.
Впровадження такого методу дозволяє виявити різні форми жовчного міхура, ступінь його зповнення контрастною речовиною, наявність перивезикулярних зрощень, деформацій та стан стінки.
Пряме введення контрастної речовини у жовчний міхур та можливість щільно його наповнити забезпечує чітку візуалізацію шийно-протокового сегмента та дозволяє оцінити стан проток. Проведення такого дослідження виправдане у хворих із частим та безперервно рецидивуючим перебігом ХБХ, оскільки воно дозволяє підтвердити або виключити органічний характер патології та визначити показання до оперативного

лікування. Не дивлячись на те, що при застосуванні цього методу ускладнень практично не буває, у діагностиці ХБХ краще застосовувати неінвазивні методи, наприклад КТ чи УЗД.
УЗД не має протипоказань і може застосовуватись у тих випадках, коли рентгенологічне дослідження не може бути проведене: у гостру фазу хвороби, при підвищеній чутливості до контрастних речовин, вагітності, печінковій недостатності, обструкції магістральних жовчних шляхів та міхурової протоки. Ультразвукове дослідження дозволяє не тільки виключити наявність конкрементів, але й оцінити скоротливу здатність та стан стінки жовчного міхура. Для ХБХ є характерним потовщення та склерозування стінки жовчного міхура та його деформації. Відсутність таких змін робить діагноз ХБХ малоймовірним.
Метод термографії для діагностики ХБХ суттєвого значення не має, але з його допомогою можна виявити цілий ряд особливостей при гострих та деструктивних формах холециститу.
При хронічному холециститі дані термографії, як правило, не змінюються. Лише при загостренні хронічного холециститу на термограмі ділянка правого підребер'я іноді виявляється світлою плямою, розміри та інтенсивність якої залежать від характеру та вираженості запалення жовчного міхура. Термографію при ХБХ потрібно проводити в основному для динамічного спостереження за станом запального процесу та для виявлення ускладнень. Її можна використовувати при будь-якому стані хворого, тому що метод є простим та нешкідливим.
При обстеженні хворих на ХБХ часто потрібно вивчати системи й органи, пов'язані з жовчовивідними шляхами анатомічно та функціонально. Це дозволяє робити висновки про стан жовчного міхура та жовчовивідних шляхів за непрямими ознаками, а також виключити хвороби з подібною симптоматикою. При потребі проводять рентгенологічне та ендоскопічне дослідження шлунка і дванадцятипалої кишки, іригоскопію, дуоденоскопію у стані гіпотонії, ехографію печінки та підшлункової залози, целіакографію, лапароскопію, екскреторну урографію.
2.Пневмонії. Лікування в залежності від збудника.
З практичних міркувань розрізняють емпіричну терапію (якщо не визначено етіологічний чинник захворювання) і етіотропну терапію хворих на пневмонію із встановленою етіологією. Оскільки на даний час не існує ефективних методів етіологічної експрес-діагностики пневмонії, в реальних умовах початкова етіотропна терапія практично завжди є емпіричною.
Для проведення емпіричної антибактеріальної терапії слід використовувати антибіотики, які мають:
-направлений спектр антимікробної дії - високу активність до основних ймовірних збудників пневмонії;
-оптимальний профіль безпеки (низька частота розвитку побічних ефектів);
-можливість створювати високі концентрації в тканинах і біологічних рідинах органів дихання;
-оптимальне співвідношення вартість/ефективність;
-зручність у застосуванні, що сприяє дотриманню хворим режиму лікування (комплайнс).
Це особливо важливо при амбулаторному лікуванні соціально активних хворих, які порушують режим прийому ліків. Комплайнс значною мірою залежить від необхідної частоти прийому лікарського препарату протягом доби, а також від тривалості курсу лікування. В таких випадках перевагу надають лікарським засобам, які призначають 1-2 рази на добу (наприклад, препарат амоксицилін/клавуланова кислота, що призначається 2 рази на добу) та/або короткими курсами (наприклад, азитроміцин).
У хворих на негоспітальну пневмонію I категорії (з нетяжким перебігом захворювання, які не потребують госпіталізації, без супутньої патології та інших "модифікуючих" факторів) адекватний клінічний ефект можливий при пероральному прийомі антибактеріальних препаратів (табл. 2). Як засіб вибору рекомендують
захищені амінопеніциліни (аугментин, амоксиклав) або макролід (азитроміцин, кларитроміцин,
мідекаміцин, спіраміцин). Як альтернативний препарат рекомендують призначати доксациклін. Цим пацієнтам вважають недоцільним призначати фторхінолони.
До II категорії відносять хворих на негоспітальну пневмонію з нетяжким перебігом, які не потребують госпіталізації, з наявністю супутньої патології та/або інших"модифікуючих" факторів (табл. 1). Виражений клінічний ефект також можливий у разі застосування пероральних антибіотиків. Однак, оскільки збільшується ймовірність етіологічної ролі грамнегативних мікроорганізмів (у тому числі тих, що мають деякі механізми розвитку резистентності до антибіотиків), як засоби вибору рекомендують захищений
амінопеніцилін (амоксицилін/клавуланова кислота) або цефалоспорин II покоління (цефуроксиму аксетил). Альтернативною терапією може бути застосування фторхінолону III-IV покоління. За неможливості перорального прийому препарату призначають парентеральне введення цефалоспорину III покоління (краще цефтриаксон, який можна застосувати 1 раз на добу).
Антибактеріальна терапія хворих НП в амбулаторних умовах
I група (з нетяжким перебігом НП, без супутньої патології та інших "модифікуючих"факторів) S. pneumoniae, M. pneumoniae, C. pneumoniae, H. influenzae
Пероральний прийом: амоксицилін або макролід Альтернатива per os: доксициклін
II група (з нетяжким перебігом НП, з наявністю супутньої патології та/або інших "модифікуючих" факторів)

S. pneumoniae, H. influenzae, M. pneumoniae, C. pneumoniae, S. aureus, M. catarrhalis, родина
Enterobacteriaceae
Пероральний прийом: амоксицилін/ клавуланова кислота або цефуроксиму аксетил Альтернатива Перорально: макролід або фторхінолон III-IV покоління, або цефтриаксон*
Госпіталізованим у терапевтичне відділення хворим III категорії з НП нетяжкого перебігу необхідно проводити парентеральну терапію з використанням амінопеніциліну, переважно захищеного (амоксицилін/клавуланова кислота, ампіцилін/сульбактам), або цефалоспорину II-III покоління (цефуроксим, цефотаксим, цефтриаксон) (табл. 3). У разі неефективності препарату вибору через 48 год. слід добавити до нього макролід (комбінована терапія) або замінити його фторхінолоном III-IV покоління (монотерапія). Хворим IV категорії з НП тяжкого перебігу, які госпіталізовані у ВРІТ, слід невідкладно призначити антибактеріальну терапію, оскільки відстрочування призначення антибіотика навіть на 8 год достовірно підвищує летальність таких пацієнтів.
Для лікування хворих цієї групи, які не мають факторів ризику Pseudomonas aeruginosa, рекомендують внутрішньовенно вводити захищений амінопеніцилін(амоксицилін/клавуланова кислота, ампіцилін/сульбактам) або цефалоспорин III покоління (цефотаксим, цефтриаксон) разом із макролідом. В якості альтернативної терапії пропонують комбінацію фторхінолону III-IV покоління з бета-лактамамом. Для лікування хворих IV групи з наявністю факторів ризику Pseudomonas aeruginosa необхідно призначати внутрішньовенно: фторхінолон II покоління (ципрофлоксацин) в поєднанні з бета-лактамом, активним у відношенні синьогнійної палички (цефтазидим, цефепім, меропенем) або аміноглікозидом. В якості альтернативної терапії пропонують антипсевдомонадний бета-лактам (меропенем) в поєднанні з аміноглікозидом.
Антибактеріальна терапія хворих на НП в умовах стаціонару
IIIгрупа (госпіталізовані у терапевтичне відділення з нетяжким перебігом НП) S. pneumoniae, H. influenzae, атипові збудники, грамнегативні ентеробактерії
Парентеральнj (в/м, в/в): амінопеніцилін переважно захищений або цефалоспорин II-III покоління +-макролід
Альтернатива: в/в: фторхінолон III-IV покоління
IV група (госпіталізовані у ВРІТ з тяжким перебігом НП)
S. pneumoniae, Legionella spp., H. influenzae, S. aureus, М. pneumoniae, грамнегативні ентеробактерії, Pseudomonas spp., полімікробні асоціації
В/в: захищений амінопеніцилін або цефалоспорин III покоління+ макролід Альтернатива в/в: фторхінолон III-IV покоління+ бета-лактам
При підозрі на P. aeruginosa: (в/в) ципрофлоксацин + бета-лактам, активний у відношенні
Синьо гнійної палички, або аміноглікозид. Альтернатива: в/в бета-лактам, активний у відношенні синьо гнійної палички, + аміноглікозид Критерії ефективності антибактеріальної терапії. Оцінку ефективності антибактеріальної терапії препаратами
вибору необхідно (обов'язково!) проводити через 48 год. від початку лікування (повторний огляд хворого). Доцільним є контакт із пацієнтом по телефону на другий день від початку лікування.
Основними критеріями ефективності в ці терміни слід вважати: зменшення вираженності інтоксикації та зниження температури тіла хворого, відсутність ознак дихальної недостатності. Якщо на початку лікування у пацієнта були відсутні ці прояви захворювання, слід орієнтуватися на його загальний стан та показники загального клінічного аналізу крові (кількість лейкоцитів, ШОЕ). За наявності позитивної динаміки наведених показників продовжують призначену антибактеріальну терапію. Якщо у пацієнта зберігаються висока лихоманка та інтоксикація або симптоматика прогресує, то лікування слід вважати неефективним, антибактеріальний засіб замінити на інший (альтернативні антибіотики) та повторно визначити доцільність госпіталізації.
Тривалість антибактеріальної терапії. У пацієнтів з нетяжким перебігом НП антибактеріальна терапія може бути завершена після досягнення нормалізації температури тіла протягом 3-5 днів. В таких випадках тривалість лікування складає, як правило, 7-10 днів. У разі отримання клінічних або епідеміологічних даних, які свідчать про мікоплазмену або хламідійну етіологію НП, тривалість антибактеріальної терапії складає в середньому 10-14 днів. Якщо позитивного ефекту лікування досягнуто, в ці терміни заміна антибіотика недоцільна.
Критерії достатності антибактеріальної терапії хворих на НП: - Температура тіла нижче 37,5 град. С.
- Відсутність симптомів інтоксикації.
- Відсутність ознак дихальної недостатності (частота дихання нижче 20 за 1 хв.). - Відсутність гнійного харкотиння.

-Кількість лейкоцитів в крові менше 10х109/л, нейтрофільних гранулоцитів - менше 80%, юних форм - менше 6%.
-Відсутність негативної динаміки за даними рентгенологічного дослідження.
3. Анемії. Діагностичні критерії та принципи лікування гіпопластичних анемій.
Гіпопластична (апластична) анемія — це патологічний стан різного походження, для якого характерне різке пригнічення кістковомозкового кровотворення.
Критерії діагнозу гіпо-(а-)пластичної анемії:
1.Нормохромна анемія (рідше гіперхромна)
2.гіпорегенераторна (кількість ретикулоцитів знижена).
3.Лейкопенія з гранулоцитопенією, нейтропенією і відносним лімфоцитозом. 4.Тромбоцитопенія.
5.У мієлограмі: зменшена кількість мієлокаріоцитів, абсолютно зменшена кількість гранулоцитів, еритрокаріоцитів, мегакаріоцитів, спостерігається відносний лімфоцитоз.
6.Гістологічне дослідження кісткового мозку свідчить про жирове переродження.
7.Рівень сироваткового заліза нормальний або підвищений.
Лікування гіпопластичної анемії. Якщо передбачають зв'язок розвитку гіпоплазії кісткового мозку з впливом будь-яких мієлотоксичних факторів (хімічних речовин, ліків та ін.), необхідно усунути контакт хворого з цими речовинами.
Завданням лікування є відновлення кількості і функцій стовбурових клітин і пригнічення імунних процесів, спрямованих проти кровотвірних елементів кісткового мозку.
Підґрунтям лікування є імуносупресивна терапія, що включає призначення антилімфоцитарного імуноглобуліну, циклоспорину А (сандимуну), кортикостероїдних гормонів, цитостатичних препаратів (циклофосфану та ін.).
Протипоказаннями до призначення імуносупресивної терапії є: виражений геморагічний синдром, інфекційно-запальні ускладнення, тяжка патологія печінки, нирок, серцево-судинної системи. Допоміжна терапія включає трансфузії еритроцитної маси, тромбоцитарного концентрату, судинозміцнювальних препаратів, антибіотиків та інших засобів.
До комплексу терапії з метою корекції нейтропенії вводять гемопоетичні фактори росту: гранулоцитарний колонієстимулювальний фактор (Г-КСФ) — нейпоген, філграстим, гранулоцитарномакрофагальний колонієстимулювальний фактор (ГМ-КСФ) — граноцит. Для стимуляції еритропоезу можливе застосування стимуляторів еритропоезу (еритропоетин, рекормон, епрекс).
Лікування проводять тривалий час курсами або безперервно протягом 6-9-12 міс.
У разі недостатнього ефекту від терапії здійснюють спленектомію. Оскільки при гіпопластичній анемії селезінка є основним органом патологічного імуногенезу і впливає на гемопоез, її видалення в частини хворих дає позитивний результат.
Одним з основних методів лікування гіпопластичної анемії є пересадження кісткового мозку. Кістковий мозок зазвичай беруть у близьких родичів хворого або донорів кісткового мозку. Неодмінною умовою успішної трансплантації є ретельний імунологічний підбір кісткового мозку, який здійснюється спеціалізованими лабораторіями.
За допомогою трансплантації кісткового мозку вдається домогтися поліпшення стану в понад 50% хворих. Однак одужання від гіпопластичної анемії спостерігається лише у 25—50% захворілих.
