
- •2. Статистический и термодинамический методы изучения систем многих частиц.
- •3. Массы атомов и молекул. Количество вещества.
- •4. Молекулярные силы
- •5. Агрегатные состояния вещества. Характер теплового движения в этих состояниях. Особенности теплового движения в различных агрегатных состояниях вещества.
- •6. Понятие вероятности. (Частотное и априорное определения вероятности события.)
- •7. Некоторые теоремы теории вероятности. (Теоремы сложения и умножения вероятностей. Условие нормировки вероятностей.)
- •8. Интегральная функция распределения. Случайные величины. Интегральная функция распределения случайной величины и её свойства.
- •9. Плотность вероятности и её свойства.
- •10. Средние значения случайных величин. (математическое ожидание). Среднее по времени и среднее по ансамблю. Эргодическая гипотеза (без доказательства).
- •11. Дисперсия и её свойства.
- •15. Модель идеального газа.
- •16. Равновесные состояния и процессы. Термодинамическое равновесие. Равновесные процессы.
- •17. Распределения молекул газа по направлениям движения в состоянии равновесия.
- •18. Число ударов молекул о стенку сосуда (о единицу площади за единицу времени).
- •19. Основное уравнение молекулярно-кинетической теории газов для давления. (Давление иг с точки зрения мкт.)
- •20. Температура и ее измерение. Эмпирические (Опытные) температурные шкалы. Идеально-газовая шкала температур.
- •21. Температура – мера средней кинетической энергии поступательного движения молекул. Молекулярно-кинетический смысл температуры.
- •22. Уравнение Менделеева – Клапейрона (Уравнение состояния идеального газа). Законы идеального газа (следствия из этого уравнения).
- •25. Распределение Максвелла для относительных скоростей (формула).
- •26. Экспериментальная проверка распределения Максвелла (опыт Штерна, опыт Ламерта).
- •27. Распределение Больцмана. Идеальный газ во внешнем поле сил. Барометрическая формула.
- •28. Распределение Максвелла-Больцмана
- •29. Понятие об отрицательных абсолютных температурах.
- •30. Флуктуация. Зависимость относительной флуктуации от числа частиц в системе. Роль флуктуации в науке и технике.
- •31. Теорема о равномерном распределении энергии теплового движения по степеням свободы. Число степеней свободы молекул. Средняя энергия теплового движения молекул газа.
- •32. Броуновское движение. Проверка распределения Больцмана в опытах с броуновским движением. Формула Эйнштейна для описания броуновского движения.
- •33. Внутренняя энергия. Термодинамический метод. Выражение для внутренней энергии идеального газа.
- •34. Работа и количество тепла. Первый закон термодинамики. Работа при равновесном и неравновесном изменении объема системы.
- •35. Теплоемкость. Применение 1-го начала термодинамики для вычисления теплоемкости вещества.
- •36. Теплоемкость молекулярного водорода (экспериментальная). Классическая теория теплоемкостей идеального газа. Ограниченность теоремы о равномерном распределении энергии по степеням свободы.
- •38. Адиабатный процесс. Уравнение адиабаты идеального газа. Работа идеального газа при адиабатическом изменении его объема.
- •39. Политропные процессы. Уравнение политропы идеального газа. Работа идеального газа при политропическом процессе.
- •40. Обратимые и необратимые процессы.
- •41. Круговые термодинамические процессы и циклы. Тепловые и холодильные машины. Работа при круговом процессе. Первое начало термодинамики в применении к круговому процессу.
- •42. Второе начало термодинамики в формулировках Кельвина и Клаузиуса, их эквивалентность. Недостаточность первое начала термодинамики для однозначного описания процессов, происходящих в природе.
- •43. Цикл Карно и его кпд.
- •44. Теоремы Карно. Кпд цикла Карно – верхний предел кпд тепловых машин.
- •45. Равенство Клаузиуса. Энтропия. Свойства энтропии. Математическое выражение второго начала термодинамики для обратимых процессов. Постоянство энтропии при обратимых процессах в замкнутой системе.
- •46. Основное уравнение термодинамики для обратимых процессов. Энтропия идеального газа.
- •48. Свободная энергия системы.
- •51. Уравнение Клапейрона-Клаузиуса (дифференциальное).
- •52. Уравнение Ван-дер-Ваальса – Уравнение состояния неидеальных газов. Опытное определение констант уравнения Ван-дер-Ваальса.
- •54. Внутренняя энергия газа Ван-дер-Ваальса. Адиабатическое расширения газа ВдВ в пустоту.
- •55. Эффект Джоуля-Томсона. Общая термодинамическая теория дифференциального эффекта Джоуля-Томсона.
- •56. Эффект Джоуля-Томсона в газе Ван-дер-Ваальса.
- •57. Сжижение газов. Получение низких и сверхнизких температур. Метод магнитного охлаждения.
- •58. Среднее число столкновений и средняя длина свободного пробега молекул. Эффективный диаметр газовых молекул. Понятие об эффективном сечении процесса столкновения частиц.
- •59. Общее уравнение явлений переноса. Явления переноса. Общее уравнение явлений переноса в газах.
- •60. Теплопроводность. Уравнение теплопроводности. Основной закон теплопроводности – закон Фурье. Вычисление и экспериментальное определение коэффициента теплопроводности.
- •61. Внутреннее трение (вязкость) газов. Основной закон вязкости – закон Ньютона. Вычисление (и экспериментальное определение) коэффициента вязкости.
- •62. Диффузия. Основной закон диффузии – закон Фика. Вычисление коэффициента самодиффузии газов.
- •63. Некоторые свойства разреженных газов. Физические явления в сильно разреженных газах. Определение вакуума. Течение и равновесие газов в условиях вакуума. Молекулярное течение. Тепловая эффузия.
- •64. Теплопроводность и вязкое трение в ультраразреженных газах.
- •65. Общие свойства жидкостей.
- •66. Молекулярное давление и поверхностное натяжение жидкостей.
- •67. Явления на границе жидкости и твердого тела.
- •68. Избыточное давление под искривленной поверхностью жидкости. Формула Лапласа.
- •69. Капиллярные явления.
- •70. Давление насыщенного пара над искривленной поверхностью жидкости.
- •72. Кипение. Перегрев жидкостей.
- •74. Кристаллические решетки. Решетки Браве. Элементы симметрии решетки. Классификация решеток Браве по кристаллографическим системам.
- •77. Плавление, кристаллизация и возгонка (сублимация) твердых тел.
- •78. Теплоемкость твердых тел. Классическая теория и ее недостатки.
- •79. Фазовая диаграмма кристалл-жидкость-газ. Тройная точка.
- •80. Фазовые переходы первого и второго рода. Фазовая диаграмма гелия.
17. Распределения молекул газа по направлениям движения в состоянии равновесия.
Рассмотрим газ, находящийся в состоянии равновесия. При этом он занимает объем V и содержит N молекул. При отсутствии внешних сил молекулы газа распределяются равномерно по объему V и движутся хаотически, не имея преимущественного направления. Если провести сферу радиусом R вокруг объема V и в произвольный момент времени продолжить направления скоростей движения всех молекул до пересечения с этой сферой, то вся сфера покроется точками в местах этих пересечений. Причем из-за отсутствия преимущественного направления в движении молекул (равновесие) поверхностная плотность этих точек = N/4R2 будет постоянна по всей сфере в любой момент времени.
Выберем на сфере произвольную элементарную площадку dS. Тогда количество точек, оказавшихся на этой площадке
dN = NdS /4R2= Nd/4, (1.3.1)
где d=dS/R2 – телесный угол, под которым видна площадка из центра сферы. (Полный телесный угол, стягиваемый сферой
= ∫ d = ∫ dS/R2 =4R2/R2=4).
Соотношение (1.3.1) можно представить в виде
dN / N = d /4. (1.3.2)
Левая часть равенства (1.3.2) представляет собой отношение числа молекул dN, направления скоростей которых заключены в телесном угле d, к общему числу молекул и при большом N равна вероятности того, что взятая наугад молекула в газе имеет направление скорости, заключенное в телесном угле d. Формула (1.3.2) выражает закон равновероятности направлений движения молекул в равновесном состоянии газа.
 Р
и с. 8
Р
и с. 8
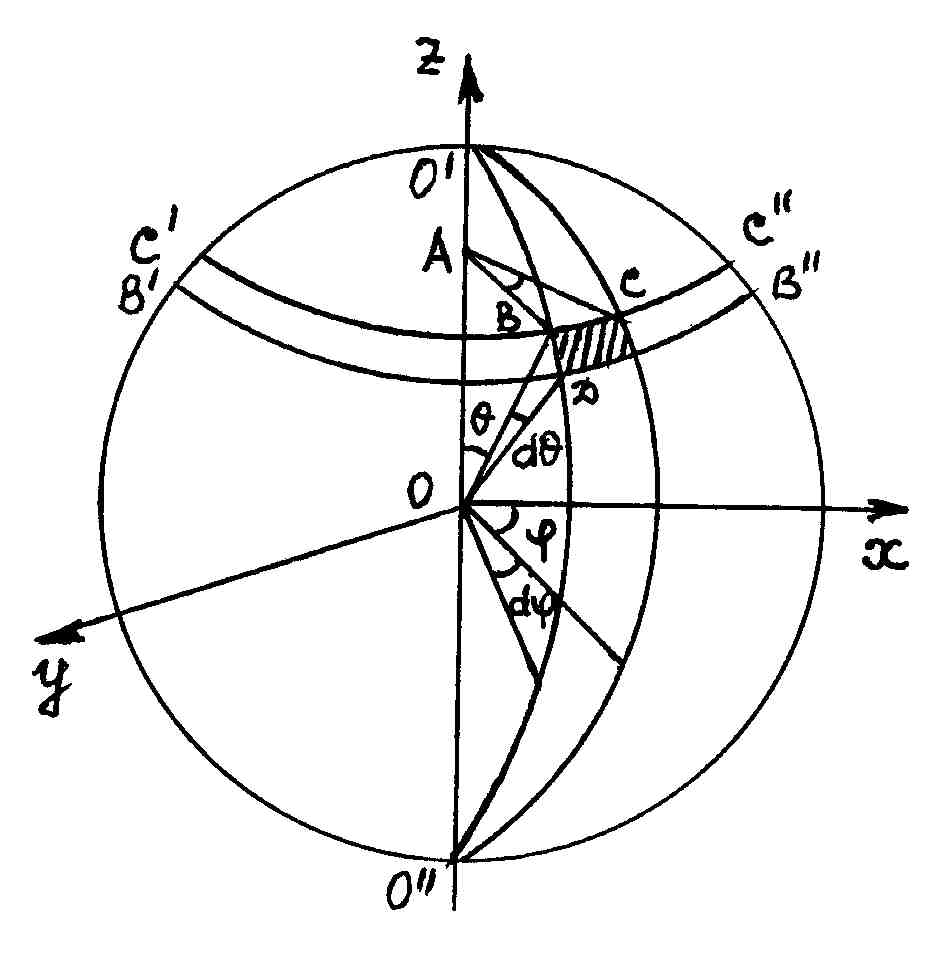
Найдем дифференциал площади dS в сферической системе координат. В результате пересечения четырех указанных окружностей получается элемент сферы, (на рис. 8 заштрихован) площадь которого
dS = BC·BD, (1.3.3)
где BC = ABd = R sin d, BD = R d.
Подставляя последние величины в формулу (1.3.3), получим выражение для бесконечно малой площади в сферической системе координат:
dS = R2sin d d. (1.3.4)
Из выражений (1.3.4) и (1.3.1) находим число частиц, которые имеют направления, определяемые сферическими углами, лежащими в интервалах от до + d и от до + d:
dN, = N sin d d /4. (1.3.5)
18. Число ударов молекул о стенку сосуда (о единицу площади за единицу времени).
Объем цилиндра на рис. 9
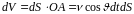 , (1.4.1)
, (1.4.1)
а число молекул в нем d = ndV, где n – концентрация молекул в сосуде.
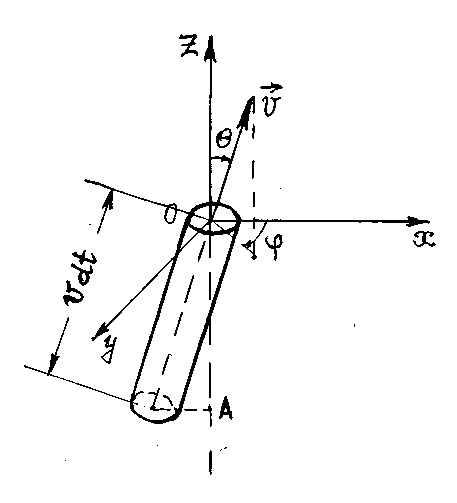
Р и с. 9
Обозначим через dn число молекул в единице объема газа, которые имеют скорости, заключенные в интервале (, + d). Пусть среди этих молекул dn молекул в единице объема имеют направления движения, определяемые сферическими углами, взятыми из интервалов (, + d) и (, + d). Количество таких молекул в единице объема газа равно
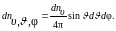 (1.4.2)
(1.4.2)
Число же указанных молекул в объеме dV рассматриваемого цилиндра
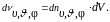 (1.4.3)
(1.4.3)
С учетом формул (1.4.1) и (1.4.2) выражение (1.4.3) примет вид
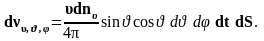 (1.4.4)
(1.4.4)
Таким образом, среди всех молекул, находящихся в объеме dV цилиндра, d,, молекул имеют близкие к скорости, и их направления движения определяются углами, близкими к углам и . Однако из объема V, занимаемого газом, к площадке dS подлетают молекулы с других направлений и с иными скоростями. Чтобы учесть это, необходимо проинтегрировать выражение (1.4.4) по всем возможным углам и и скоростям :
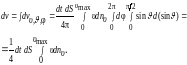 (1.4.5)
(1.4.5)
Разделив обе части соотношения (1.4.5) на dtdS, получим
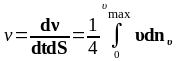 (1.4.6)
(1.4.6)
Таким образом, выражение (1.4.6) определяет число ударов молекул газа в единицу времени о единичную площадку стенки сосуда.
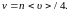 (1.4.12)
(1.4.12)
Число ударов молекул газа в единицу времени о единичную площадку пропорционально концентрации и средней скорости их движения.
