
- •2. Статистический и термодинамический методы изучения систем многих частиц.
- •3. Массы атомов и молекул. Количество вещества.
- •4. Молекулярные силы
- •5. Агрегатные состояния вещества. Характер теплового движения в этих состояниях. Особенности теплового движения в различных агрегатных состояниях вещества.
- •6. Понятие вероятности. (Частотное и априорное определения вероятности события.)
- •7. Некоторые теоремы теории вероятности. (Теоремы сложения и умножения вероятностей. Условие нормировки вероятностей.)
- •8. Интегральная функция распределения. Случайные величины. Интегральная функция распределения случайной величины и её свойства.
- •9. Плотность вероятности и её свойства.
- •10. Средние значения случайных величин. (математическое ожидание). Среднее по времени и среднее по ансамблю. Эргодическая гипотеза (без доказательства).
- •11. Дисперсия и её свойства.
- •15. Модель идеального газа.
- •16. Равновесные состояния и процессы. Термодинамическое равновесие. Равновесные процессы.
- •17. Распределения молекул газа по направлениям движения в состоянии равновесия.
- •18. Число ударов молекул о стенку сосуда (о единицу площади за единицу времени).
- •19. Основное уравнение молекулярно-кинетической теории газов для давления. (Давление иг с точки зрения мкт.)
- •20. Температура и ее измерение. Эмпирические (Опытные) температурные шкалы. Идеально-газовая шкала температур.
- •21. Температура – мера средней кинетической энергии поступательного движения молекул. Молекулярно-кинетический смысл температуры.
- •22. Уравнение Менделеева – Клапейрона (Уравнение состояния идеального газа). Законы идеального газа (следствия из этого уравнения).
- •25. Распределение Максвелла для относительных скоростей (формула).
- •26. Экспериментальная проверка распределения Максвелла (опыт Штерна, опыт Ламерта).
- •27. Распределение Больцмана. Идеальный газ во внешнем поле сил. Барометрическая формула.
- •28. Распределение Максвелла-Больцмана
- •29. Понятие об отрицательных абсолютных температурах.
- •30. Флуктуация. Зависимость относительной флуктуации от числа частиц в системе. Роль флуктуации в науке и технике.
- •31. Теорема о равномерном распределении энергии теплового движения по степеням свободы. Число степеней свободы молекул. Средняя энергия теплового движения молекул газа.
- •32. Броуновское движение. Проверка распределения Больцмана в опытах с броуновским движением. Формула Эйнштейна для описания броуновского движения.
- •33. Внутренняя энергия. Термодинамический метод. Выражение для внутренней энергии идеального газа.
- •34. Работа и количество тепла. Первый закон термодинамики. Работа при равновесном и неравновесном изменении объема системы.
- •35. Теплоемкость. Применение 1-го начала термодинамики для вычисления теплоемкости вещества.
- •36. Теплоемкость молекулярного водорода (экспериментальная). Классическая теория теплоемкостей идеального газа. Ограниченность теоремы о равномерном распределении энергии по степеням свободы.
- •38. Адиабатный процесс. Уравнение адиабаты идеального газа. Работа идеального газа при адиабатическом изменении его объема.
- •39. Политропные процессы. Уравнение политропы идеального газа. Работа идеального газа при политропическом процессе.
- •40. Обратимые и необратимые процессы.
- •41. Круговые термодинамические процессы и циклы. Тепловые и холодильные машины. Работа при круговом процессе. Первое начало термодинамики в применении к круговому процессу.
- •42. Второе начало термодинамики в формулировках Кельвина и Клаузиуса, их эквивалентность. Недостаточность первое начала термодинамики для однозначного описания процессов, происходящих в природе.
- •43. Цикл Карно и его кпд.
- •44. Теоремы Карно. Кпд цикла Карно – верхний предел кпд тепловых машин.
- •45. Равенство Клаузиуса. Энтропия. Свойства энтропии. Математическое выражение второго начала термодинамики для обратимых процессов. Постоянство энтропии при обратимых процессах в замкнутой системе.
- •46. Основное уравнение термодинамики для обратимых процессов. Энтропия идеального газа.
- •48. Свободная энергия системы.
- •51. Уравнение Клапейрона-Клаузиуса (дифференциальное).
- •52. Уравнение Ван-дер-Ваальса – Уравнение состояния неидеальных газов. Опытное определение констант уравнения Ван-дер-Ваальса.
- •54. Внутренняя энергия газа Ван-дер-Ваальса. Адиабатическое расширения газа ВдВ в пустоту.
- •55. Эффект Джоуля-Томсона. Общая термодинамическая теория дифференциального эффекта Джоуля-Томсона.
- •56. Эффект Джоуля-Томсона в газе Ван-дер-Ваальса.
- •57. Сжижение газов. Получение низких и сверхнизких температур. Метод магнитного охлаждения.
- •58. Среднее число столкновений и средняя длина свободного пробега молекул. Эффективный диаметр газовых молекул. Понятие об эффективном сечении процесса столкновения частиц.
- •59. Общее уравнение явлений переноса. Явления переноса. Общее уравнение явлений переноса в газах.
- •60. Теплопроводность. Уравнение теплопроводности. Основной закон теплопроводности – закон Фурье. Вычисление и экспериментальное определение коэффициента теплопроводности.
- •61. Внутреннее трение (вязкость) газов. Основной закон вязкости – закон Ньютона. Вычисление (и экспериментальное определение) коэффициента вязкости.
- •62. Диффузия. Основной закон диффузии – закон Фика. Вычисление коэффициента самодиффузии газов.
- •63. Некоторые свойства разреженных газов. Физические явления в сильно разреженных газах. Определение вакуума. Течение и равновесие газов в условиях вакуума. Молекулярное течение. Тепловая эффузия.
- •64. Теплопроводность и вязкое трение в ультраразреженных газах.
- •65. Общие свойства жидкостей.
- •66. Молекулярное давление и поверхностное натяжение жидкостей.
- •67. Явления на границе жидкости и твердого тела.
- •68. Избыточное давление под искривленной поверхностью жидкости. Формула Лапласа.
- •69. Капиллярные явления.
- •70. Давление насыщенного пара над искривленной поверхностью жидкости.
- •72. Кипение. Перегрев жидкостей.
- •74. Кристаллические решетки. Решетки Браве. Элементы симметрии решетки. Классификация решеток Браве по кристаллографическим системам.
- •77. Плавление, кристаллизация и возгонка (сублимация) твердых тел.
- •78. Теплоемкость твердых тел. Классическая теория и ее недостатки.
- •79. Фазовая диаграмма кристалл-жидкость-газ. Тройная точка.
- •80. Фазовые переходы первого и второго рода. Фазовая диаграмма гелия.
77. Плавление, кристаллизация и возгонка (сублимация) твердых тел.
Плавлением называют процесс перехода вещества из твердого кристаллического состояния в жидкое. Плавление происходит при постоянной температуре с поглощением тепла. Постоянство температуры объясняется тем, что при плавлении вся подводимая теплота идет на разупорядочение регулярного пространственного расположения атомов (молекул) в кристаллической решетке. При этом среднее расстояние между атомами и, следовательно, силы взаимодействия изменяется незначительно. Температура плавления для данного кристалла его важная характеристика, но она не является величиной постоянной, а существенным образом зависит от внешнего давления, при котором происходит плавление. Для большинства кристаллов (кроме воды, и некоторых сплавов) температура плавления растет с увеличением внешнего давления, так как для отдаления атомов друг от друга при большем давлении требуется большая энергия тепловых движений, т. е. более высокая температура.
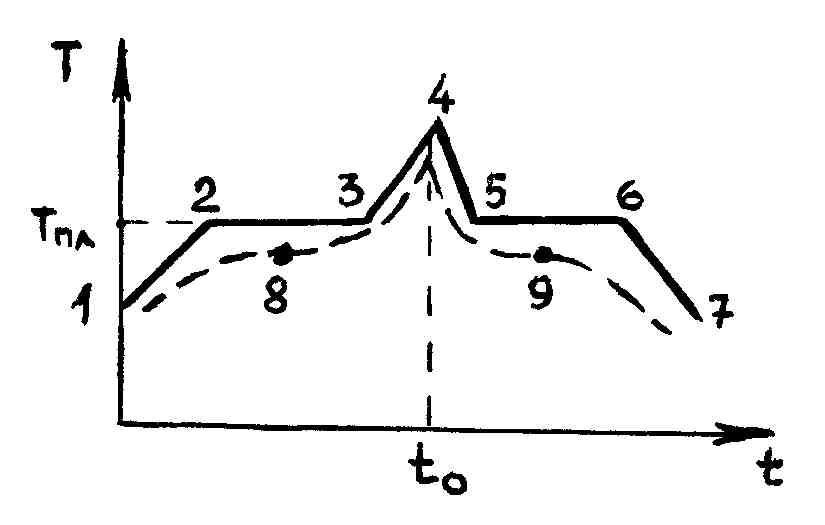
На рис. 93 представлена зависимость температуры нагреваемого кристалла от времени.
Р и с. 93
На участке 12 происходит нагревание кристалла. При достижении температуры Tпл вся поступающая теплота идет на плавление кристалла (участок 23), нагревания его не происходит.
Количество теплоты qпл, необходимое для превращения одного моля кристалла в жидкое состояние при постоянной температуре плавления, называют молярной скрытой теплотой плавления. Каждому кристаллу присуща своя величина теплоты плавления.
Отметим, что усиление или ослабление подвода тепла на участке 23 вызывает только ускорение или замедление процесса плавления, не изменяя величины Tпл. Если прекратить подвод тепла, то останавливается и процесс плавления, т. е. двухфазной системе жидкостькристалл устанавливается равновесное состояние, когда числа молекул, переходящих в единицу времени из твердой фазы в жидкую и обратно, равны.
На участке 34 происходит процесс нагревания жидкости. Если в момент времени t0 остановить нагревание жидкости, то возникнет обратный процесс охлаждения жидкости (участок 45). Когда температура достигнет температуры плавления, начнется кристаллизация жидкости (участок 56). Как только процесс кристаллизации заканчивается (точка 6), дальнейший отвод тепла сопровождается понижением температура (участок 67).
В кристалле, как мы знаем, каждая молекула совершает только колебательное движение, тогда как в жидкости она совершает еще и поступательное движение. Поэтому при кристаллизации от вещества необходимо отводить тепловую энергию, соответствующую поступательному движению молекул. Молекулы, утратившие этот излишек энергии, присоединяются к кристаллам.
У аморфных тел изменение температуры со временем (пунктирная кривая на рис. 93) не имеет участка с постоянной температурой, а только точку перегиба (8 или 9). Увеличение температуры твердого аморфного тела сопровождается непрерывным уменьшением его вязкости. У аморфных тел нельзя указать такую определенную температуру, выше которой можно было бы констатировать жидкое состояние, а ниже твердое состояние. Выделяется только температура, соответствующая точке перегиба. Эту температуру условно называют температурой размягчения аморфных тел.
Изменение температуры dT плавления кристалла связано с изменением внешнего давления dP уравнением Клапейрона Клаузиуса:
 (6.6.1)
(6.6.1)
где

молярные объемы жидкости и кристалла
соответственно. Перепишем уравнение
(6.6.1) в эквивалентной форме:
молярные объемы жидкости и кристалла
соответственно. Перепишем уравнение
(6.6.1) в эквивалентной форме:
 (6.6.2)
(6.6.2)
Если
 ,
то, как видно из (6.6.2),
,
то, как видно из (6.6.2),
 (dP
и dT
имеют
одинаковые знаки), следовательно, с
увеличением внешнего давления температура
плавления также увеличивается и наоборот.
Если же
(dP
и dT
имеют
одинаковые знаки), следовательно, с
увеличением внешнего давления температура
плавления также увеличивается и наоборот.
Если же
 ,
то
,
то
 (dP
и dT
имеют разные
знаки); в этом случае увеличение внешнего
давления сопровождается уменьшением
температуры плавления (этот случай
имеет место, как указывалось выше, для
кристаллов H2O,
Ga,
Bi
и др.).
(dP
и dT
имеют разные
знаки); в этом случае увеличение внешнего
давления сопровождается уменьшением
температуры плавления (этот случай
имеет место, как указывалось выше, для
кристаллов H2O,
Ga,
Bi
и др.).
Так как при плавлении
изменение
 объема двух фаз значтельно меньше, чем
при кипении, то
объема двух фаз значтельно меньше, чем
при кипении, то
 . (6.6.3)
. (6.6.3)
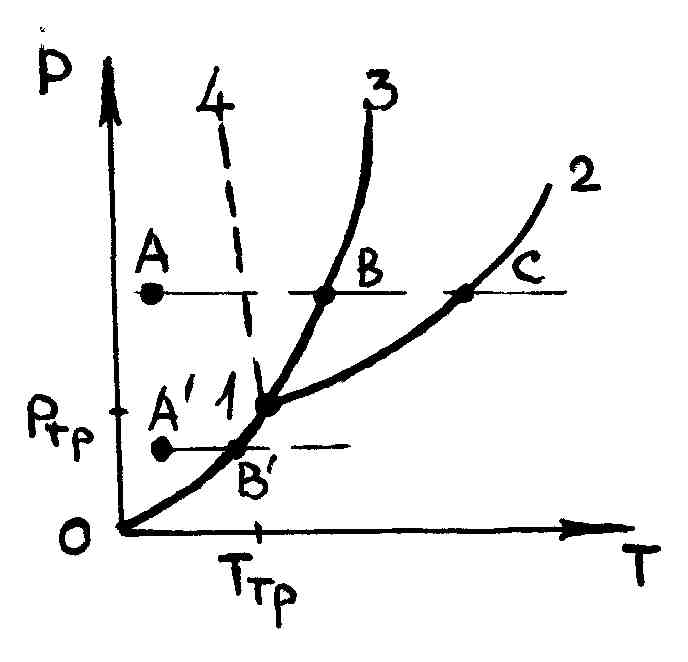
Это свидетельствует о том, что кривая плавления Pпл(T) растет гораздо быстрее кривой кипения Pкип(T), т. е. графики этих функций на плоскости P, T должны пересекаться. На рис. 94 кривая кипения 12 пересекается с кривой плавления 13 в точке 1.
Р и с. 94
Линия 13 относится к кристаллам, для которых , а линия 14 для кристаллов с . Слева от этих линий вещество находится при температурах, которые меньше температуры плавления, т. е. в кристаллическом состоянии; справа от этих линий вещество находится при более высокой температуре, т. е. в жидком состоянии. Вдоль самих линий 13 или 14, в каждой их точке, кристаллическая и жидкая фазы существуют одновременно. Точка 1 соответствует самому низкому давлению, при котором еще возможно превращение вещества из кристаллического состояния в жидкое и обратно, т. е. равновесное состояние между кристаллической и жидкой фазами: при меньших давлениях жидкое состояние не существует.
На этом же рисунке кривая кипения 12, которую мы рассматривали ранее, представляет собой зависимость давления насыщенных паров от температуры. Слева от этой кривой вещество находится при температурах, которые меньше температуры кипения, т. е. в жидком состоянии; точки же, расположенные справа от этой кривой, соответствуют более высоким температурам и, значит, состояниям насыщенного пара. Вдоль самой кривой 12 жидкость и ее насыщенный пар сосуществует одновременно так, что число молекул, покидающих жидкость, равно числу молекул, возвращающихся обратно, т. е. жидкость и пар находятся в равновесии. Точка 1 на этой кривой соответствует самой низкой температуре и самому низкому давлению, при которых еще может сосуществовать жидкость в равновесии со своим насыщенным паром. Точка 1 называется тройной точкой данного вещества, которая характеризуется тем, что в ней одновременно существуют в равновесии друг с другом все три фазы вещества: газообразное (насыщенный пар), жидкое и твердое. Для каждого вещества имеются определенные значения давлений Pтр и температуры Tтр тройной точки (табл. 6.6.1).
Таблица 6.6.1
Вещество |
Tтр, К |
Pтр, атм |
Углекислота (CO2) |
216,5 |
5,11 |
Вода (H20) |
273,16 |
5·10-3 |
Кислород (O2) |
54,4 |
15·10-4 |
Йод (J2) |
387,3 |
12·10-2 |
При давлениях
меньших Pтр
в равновесии могут находиться только
твердое и газообразное состояния
вещества (кривая 10). Переход вещества
из твердого состояния в газообразное
называют возгонкой (сублимацией).
Соответственно кривую 10 равновесия
твердое тело
газ называют кривой возгонки, или
сублимации. Возгонка связана с разрушением
кристаллической решетки и требует
энергии. Количество тепловой энергии
qвоз,
необходимое для перевода одного моля
кристалла из твердого состояния
непосредственно в газообразное,
называется молярной скрытой теплотой
возгонки. Теплота возгонки, очевидно,
равна сумме скрытых теплот плавления
и парообразования, т. е.
 .
.
Равновесное давление (ординаты кривой 10) насыщенных паров над кристаллом имеют малую величину, которую чрезвычайно трудно измерить.
РТ диаграмма вещества является его важнейшей характеристикой. Располагая РТ диаграммой заданного вещества, мы всегда легко можем выяснить, в каком состоянии твердом, жидком или газообразном находится это вещество при каких-либо давлении Р и температуре Т.
Возьмем на диаграмме РТ какую-нибудь точку A (рис. 94). Температура, соответствующая точке A, меньше температуры точки B, расположенной на кривой плавления 13 при том же давлении. Поэтому точка A изображает вещество в твердом состоянии, так как его температура ниже температуры плавления. Будем нагревать данное вещество при постоянном внешнем давлении. Тогда точка A, изображающая состояние вещества, будет двигаться вправо по прямой параллельной оси AC. В тот момент, когда точка A попадет на кривую плавления в положение B, начнется процесс плавления, и дальнейший приток теплоты к телу, как мы знаем, не будет сопровождаться повышением температуры: поступающая теплота к веществу идет исключительно на плавление тела. Поэтому во все время плавления, пока вещество находится частью в твердом, частью в жидком состоянии, точка A, изображающая состояние вещества, остается на кривой 13 плавления. Когда все кристаллы расплавятся, и мы будем иметь одну только жидкость, дальнейшее нагревание вызовет снова повышение температуры, и точка A будет опять двигаться вправо. В точке C, лежащей на кривой 12 кипения, начнется процесс кипения жидкости, который происходит при постоянной температуре кипения. После окончания процесса кипения все вещество окажется в газообразном состоянии. Дальнейший подвод теплоты приведет к нагреванию газа. Обратное охлаждение пара при том же внешнем давлении, заставит точку A двигаться по той же горизонтальной прямой влево, причем в точке C произойдет конденсация пара в жидкость, в точке B кристаллизация жидкости.
Возьмем теперь точку A, изображающую кристаллическое состояние вещества при давлении меньшем, чем давление в тройной точке 1. Будем нагревать такой кристалл при постоянном внешнем давлении, точка начнет смещаться вправо вдоль прямой. В точке B кристалл испарится, т. е. произойдет процесс возгонки. Обратно, при охлаждении пара при постоянном давлении вдоль прямой BA в точке B вещество кристаллизуется из парообразного состояния.
Таким образом, нагревание кристалла при давлении выше тройной точки сопровождается его плавлением; при нагревании же под давлением ниже тройной точки тело расплавиться не может, а будет испаряться или возгоняться. Если нагревать кристалл при атмосферном давлении, то плавление наступит при условии, что давление тройной точки этого кристалла ниже атмосферного давления, в противном случае будет наблюдаться возгонка. Например, как видно из табл. 6.6.1, углекислота (сухой лед) при атмосферном давлении будет возгоняться.
