- •2. Статистический и термодинамический методы изучения систем многих частиц.
- •3. Массы атомов и молекул. Количество вещества.
- •4. Молекулярные силы
- •5. Агрегатные состояния вещества. Характер теплового движения в этих состояниях. Особенности теплового движения в различных агрегатных состояниях вещества.
- •6. Понятие вероятности. (Частотное и априорное определения вероятности события.)
- •7. Некоторые теоремы теории вероятности. (Теоремы сложения и умножения вероятностей. Условие нормировки вероятностей.)
- •8. Интегральная функция распределения. Случайные величины. Интегральная функция распределения случайной величины и её свойства.
- •9. Плотность вероятности и её свойства.
- •10. Средние значения случайных величин. (математическое ожидание). Среднее по времени и среднее по ансамблю. Эргодическая гипотеза (без доказательства).
- •11. Дисперсия и её свойства.
- •15. Модель идеального газа.
- •16. Равновесные состояния и процессы. Термодинамическое равновесие. Равновесные процессы.
- •17. Распределения молекул газа по направлениям движения в состоянии равновесия.
- •18. Число ударов молекул о стенку сосуда (о единицу площади за единицу времени).
- •19. Основное уравнение молекулярно-кинетической теории газов для давления. (Давление иг с точки зрения мкт.)
- •20. Температура и ее измерение. Эмпирические (Опытные) температурные шкалы. Идеально-газовая шкала температур.
- •21. Температура – мера средней кинетической энергии поступательного движения молекул. Молекулярно-кинетический смысл температуры.
- •22. Уравнение Менделеева – Клапейрона (Уравнение состояния идеального газа). Законы идеального газа (следствия из этого уравнения).
- •25. Распределение Максвелла для относительных скоростей (формула).
- •26. Экспериментальная проверка распределения Максвелла (опыт Штерна, опыт Ламерта).
- •27. Распределение Больцмана. Идеальный газ во внешнем поле сил. Барометрическая формула.
- •28. Распределение Максвелла-Больцмана
- •29. Понятие об отрицательных абсолютных температурах.
- •30. Флуктуация. Зависимость относительной флуктуации от числа частиц в системе. Роль флуктуации в науке и технике.
- •31. Теорема о равномерном распределении энергии теплового движения по степеням свободы. Число степеней свободы молекул. Средняя энергия теплового движения молекул газа.
- •32. Броуновское движение. Проверка распределения Больцмана в опытах с броуновским движением. Формула Эйнштейна для описания броуновского движения.
- •33. Внутренняя энергия. Термодинамический метод. Выражение для внутренней энергии идеального газа.
- •34. Работа и количество тепла. Первый закон термодинамики. Работа при равновесном и неравновесном изменении объема системы.
- •35. Теплоемкость. Применение 1-го начала термодинамики для вычисления теплоемкости вещества.
- •36. Теплоемкость молекулярного водорода (экспериментальная). Классическая теория теплоемкостей идеального газа. Ограниченность теоремы о равномерном распределении энергии по степеням свободы.
- •38. Адиабатный процесс. Уравнение адиабаты идеального газа. Работа идеального газа при адиабатическом изменении его объема.
- •39. Политропные процессы. Уравнение политропы идеального газа. Работа идеального газа при политропическом процессе.
- •40. Обратимые и необратимые процессы.
- •41. Круговые термодинамические процессы и циклы. Тепловые и холодильные машины. Работа при круговом процессе. Первое начало термодинамики в применении к круговому процессу.
- •42. Второе начало термодинамики в формулировках Кельвина и Клаузиуса, их эквивалентность. Недостаточность первое начала термодинамики для однозначного описания процессов, происходящих в природе.
- •43. Цикл Карно и его кпд.
- •44. Теоремы Карно. Кпд цикла Карно – верхний предел кпд тепловых машин.
- •45. Равенство Клаузиуса. Энтропия. Свойства энтропии. Математическое выражение второго начала термодинамики для обратимых процессов. Постоянство энтропии при обратимых процессах в замкнутой системе.
- •46. Основное уравнение термодинамики для обратимых процессов. Энтропия идеального газа.
- •48. Свободная энергия системы.
- •51. Уравнение Клапейрона-Клаузиуса (дифференциальное).
- •52. Уравнение Ван-дер-Ваальса – Уравнение состояния неидеальных газов. Опытное определение констант уравнения Ван-дер-Ваальса.
- •54. Внутренняя энергия газа Ван-дер-Ваальса. Адиабатическое расширения газа ВдВ в пустоту.
- •55. Эффект Джоуля-Томсона. Общая термодинамическая теория дифференциального эффекта Джоуля-Томсона.
- •56. Эффект Джоуля-Томсона в газе Ван-дер-Ваальса.
- •57. Сжижение газов. Получение низких и сверхнизких температур. Метод магнитного охлаждения.
- •58. Среднее число столкновений и средняя длина свободного пробега молекул. Эффективный диаметр газовых молекул. Понятие об эффективном сечении процесса столкновения частиц.
- •59. Общее уравнение явлений переноса. Явления переноса. Общее уравнение явлений переноса в газах.
- •60. Теплопроводность. Уравнение теплопроводности. Основной закон теплопроводности – закон Фурье. Вычисление и экспериментальное определение коэффициента теплопроводности.
- •61. Внутреннее трение (вязкость) газов. Основной закон вязкости – закон Ньютона. Вычисление (и экспериментальное определение) коэффициента вязкости.
- •62. Диффузия. Основной закон диффузии – закон Фика. Вычисление коэффициента самодиффузии газов.
- •63. Некоторые свойства разреженных газов. Физические явления в сильно разреженных газах. Определение вакуума. Течение и равновесие газов в условиях вакуума. Молекулярное течение. Тепловая эффузия.
- •64. Теплопроводность и вязкое трение в ультраразреженных газах.
- •65. Общие свойства жидкостей.
- •66. Молекулярное давление и поверхностное натяжение жидкостей.
- •67. Явления на границе жидкости и твердого тела.
- •68. Избыточное давление под искривленной поверхностью жидкости. Формула Лапласа.
- •69. Капиллярные явления.
- •70. Давление насыщенного пара над искривленной поверхностью жидкости.
- •72. Кипение. Перегрев жидкостей.
- •74. Кристаллические решетки. Решетки Браве. Элементы симметрии решетки. Классификация решеток Браве по кристаллографическим системам.
- •77. Плавление, кристаллизация и возгонка (сублимация) твердых тел.
- •78. Теплоемкость твердых тел. Классическая теория и ее недостатки.
- •79. Фазовая диаграмма кристалл-жидкость-газ. Тройная точка.
- •80. Фазовые переходы первого и второго рода. Фазовая диаграмма гелия.
74. Кристаллические решетки. Решетки Браве. Элементы симметрии решетки. Классификация решеток Браве по кристаллографическим системам.
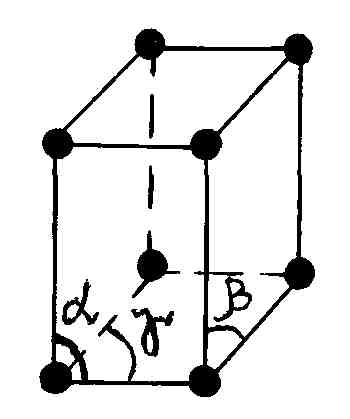
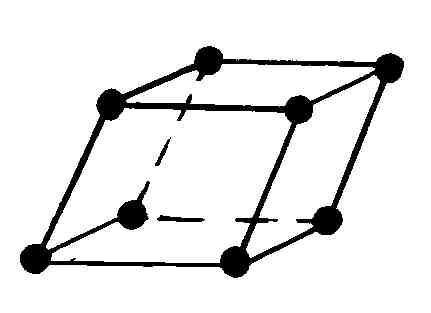
Упорядоченное расположение молекул в объеме кристалла можно получить, если рассматривать следующую сумму из трех векторов
 (6.4.1)
(6.4.1)
исходящих из точки, где расположена некоторая молекула (атом) кристалла, и расположенных под углами α, β, γ друг к другу, как показано на рис. 87.
Р и с. 87
Величины n1,
n2,
n3
в векторной сумме (6.4.1) – целые числа,
включая нуль. Если в конце вектора
 помещать
молекулу при всевозможных значениях
n1,
n2,
n3,
то таким образом мы получим так называемую
кристаллическую решетку. Элементарная
ячейка этой кристаллической решетки
представляется параллелепипедом,
построенным на трех векторах
помещать
молекулу при всевозможных значениях
n1,
n2,
n3,
то таким образом мы получим так называемую
кристаллическую решетку. Элементарная
ячейка этой кристаллической решетки
представляется параллелепипедом,
построенным на трех векторах
 (на рис. 87 она выделена). Весь кристалл
можно представить как смещение
элементарных ячеек вдоль трех направлений
(на рис. 87 она выделена). Весь кристалл
можно представить как смещение
элементарных ячеек вдоль трех направлений
 .
Модули этих векторов называют постоянными
кристаллической решетки.
.
Модули этих векторов называют постоянными
кристаллической решетки.
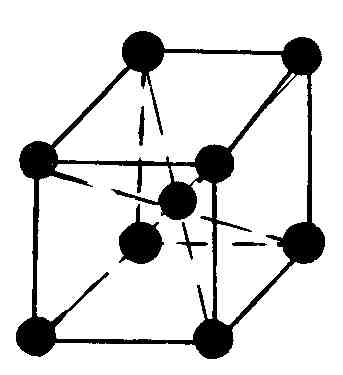
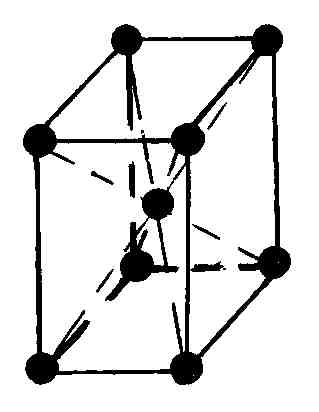
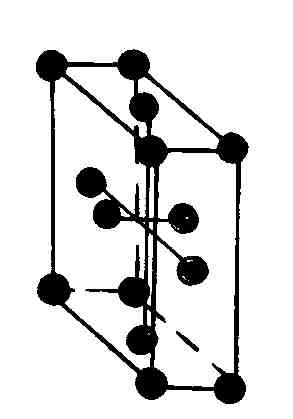
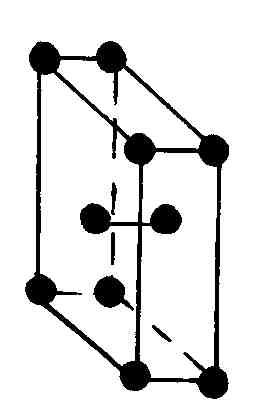
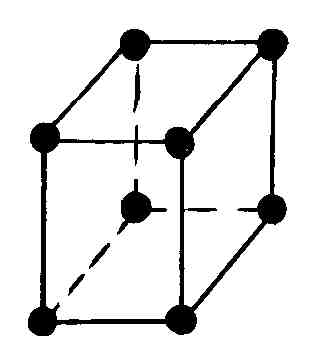
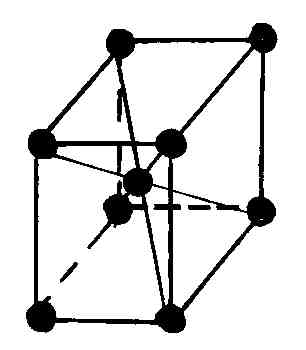
Многие реальные кристаллы представляются совокупностью нескольких кристаллических решеток, сдвинутых относительно друг друга (их называют подрешетками). Если в таких кристаллах выделить элементарную ячейку одной из подрешеток, то молекулы могут оказаться не только в вершинах ячейки, но и в центре ее граней и в центре ее диагональных плоскостей. В первом случае ячейки называются гранецентрированными или базоцентрированными, во втором – объемоцентрированными.
Как доказал А. Браве, существует всего четырнадцать трехмерных пространственных решеток (решеток Браве), подразделяющихся на семь систем (сингоний), в соответствии с семью различными типами элементарных ячеек (табл. 6.4.1).
Наиболее симметричной решеткой Браве является кубическая: симметрия куба сохраняется, если кроме частиц в вершинах кубов частицы будут находиться в их центрах или в центрах всех их граней (табл. 6.4.1).
Таблица 6.4.1
Кристаллические системы и решетки Браве
Кристалли- ческая система (сингония) |
Ячейка, ее ребра и углы |
Решетки Браве |
|||
Простые (примитивные) |
Сложные |
||||
объемноцен-трированные |
гранецент-рированные |
базоцентри- рованные |
|||
Кубическая |
куб a = b= c α = β = γ = = 90˚ |
|
|
|
─ |
Тетраго- нальная |
Квадратная призма a = b ≠ c α = β = γ = = 90˚ |
|
|
─ |
─ |
Гексаго-нальная |
Прямая при зма.В основан.правильный ромб a = b ≠ c α = β = 90˚ γ=120˚ |
|
─ |
─ |
─ |
Тригональная (ромбоэд- рическая) |
Ромбоэдр a = b = c α = β= γ ≠ 90˚ |
|
─ |
─ |
─ |
Ромбиче-ская |
Прямуголь ный парал- лелепипед a ≠ b ≠ c α = β = γ = 90˚ |
|
|
|
|
Монклин- ная |
Прямая при зма. В основании правильный ромб a = b ≠ c α = = 90˚≠ ≠ β |
|
|
─ |
─ |
Триклин-ная |
Косоуголь- ный парал- лелепипед a ≠ b ≠ c α ≠ β ≠ γ |
|
─ |
─ |
─ |
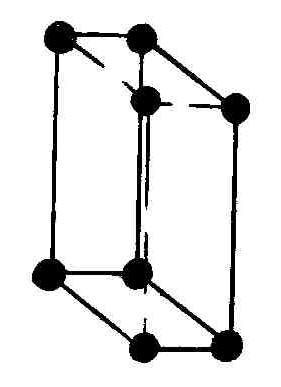
В тетрагональной системе простейшая решетка имеет вид правильной призмы с квадратом в основании. Вторая тетрагональная ячейка объемноцентрированная с дополнительным атомом в ее центре.
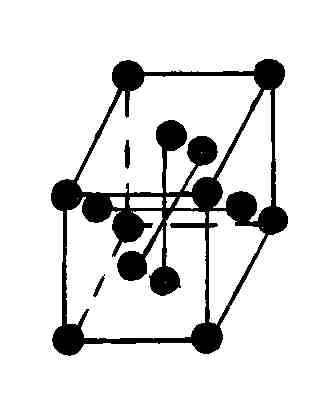
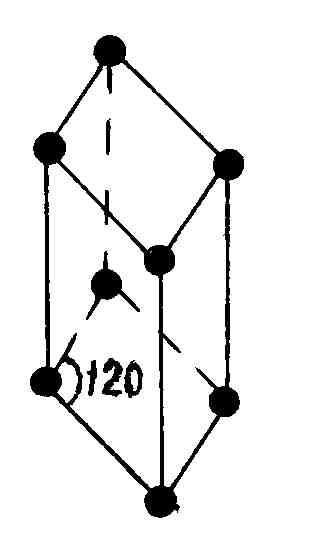
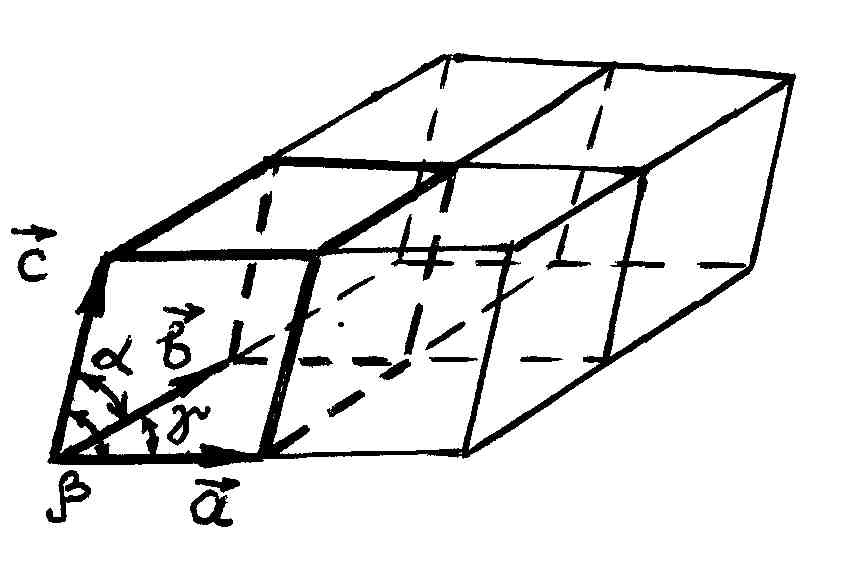
В гексагональной системе в качестве элементарной ячейки выбрана прямая призма, в основании которой лежит ромб с острым углом в 60°. Для того чтобы подчеркнуть пространственную симметрию гексагональных кристаллов, часто к элементарной ячейке добавляют еще две таких же ячейки, повернутые относительно друг друга на 120°, получая в результате правильную шестигранную призму (рис. 88). Из этих шестигранных призм строится гексагональный кристалл.
Р и с. 88
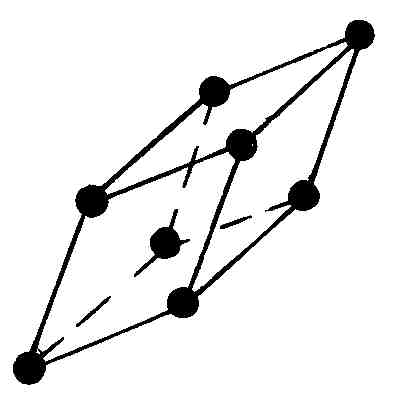
В тригональной (ромбоэдрической) системе параллелепипед Браве имеет форму ромбоэдра. Последний можно получить, равномерно растягивая куб в направлении его пространственной диагонали. Грани ромбоэдра – одинаковые ромбы.
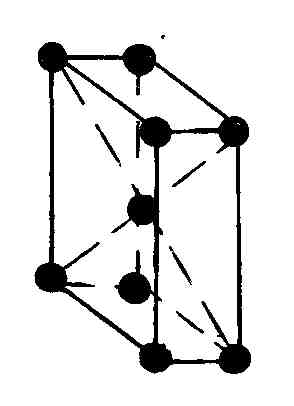
Элементарная решетка Браве в ромбической системе это прямоугольный параллелепипед. Имеется четыре типа ромбических решеток Браве: одна простая и три сложные; объемноцентрированная с дополнительным атомом в ее центре, гранецентрированная с четырьмя дополнительными атомами, расположенными в центре каждой из ее граней, и базоцентрированная с двумя дополнительными атомами в основаниях параллелепипеда.
В моноклинной системе элементарная ячейка это прямой параллелепипед, в основании которого расположен параллелограмм. В такой системе два типа решеток Браве: простая и объемноцентрированная.
Наконец, в триклинной системе параллелепипед Браве представляет собой косоугольный параллелепипед.
Среди кристаллических металлов в природе наибольшее распространение имеют гексогональная и кубическая структуры (табл. 6.4.2). При кристаллизации любых химических элементов природа отдает предпочтение объемноцентрированным и гранецентрированным структурам. Можно показать, что в этих структурах достигается минимум потенциальной энергии взаимодействия атомов, что обеспечивает их высокую устойчивость.
Таблица 6.4.2
Кристаллическая структура металлов
Li 3 |
Be 2 |
|
|
|
|
|
|
|
|
|
|
Na 3 |
Mg 2 |
|
|
|
|
|
|
|
|
|
|
K 3 |
Ca 1;2 |
Sc 1;2 |
Ti 2;3 |
V 3 |
Cr 3 |
Mn 1 |
Fe 1;3 |
Co 1;2 |
Ni 1;2 |
Cu 1 |
Zn 2 |
Rb 3 |
Sr 1 |
Y 2 |
Zr 2;3 |
Nb 3 |
Mo 2;3 |
Tc 2 |
Ru 1;2 |
Rh 1 |
Rd 1 |
Ag 1 |
Cd 2 |
Cs 3 |
Ba 3 |
La 1;2 |
Hf 2;3 |
Ta 3 |
W 3 |
Re 2 |
Os 1;2 |
Ir 1 |
Pt 1 |
Au 1 |
Hg 1 |
Обозначения: 1 – кубическая плотнейшая упаковка; 2 – гексаго-нальная плотнейшая упаковка; 3 – объемоцентрированная кубическая решетка.
Почти для всех металлов характерна максимально плотная упаковка частиц. Поясним два вида плотнейшей упаковки сферических частиц – кубическую и гексагональную.
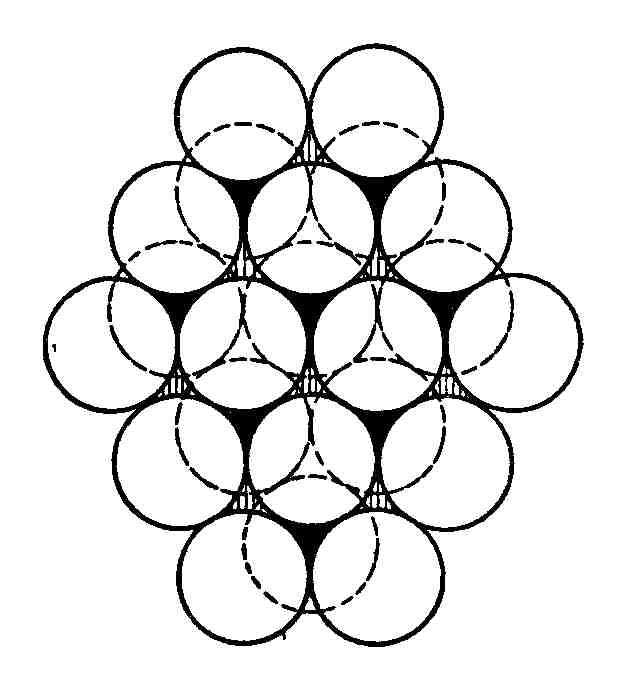
Пусть на плоскости уложен один слой шаров. Тогда наиболее плотным будет их расположение, показанное на рис. 89.
Р и с. 89
В этом случае каждый шар соприкасается с шестью другими. Для того чтобы расположить шары с двух сторон этого слоя с максимально плотной упаковкой, очевидно, шары верхнего и нижнего слоев следует располагать так, чтобы они попадали в лунки (углубления между шарами) среднего слоя. На рис. 89 изображены два слоя. Шары нижнего слоя показаны пунктиром, лунки, в которые они попадают, сделаны темными. Легко видеть, что в нижнем слое шаров половина лунок остается незанятыми шарами первого слоя (эти лунки заштрихованы). При уложении третьего слоя (сверху) возможны два варианта плотной упаковки: можно поместить шары или в темные лунки, или в заштрихованные; в первом случае мы получим гексагональную упаковку (рис. 90), во втором – кубическую гранецентрированную (рис. 91).
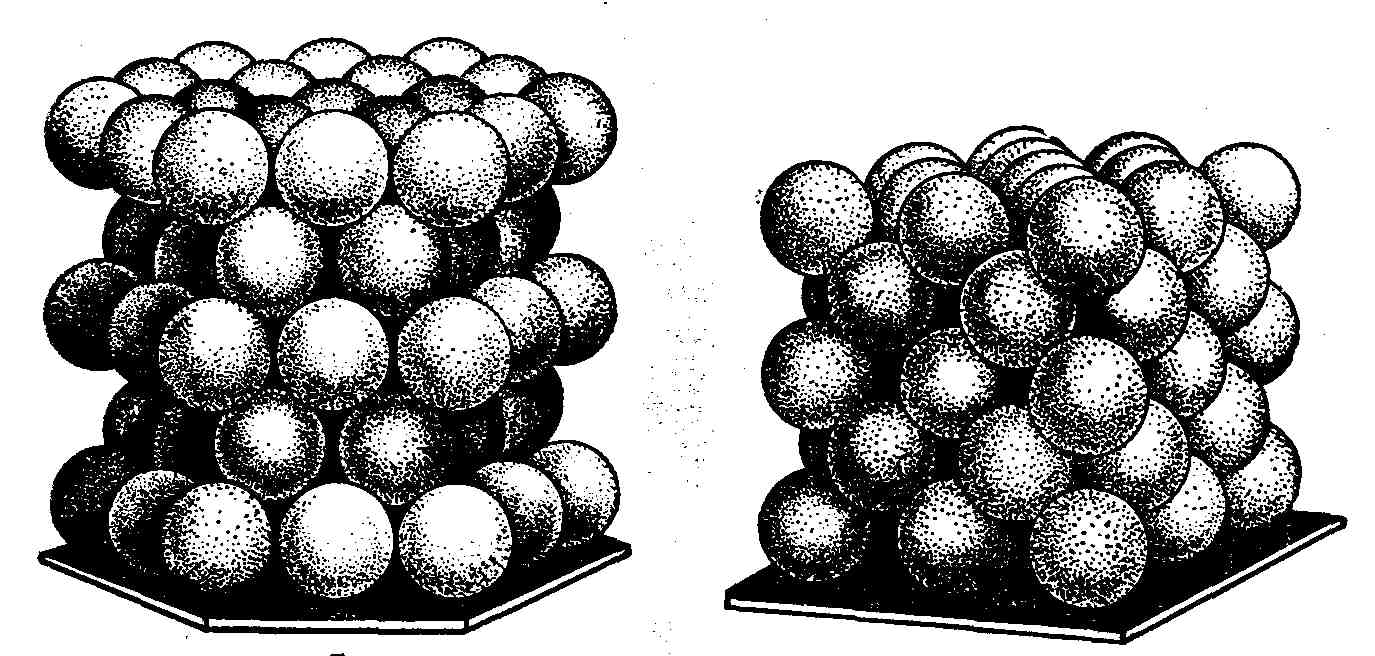
Р и с. 90 Р и с. 91 Р и с. 92
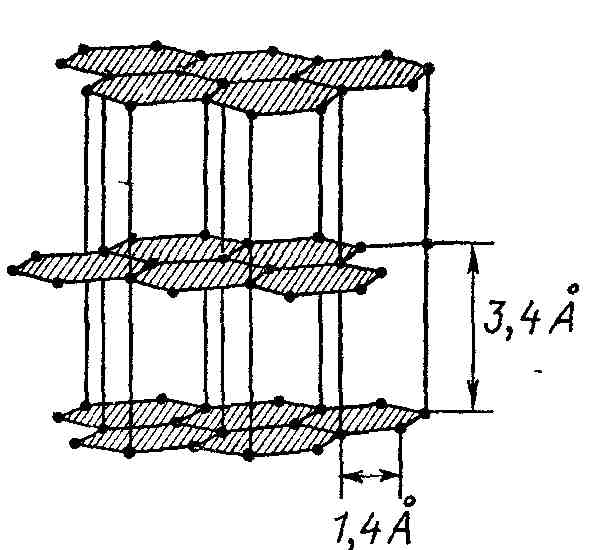
Примером кубической гранецентрированной плотнейшей упаковки ионов Na+ и Cl− является хлорид натрия (соль), структура которого представлена на рис. 83. Интересен пример гексагональной решетки, имеющей слоистый характер. Это широко распространенная модификация углерода – графит (рис. 92).
Решетка состоит из плоских параллельных слоев, в которых атомы образуют правильные шестиугольники. Расстояние между слоями в несколько раз больше, чем расстояние между атомами внутри слоя, что объясняет легкость, с которой отделяются слои графита друг от друга.
?75. Кристаллографические системы координат. Обозначение атомных плоскостей и направлений в кристаллах.
?76. Дефекты в кристаллах. Точечные дефекты. Дислокации.
Дефектами кристалла называют всякое нарушение трансляционной симметрии кристалла — идеальной периодичности кристаллической решётки. Различают несколько видов дефектов по размерности. А именно, бывают нульмерные (точечные), одномерные (линейные), двумерные (плоские) и трёхмерные (объемные) дефекты.