
- •2. Статистический и термодинамический методы изучения систем многих частиц.
- •3. Массы атомов и молекул. Количество вещества.
- •4. Молекулярные силы
- •5. Агрегатные состояния вещества. Характер теплового движения в этих состояниях. Особенности теплового движения в различных агрегатных состояниях вещества.
- •6. Понятие вероятности. (Частотное и априорное определения вероятности события.)
- •7. Некоторые теоремы теории вероятности. (Теоремы сложения и умножения вероятностей. Условие нормировки вероятностей.)
- •8. Интегральная функция распределения. Случайные величины. Интегральная функция распределения случайной величины и её свойства.
- •9. Плотность вероятности и её свойства.
- •10. Средние значения случайных величин. (математическое ожидание). Среднее по времени и среднее по ансамблю. Эргодическая гипотеза (без доказательства).
- •11. Дисперсия и её свойства.
- •15. Модель идеального газа.
- •16. Равновесные состояния и процессы. Термодинамическое равновесие. Равновесные процессы.
- •17. Распределения молекул газа по направлениям движения в состоянии равновесия.
- •18. Число ударов молекул о стенку сосуда (о единицу площади за единицу времени).
- •19. Основное уравнение молекулярно-кинетической теории газов для давления. (Давление иг с точки зрения мкт.)
- •20. Температура и ее измерение. Эмпирические (Опытные) температурные шкалы. Идеально-газовая шкала температур.
- •21. Температура – мера средней кинетической энергии поступательного движения молекул. Молекулярно-кинетический смысл температуры.
- •22. Уравнение Менделеева – Клапейрона (Уравнение состояния идеального газа). Законы идеального газа (следствия из этого уравнения).
- •25. Распределение Максвелла для относительных скоростей (формула).
- •26. Экспериментальная проверка распределения Максвелла (опыт Штерна, опыт Ламерта).
- •27. Распределение Больцмана. Идеальный газ во внешнем поле сил. Барометрическая формула.
- •28. Распределение Максвелла-Больцмана
- •29. Понятие об отрицательных абсолютных температурах.
- •30. Флуктуация. Зависимость относительной флуктуации от числа частиц в системе. Роль флуктуации в науке и технике.
- •31. Теорема о равномерном распределении энергии теплового движения по степеням свободы. Число степеней свободы молекул. Средняя энергия теплового движения молекул газа.
- •32. Броуновское движение. Проверка распределения Больцмана в опытах с броуновским движением. Формула Эйнштейна для описания броуновского движения.
- •33. Внутренняя энергия. Термодинамический метод. Выражение для внутренней энергии идеального газа.
- •34. Работа и количество тепла. Первый закон термодинамики. Работа при равновесном и неравновесном изменении объема системы.
- •35. Теплоемкость. Применение 1-го начала термодинамики для вычисления теплоемкости вещества.
- •36. Теплоемкость молекулярного водорода (экспериментальная). Классическая теория теплоемкостей идеального газа. Ограниченность теоремы о равномерном распределении энергии по степеням свободы.
- •38. Адиабатный процесс. Уравнение адиабаты идеального газа. Работа идеального газа при адиабатическом изменении его объема.
- •39. Политропные процессы. Уравнение политропы идеального газа. Работа идеального газа при политропическом процессе.
- •40. Обратимые и необратимые процессы.
- •41. Круговые термодинамические процессы и циклы. Тепловые и холодильные машины. Работа при круговом процессе. Первое начало термодинамики в применении к круговому процессу.
- •42. Второе начало термодинамики в формулировках Кельвина и Клаузиуса, их эквивалентность. Недостаточность первое начала термодинамики для однозначного описания процессов, происходящих в природе.
- •43. Цикл Карно и его кпд.
- •44. Теоремы Карно. Кпд цикла Карно – верхний предел кпд тепловых машин.
- •45. Равенство Клаузиуса. Энтропия. Свойства энтропии. Математическое выражение второго начала термодинамики для обратимых процессов. Постоянство энтропии при обратимых процессах в замкнутой системе.
- •46. Основное уравнение термодинамики для обратимых процессов. Энтропия идеального газа.
- •48. Свободная энергия системы.
- •51. Уравнение Клапейрона-Клаузиуса (дифференциальное).
- •52. Уравнение Ван-дер-Ваальса – Уравнение состояния неидеальных газов. Опытное определение констант уравнения Ван-дер-Ваальса.
- •54. Внутренняя энергия газа Ван-дер-Ваальса. Адиабатическое расширения газа ВдВ в пустоту.
- •55. Эффект Джоуля-Томсона. Общая термодинамическая теория дифференциального эффекта Джоуля-Томсона.
- •56. Эффект Джоуля-Томсона в газе Ван-дер-Ваальса.
- •57. Сжижение газов. Получение низких и сверхнизких температур. Метод магнитного охлаждения.
- •58. Среднее число столкновений и средняя длина свободного пробега молекул. Эффективный диаметр газовых молекул. Понятие об эффективном сечении процесса столкновения частиц.
- •59. Общее уравнение явлений переноса. Явления переноса. Общее уравнение явлений переноса в газах.
- •60. Теплопроводность. Уравнение теплопроводности. Основной закон теплопроводности – закон Фурье. Вычисление и экспериментальное определение коэффициента теплопроводности.
- •61. Внутреннее трение (вязкость) газов. Основной закон вязкости – закон Ньютона. Вычисление (и экспериментальное определение) коэффициента вязкости.
- •62. Диффузия. Основной закон диффузии – закон Фика. Вычисление коэффициента самодиффузии газов.
- •63. Некоторые свойства разреженных газов. Физические явления в сильно разреженных газах. Определение вакуума. Течение и равновесие газов в условиях вакуума. Молекулярное течение. Тепловая эффузия.
- •64. Теплопроводность и вязкое трение в ультраразреженных газах.
- •65. Общие свойства жидкостей.
- •66. Молекулярное давление и поверхностное натяжение жидкостей.
- •67. Явления на границе жидкости и твердого тела.
- •68. Избыточное давление под искривленной поверхностью жидкости. Формула Лапласа.
- •69. Капиллярные явления.
- •70. Давление насыщенного пара над искривленной поверхностью жидкости.
- •72. Кипение. Перегрев жидкостей.
- •74. Кристаллические решетки. Решетки Браве. Элементы симметрии решетки. Классификация решеток Браве по кристаллографическим системам.
- •77. Плавление, кристаллизация и возгонка (сублимация) твердых тел.
- •78. Теплоемкость твердых тел. Классическая теория и ее недостатки.
- •79. Фазовая диаграмма кристалл-жидкость-газ. Тройная точка.
- •80. Фазовые переходы первого и второго рода. Фазовая диаграмма гелия.
69. Капиллярные явления.
Поместим цилиндрическую трубку малого сечения (капилляр) одним концом в жидкость, налитую в широкий сосуд (рис. 76).
Если жидкость частично смачивает капилляр, то ее поверхность в капилляре будет вогнутой сферической формы (рис. 76, а). При этом жидкость в капилляре поднимется на некоторую высоту h. Это можно объяснить тем, что давление на плоской поверхности жидкости, равное сумме атмосферного давления p0 и молекулярного давления pМ больше, чем давление p0+pМ–2s/R на вогнутой поверхности мениска на величину давления Лапласа. Вследствие этой разности давлений жидкость в капилляре поднимется до такого уровня h, при котором гидростатическое давление столба жидкости rgh уравновесится давлением Лапласа pЛ=2s/R, где R – радиус сферы мениска, т. е.
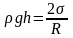 .
.
Откуда
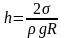 . (5.5.1)
. (5.5.1)
Как видно из рис. 76 радиус кривизны мениска R связан с радиусом капилляра r равенством R = r/cosq, где q – краевой угол. Учтя это, перепишем (5.5.1) в виде
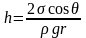 . (5.5.2)
. (5.5.2)
Если жидкость полностью смачивает твердое тело капилляра (к примеру, вода - чистое стекло), то q = 0 и
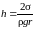 . (5.5.3)
. (5.5.3)
В этом случае сферическая поверхность мениска вписана во внутреннюю поверхность цилиндрического капилляра (R = r).
Если же жидкость частично не смачивает капилляр (рис.76, б), то давление на плоской поверхности жидкости, равное p0 + pМ, будет меньше, чем давление p0 +pМ=2s /R на выпуклой поверхности мениска, в результате чего жидкость в капилляре опустится на величину h, определяемую формулой (5.5.2). При этом h < 0, так как при частичном несмачивании краевой угол p/2 £ q £ p и cosq <0.
70. Давление насыщенного пара над искривленной поверхностью жидкости.
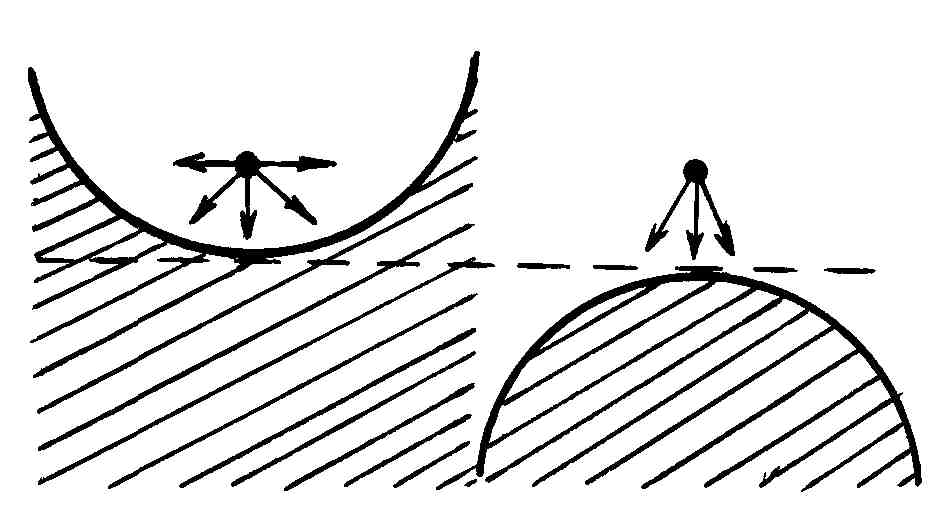
Предположим, что в закрытом сосуде имеется насыщенный пар и жидкость, в которую погружены два капилляра, один смачиваемый, другой – несмачиваемый этой жидкостью (рис. 77).
Давление насыщенного пара уменьшается с высотой по барометриче-
ской формуле (1.13.20) и на высоте h будет равно
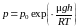 , (5.6.1)
, (5.6.1)
где p0 – давление пара на плоской поверхности жидкости, h – высота жидкости в капилляре.
Р и с. 77
Легко видеть, что
при обычных температурах величина
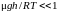 .
Поэтому экспоненту можно разложить в
ряд по степеням этой величины:
.
Поэтому экспоненту можно разложить в
ряд по степеням этой величины: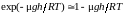 .
В результате выражение (5.6.1) примет вид:
.
В результате выражение (5.6.1) примет вид:
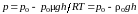 , (5.6.2)
, (5.6.2)
где ρ0 – плотность насыщенного пара. Подставляя в формулу (5.6.2) выражение (5.5.1), получим величину давления пара над вогнутой поверхностью мениска (h > 0):
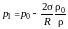 , (5.6.3)
, (5.6.3)
где ρ
– плотность
жидкости. Следовательно, давление р1
пара над вогнутой поверхностью жидкости
меньше давления пара над плоской на
величину
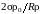 ,
зависящую от радиуса R
кривизны этой поверхности.
,
зависящую от радиуса R
кривизны этой поверхности.
Если жидкость частично не смачивает капилляр (h < 0), то давление р2 пара над выпуклой поверхностью мениска будет больше давления пара над плоской:
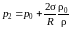 . (5.6.4)
. (5.6.4)
Существенно отметить, что разность давлений насыщенных паров над плоской и кривой поверхностью жидкости определяется только радиусом кривизны R и параметрами (σ, ρ) жидкости и пара (ρ0) и не зависит от силы тяжести (g) и высоты h, на которой расположена кривая поверхность жидкости.
Физически различие между давлением насыщенного пара над плоской и искривленной поверхностями жидкости объясняется следующим образом. Равновесие между насыщенным паром и жидкостью означает равенство между числами молекул, ежесекундно переходящих из жидкости в пар и обратно. При вогнутой поверхности переходу молекул из жидкости в пар препятствует большое число соседних (находящихся поблизости) молекул, чем при плоской поверхности (рис. 77), поэтому при данной температуре ежесекундное число молекул, которые могли бы преодолеть притяжение к поверхностному слою жидкости и перейти в пар, меньше, чем в случае плоской поверхности, что создает меньшее давление паров над вогнутой поверхностью. Наоборот, переход молекул с выпуклой поверхности жидкости в пар потребует меньшей затраты энергии, так как число близко расположенных молекул, препятствующих этому переходу, будет меньше, чем при плоской поверхности (рис. 77); следовательно, число молекул, ежесекундно покидающих выпуклую поверхность, будет при одинаковой температуре больше, чем аналогичное число молекул для плоской поверхности. В результате над выпуклой поверхностью жидкости будет создано большее давление паров, чем над плоской.
Предположим, что над плоской поверхностью жидкости в атмосфере ее пара находятся капельки этой жидкости. Так как пар является насыщенным для плоской поверхности, т. е. имеет давление р0, то для капелек с выпуклой поверхностью этот же пар оказывается ненасыщенным, так как, согласно (5.6.4), выпуклые поверхности находятся в равновесии с паром большего давления, чем плоские поверхности. Вследствие этого капельки жидкости испаряются. Если же в атмосфере имеются капельки различных радиусов, и если давление паров в атмосфере больше, чем давление пара над каплей самого малого размера, то этот пар будет пересыщенным для всех капелек, и на них начнется процесс конденсации, который приведет к увеличению размеров всех капелек, и они, в конце концов, выпадут в виде дождя.
?71. Испарение жидкостей. Скрытая теплота испарения. Температурная зависимость давления насыщенных паров. Уравнение Клапейрона-Клаузиуса.
