
- •2. Статистический и термодинамический методы изучения систем многих частиц.
- •3. Массы атомов и молекул. Количество вещества.
- •4. Молекулярные силы
- •5. Агрегатные состояния вещества. Характер теплового движения в этих состояниях. Особенности теплового движения в различных агрегатных состояниях вещества.
- •6. Понятие вероятности. (Частотное и априорное определения вероятности события.)
- •7. Некоторые теоремы теории вероятности. (Теоремы сложения и умножения вероятностей. Условие нормировки вероятностей.)
- •8. Интегральная функция распределения. Случайные величины. Интегральная функция распределения случайной величины и её свойства.
- •9. Плотность вероятности и её свойства.
- •10. Средние значения случайных величин. (математическое ожидание). Среднее по времени и среднее по ансамблю. Эргодическая гипотеза (без доказательства).
- •11. Дисперсия и её свойства.
- •15. Модель идеального газа.
- •16. Равновесные состояния и процессы. Термодинамическое равновесие. Равновесные процессы.
- •17. Распределения молекул газа по направлениям движения в состоянии равновесия.
- •18. Число ударов молекул о стенку сосуда (о единицу площади за единицу времени).
- •19. Основное уравнение молекулярно-кинетической теории газов для давления. (Давление иг с точки зрения мкт.)
- •20. Температура и ее измерение. Эмпирические (Опытные) температурные шкалы. Идеально-газовая шкала температур.
- •21. Температура – мера средней кинетической энергии поступательного движения молекул. Молекулярно-кинетический смысл температуры.
- •22. Уравнение Менделеева – Клапейрона (Уравнение состояния идеального газа). Законы идеального газа (следствия из этого уравнения).
- •25. Распределение Максвелла для относительных скоростей (формула).
- •26. Экспериментальная проверка распределения Максвелла (опыт Штерна, опыт Ламерта).
- •27. Распределение Больцмана. Идеальный газ во внешнем поле сил. Барометрическая формула.
- •28. Распределение Максвелла-Больцмана
- •29. Понятие об отрицательных абсолютных температурах.
- •30. Флуктуация. Зависимость относительной флуктуации от числа частиц в системе. Роль флуктуации в науке и технике.
- •31. Теорема о равномерном распределении энергии теплового движения по степеням свободы. Число степеней свободы молекул. Средняя энергия теплового движения молекул газа.
- •32. Броуновское движение. Проверка распределения Больцмана в опытах с броуновским движением. Формула Эйнштейна для описания броуновского движения.
- •33. Внутренняя энергия. Термодинамический метод. Выражение для внутренней энергии идеального газа.
- •34. Работа и количество тепла. Первый закон термодинамики. Работа при равновесном и неравновесном изменении объема системы.
- •35. Теплоемкость. Применение 1-го начала термодинамики для вычисления теплоемкости вещества.
- •36. Теплоемкость молекулярного водорода (экспериментальная). Классическая теория теплоемкостей идеального газа. Ограниченность теоремы о равномерном распределении энергии по степеням свободы.
- •38. Адиабатный процесс. Уравнение адиабаты идеального газа. Работа идеального газа при адиабатическом изменении его объема.
- •39. Политропные процессы. Уравнение политропы идеального газа. Работа идеального газа при политропическом процессе.
- •40. Обратимые и необратимые процессы.
- •41. Круговые термодинамические процессы и циклы. Тепловые и холодильные машины. Работа при круговом процессе. Первое начало термодинамики в применении к круговому процессу.
- •42. Второе начало термодинамики в формулировках Кельвина и Клаузиуса, их эквивалентность. Недостаточность первое начала термодинамики для однозначного описания процессов, происходящих в природе.
- •43. Цикл Карно и его кпд.
- •44. Теоремы Карно. Кпд цикла Карно – верхний предел кпд тепловых машин.
- •45. Равенство Клаузиуса. Энтропия. Свойства энтропии. Математическое выражение второго начала термодинамики для обратимых процессов. Постоянство энтропии при обратимых процессах в замкнутой системе.
- •46. Основное уравнение термодинамики для обратимых процессов. Энтропия идеального газа.
- •48. Свободная энергия системы.
- •51. Уравнение Клапейрона-Клаузиуса (дифференциальное).
- •52. Уравнение Ван-дер-Ваальса – Уравнение состояния неидеальных газов. Опытное определение констант уравнения Ван-дер-Ваальса.
- •54. Внутренняя энергия газа Ван-дер-Ваальса. Адиабатическое расширения газа ВдВ в пустоту.
- •55. Эффект Джоуля-Томсона. Общая термодинамическая теория дифференциального эффекта Джоуля-Томсона.
- •56. Эффект Джоуля-Томсона в газе Ван-дер-Ваальса.
- •57. Сжижение газов. Получение низких и сверхнизких температур. Метод магнитного охлаждения.
- •58. Среднее число столкновений и средняя длина свободного пробега молекул. Эффективный диаметр газовых молекул. Понятие об эффективном сечении процесса столкновения частиц.
- •59. Общее уравнение явлений переноса. Явления переноса. Общее уравнение явлений переноса в газах.
- •60. Теплопроводность. Уравнение теплопроводности. Основной закон теплопроводности – закон Фурье. Вычисление и экспериментальное определение коэффициента теплопроводности.
- •61. Внутреннее трение (вязкость) газов. Основной закон вязкости – закон Ньютона. Вычисление (и экспериментальное определение) коэффициента вязкости.
- •62. Диффузия. Основной закон диффузии – закон Фика. Вычисление коэффициента самодиффузии газов.
- •63. Некоторые свойства разреженных газов. Физические явления в сильно разреженных газах. Определение вакуума. Течение и равновесие газов в условиях вакуума. Молекулярное течение. Тепловая эффузия.
- •64. Теплопроводность и вязкое трение в ультраразреженных газах.
- •65. Общие свойства жидкостей.
- •66. Молекулярное давление и поверхностное натяжение жидкостей.
- •67. Явления на границе жидкости и твердого тела.
- •68. Избыточное давление под искривленной поверхностью жидкости. Формула Лапласа.
- •69. Капиллярные явления.
- •70. Давление насыщенного пара над искривленной поверхностью жидкости.
- •72. Кипение. Перегрев жидкостей.
- •74. Кристаллические решетки. Решетки Браве. Элементы симметрии решетки. Классификация решеток Браве по кристаллографическим системам.
- •77. Плавление, кристаллизация и возгонка (сублимация) твердых тел.
- •78. Теплоемкость твердых тел. Классическая теория и ее недостатки.
- •79. Фазовая диаграмма кристалл-жидкость-газ. Тройная точка.
- •80. Фазовые переходы первого и второго рода. Фазовая диаграмма гелия.
66. Молекулярное давление и поверхностное натяжение жидкостей.
На каждую молекулу,
находящуюся внутри жидкости, действуют
силы притяжения со стороны всех молекул,
расположенных в сфере действия этих
сил. Как мы знаем, эта сфера имеет радиус
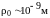 .
Равнодействующая
.
Равнодействующая
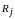 всех
сил
всех
сил
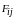 ,
действующих на
,
действующих на
 -ю
молекулу со стороны молекул, находящихся
в сфере радиуса
-ю
молекулу со стороны молекул, находящихся
в сфере радиуса
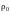 ,
близка к нулю, т. е.
,
близка к нулю, т. е.
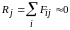 .
.
Эта сила может быть точно равна нулю, если окружающие молекулы будут расположены совершенно симметрично и на равных расстояниях от нее. Однако случайное изменение в относительном расположении соседних молекул вследствие их теплового движения делает эту сумму отличной от нуля. Таким образом, каждая молекула жидкости все время движется под влиянием равнодействующей , меняющейся со временем по величине и направлению. Эта равнодействующая направлена в ту сторону, где случайно оказалась большая концентрация молекул и ближе расположены соседние молекулы. Следовательно, молекулярные силы взаимного притяжения способствуют концентрации молекул.
Пусть теперь j-я молекула расположена настолько близко к поверхности, что сфера молекулярного действия сил пересекает поверхность жидкости (рис.69, а).
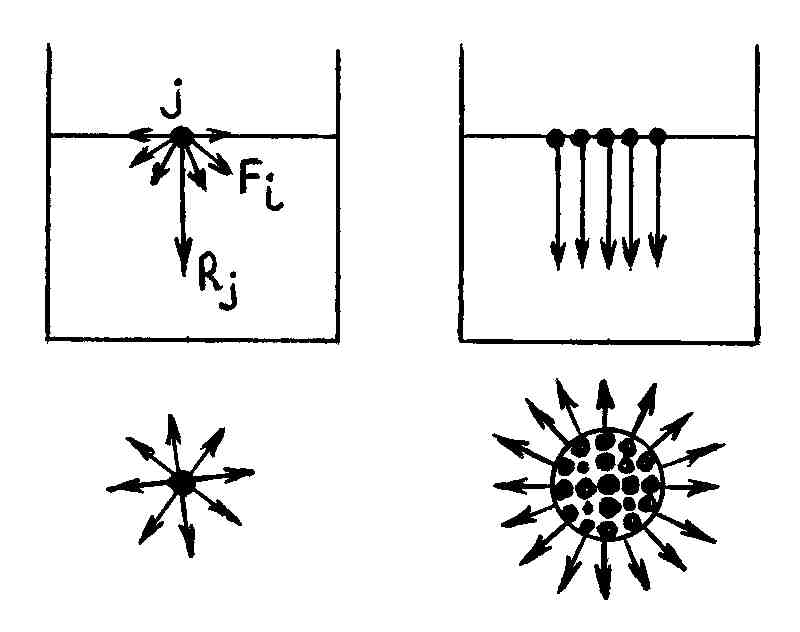
а б
Р и с. 69
В этом случае часть
сферы молекулярного действия сил,
лежащая выше поверхности жидкости,
содержит значительно меньше молекул
жидкости (пар), чем расположенная ниже
этой поверхности (жидкость), вследствие
чего рассматриваемая молекула
притягивается вниз сильнее, чем вверх.
Поэтому равнодействующая
 не равна нулю и направлена вследствие
симметрии перпендикулярно к поверхности
внутрь жидкости.
не равна нулю и направлена вследствие
симметрии перпендикулярно к поверхности
внутрь жидкости.
Выберем на поверхности жидкости некоторую площадку S, к примеру, в форме круга (рис. 69, б). Молекулы, охваченные этой площадкой, связаны между собой внутренними силами, и поэтому этот мономолекулярный диск можно рассматривать как некоторое тело (пленку). Пусть на этой площадке вмещается N молекул. Тогда величина суммарной силы, действующей на все молекулы диска, будет равна
 , (5.2.1)
, (5.2.1)
так как все силы
 параллельны и имеют одну и ту же величину.
Если величину (5.2.1) разделить на площадь
S
диска, то получим так называемое
молекулярное давление pΜ,
с которым поверхностный слой действует
на остальную массу жидкости:
параллельны и имеют одну и ту же величину.
Если величину (5.2.1) разделить на площадь
S
диска, то получим так называемое
молекулярное давление pΜ,
с которым поверхностный слой действует
на остальную массу жидкости:
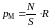 . (5.2.2)
. (5.2.2)
Каждый из сомножителей
в последнем выражении пропорционален
плотности жидкости
 (
(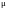 − молярная масса, VΜ
− молярный объем). Поэтому
− молярная масса, VΜ
− молярный объем). Поэтому
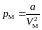 , (5.2.3)
, (5.2.3)
где а − коэффициент пропорциональности, характеризующий силы притяжения между молекулами жидкости. Молекулярное давление в жидкости (5.2.3) имеет такой же вид, как для газов (3.4.8). Различие состоит только в величине молярного объема VΜ, который для жидкостей значительно меньше, чем для газов. Оценим молекулярное давление для воды. Из опыта известно, что а = 0,555 Дж∙м3/моль2, VΜ = 18∙10–3/103 = 18∙10–6 м3/моль. Подставляя эти величины в (5.2.3), получим
pΜ
= 1,7∙109
Па
 17000 атм.
17000 атм.
Из приведенного примера ясно, почему жидкости трудно сжимаемы. Они всегда находятся в сжатом состоянии под очень высоким молекулярным давлением, и поэтому, заметное уменьшение объема требует приложения такого давления, которое было бы одного порядка с давлением молекулярным. Отметим, что непосредственно молекулярное давление измерить нельзя, так как любой манометр измеряет внешнее и гидростатическое давление.
Взаимное притяжение молекул вызывает не только давление поверхностного слоя на остальную жидкость, но стремится также уменьшить поверхность жидкости, т. е. вызывает силу, направленную вдоль поверхности, подобную той, какую мы имеем в натянутой резиновой пленке. Эта сила поверхностного натяжения тесно связана с молекулярным давлением. Действительно, каждая молекула, находящаяся на поверхности, испытывает силу, направленную внутрь жидкости, поэтому каждая такая молекула стремится уйти с поверхности и погрузиться в жидкость. Поэтому равновесие жидкости будет достигнуто при таком расположении молекул, когда на поверхности находится наименьшее возможное число молекул, т. е. поверхность жидкости имеет наименьшую величину. Это стремление жидкости иметь наименьшую поверхность создает сходство поверхности жидкости с упругой пленкой, которая, будучи растянута, стремится стянуться и уменьшить свою поверхность. Из всех тел данного объема наименьшую поверхность имеет шар. Поэтому мелкие капли жидкости принимают форму шара.
Рассмотрим снова
мономолекулярный диск площадью S,
расположенный на поверхности жидкости.
На j-ю
молекулу, лежащую внутри этого диска,
действует веер сил
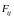 ,
лежащих в плоскости, касательной к
поверхности жидкости. Для всех молекул,
расположенных внутри площадки S,
все эти силы Fij
взаимно уравновешиваются. Только у
молекул, расположенных вдоль окружности,
ограничивающей площадку S,
силы
,
направленные наружу, останутся
неуравновешенными и дадут результирующую
силу
,
лежащих в плоскости, касательной к
поверхности жидкости. Для всех молекул,
расположенных внутри площадки S,
все эти силы Fij
взаимно уравновешиваются. Только у
молекул, расположенных вдоль окружности,
ограничивающей площадку S,
силы
,
направленные наружу, останутся
неуравновешенными и дадут результирующую
силу
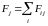 ,
перпендикулярную к окружности и
касательную к поверхности жидкости.
Сумма модулей этих внешних сил
,
перпендикулярную к окружности и
касательную к поверхности жидкости.
Сумма модулей этих внешних сил
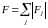 ,
растягивающих пленку, охватываемую
площадкой S,
называют силой поверхностного натяжения.
Сила поверхностного натяжения, которая
приходится на единицу длины окружности,
ограничивающую площадку S,
называется коэффициентом поверхностного
натяжения данной жидкости:
,
растягивающих пленку, охватываемую
площадкой S,
называют силой поверхностного натяжения.
Сила поверхностного натяжения, которая
приходится на единицу длины окружности,
ограничивающую площадку S,
называется коэффициентом поверхностного
натяжения данной жидкости:
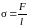 . (5.2.4)
. (5.2.4)
Единицей измерения коэффициента поверхностного натяжения в системе СИ является Н/м.
Коэффициент поверхностного натяжения зависит от температуры. С повышением температуры он уменьшается, так как при нагревании жидкости увеличивается среднее расстояние между молекулами, что приводит к уменьшению сил притяжения, а, значит, и результирующей силы F, действующей на единицу длины контура, расположенного на поверхности жидкости.
Используя формулу (5.2.4), можно ввести в рассмотрение другое, эквивалентное, определение коэффициента поверхностного натяжения. Для этого рассмотрим следующий опыт. Проволочный каркас заполним жидкой пленкой (рис. 70).
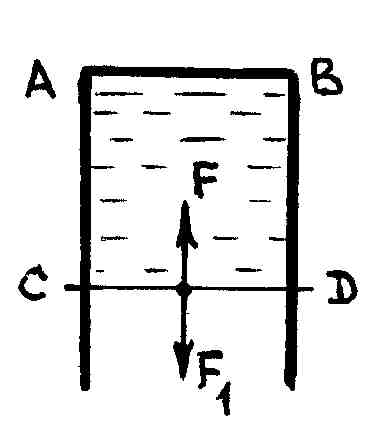
Р и с. 70
Перемычка СD
каркаса может свободно скользить вдоль
направляющих проволок АС
и BD.
Пленка состоит из нижней и верхней
поверхностей, между которыми находится
жидкость. На перемычку длины
 действует
сила поверхностного натяжения
действует
сила поверхностного натяжения
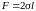 .
Чтобы перемычка находилась в равновесии,
к ней нужно приложить силу
.
Чтобы перемычка находилась в равновесии,
к ней нужно приложить силу
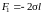 .
Под действием силы F1
(точнее F1
+ dF1)
перемычка переместится на расстояние
dx.
При этом площадь поверхности пленки
увеличится на величину
.
Под действием силы F1
(точнее F1
+ dF1)
перемычка переместится на расстояние
dx.
При этом площадь поверхности пленки
увеличится на величину
 .
Увеличение поверхности пленки происходит
за счет перехода молекул из глубины
жидкости в поверхностный слой. При этом
переходе молекулы расходуют свою
кинетическую энергию на работу против
силы R,
направленной вовнутрь жидкости, уменьшая
тем самым температуру жидкости. Чтобы
температура жидкости не изменялась,
перемычку необходимо перемещать
бесконечно медленно. Тогда жидкость
будет успевать получать теплоту от
внешней среды и сохранять температуру
постоянной.
.
Увеличение поверхности пленки происходит
за счет перехода молекул из глубины
жидкости в поверхностный слой. При этом
переходе молекулы расходуют свою
кинетическую энергию на работу против
силы R,
направленной вовнутрь жидкости, уменьшая
тем самым температуру жидкости. Чтобы
температура жидкости не изменялась,
перемычку необходимо перемещать
бесконечно медленно. Тогда жидкость
будет успевать получать теплоту от
внешней среды и сохранять температуру
постоянной.
Таким образом,
работа силы F1
+ dF1
при изотермическом увеличении площади
поверхности жидкости на
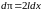 равна:
равна:
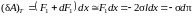 .
.
Откуда
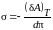 . (5.2.5)
. (5.2.5)
Из последнего
выражения следует, что коэффициент
поверхностного натяжения численно
равен работе при изотермическом
увеличении поверхности жидкости на
единицу площади. Коэффициент
 является положительной величиной.
Поэтому, если сила поверхностного
натяжения жидкости совершает положительную
работу
является положительной величиной.
Поэтому, если сила поверхностного
натяжения жидкости совершает положительную
работу
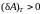 ,
то перемычка движется так, что площадь
поверхности жидкости уменьшается, т.
е.
,
то перемычка движется так, что площадь
поверхности жидкости уменьшается, т.
е.
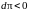 ,
и тогда на основании (5.2.5)
,
и тогда на основании (5.2.5)
 .
Наоборот, если внешняя сила F1
совершает работу, то
.
Наоборот, если внешняя сила F1
совершает работу, то
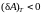 ,
и перемычка движется так, что площадь
поверхности жидкости увеличивается,
т. е.
,
и перемычка движется так, что площадь
поверхности жидкости увеличивается,
т. е.
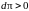 и снова
.
и снова
.
Мы знаем, что работа при обратимом изотермическом процессе равны убыли свободной энергии, т. е.
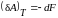 . (5.2.6)
. (5.2.6)
Поэтому выражение (5.2.5) может быть записано в виде:
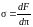 , (5.2.7)
, (5.2.7)
т. е. коэффициент поверхностного натяжения численно равен изменению свободной энергии жидкости при увеличении площади ее поверхности на единицу. Выражение (5.2.7) является наиболее общим определением коэффициента поверхностного натяжения. Из этого выражения следует, что можно также измерять в системе СИ в Дж/м2 = Н/м.
Так как коэффициент поверхностного натяжения является функцией температуры жидкости и не зависит от ее площади, то из соотношения (5.2.7) следует, что
 , (5.2.8)
, (5.2.8)
т. е. свободная поверхностная энергия жидкости равна произведению на площадь поверхности S.
Учитывая, что
работа, совершаемая пленкой,
 ,
основное уравнение термодинамики для
обратимых процессов можно записать в
виде
,
основное уравнение термодинамики для
обратимых процессов можно записать в
виде
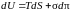 . (5.2.9)
. (5.2.9)
Так как по определению
свободная энергия
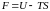 ,
то
,
то
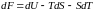 . (5.2.10)
. (5.2.10)
Из соотношений (5.2.9–5.2.10) находим
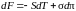 . (5.2.11)
. (5.2.11)
Отсюда
 . (5.2.12)
. (5.2.12)
Подставим в формулу
для внутренней энергии
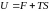 выражения (5.2.8) и (5.2.12). В результате
получим
выражения (5.2.8) и (5.2.12). В результате
получим
 . (5.2.13)
. (5.2.13)
Так как коэффициент
поверхностного натяжения является
убывающей функцией температуры, то
 ,
и, как видно из (5.2.13), внутренняя энергия
жидкости больше ее свободной поверхностной
энергии, т. е.
,
и, как видно из (5.2.13), внутренняя энергия
жидкости больше ее свободной поверхностной
энергии, т. е.
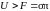 .
Это ясно, например, из того, что при
приближении к критической точке, когда
различие между жидкостью и газом
исчезает, поверхностное натяжение
должно стать равным нулю.
.
Это ясно, например, из того, что при
приближении к критической точке, когда
различие между жидкостью и газом
исчезает, поверхностное натяжение
должно стать равным нулю.
Теплота, получаемая жидкостью от внешней среды при образовании единицы площади поверхности пленки,
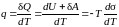 . (5.2.14)
. (5.2.14)
Из последнего
выражения видно, что
 ,
так как
.
Нетрудно видеть, что величина q
меньше приращения энергии поверхности,
так как
,
так как
.
Нетрудно видеть, что величина q
меньше приращения энергии поверхности,
так как
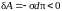 (работа
отрицательна потому, что при увеличении
площади поверхности работу совершает
не пленка, а внешняя сила).
(работа
отрицательна потому, что при увеличении
площади поверхности работу совершает
не пленка, а внешняя сила).
