
- •2. Статистический и термодинамический методы изучения систем многих частиц.
- •3. Массы атомов и молекул. Количество вещества.
- •4. Молекулярные силы
- •5. Агрегатные состояния вещества. Характер теплового движения в этих состояниях. Особенности теплового движения в различных агрегатных состояниях вещества.
- •6. Понятие вероятности. (Частотное и априорное определения вероятности события.)
- •7. Некоторые теоремы теории вероятности. (Теоремы сложения и умножения вероятностей. Условие нормировки вероятностей.)
- •8. Интегральная функция распределения. Случайные величины. Интегральная функция распределения случайной величины и её свойства.
- •9. Плотность вероятности и её свойства.
- •10. Средние значения случайных величин. (математическое ожидание). Среднее по времени и среднее по ансамблю. Эргодическая гипотеза (без доказательства).
- •11. Дисперсия и её свойства.
- •15. Модель идеального газа.
- •16. Равновесные состояния и процессы. Термодинамическое равновесие. Равновесные процессы.
- •17. Распределения молекул газа по направлениям движения в состоянии равновесия.
- •18. Число ударов молекул о стенку сосуда (о единицу площади за единицу времени).
- •19. Основное уравнение молекулярно-кинетической теории газов для давления. (Давление иг с точки зрения мкт.)
- •20. Температура и ее измерение. Эмпирические (Опытные) температурные шкалы. Идеально-газовая шкала температур.
- •21. Температура – мера средней кинетической энергии поступательного движения молекул. Молекулярно-кинетический смысл температуры.
- •22. Уравнение Менделеева – Клапейрона (Уравнение состояния идеального газа). Законы идеального газа (следствия из этого уравнения).
- •25. Распределение Максвелла для относительных скоростей (формула).
- •26. Экспериментальная проверка распределения Максвелла (опыт Штерна, опыт Ламерта).
- •27. Распределение Больцмана. Идеальный газ во внешнем поле сил. Барометрическая формула.
- •28. Распределение Максвелла-Больцмана
- •29. Понятие об отрицательных абсолютных температурах.
- •30. Флуктуация. Зависимость относительной флуктуации от числа частиц в системе. Роль флуктуации в науке и технике.
- •31. Теорема о равномерном распределении энергии теплового движения по степеням свободы. Число степеней свободы молекул. Средняя энергия теплового движения молекул газа.
- •32. Броуновское движение. Проверка распределения Больцмана в опытах с броуновским движением. Формула Эйнштейна для описания броуновского движения.
- •33. Внутренняя энергия. Термодинамический метод. Выражение для внутренней энергии идеального газа.
- •34. Работа и количество тепла. Первый закон термодинамики. Работа при равновесном и неравновесном изменении объема системы.
- •35. Теплоемкость. Применение 1-го начала термодинамики для вычисления теплоемкости вещества.
- •36. Теплоемкость молекулярного водорода (экспериментальная). Классическая теория теплоемкостей идеального газа. Ограниченность теоремы о равномерном распределении энергии по степеням свободы.
- •38. Адиабатный процесс. Уравнение адиабаты идеального газа. Работа идеального газа при адиабатическом изменении его объема.
- •39. Политропные процессы. Уравнение политропы идеального газа. Работа идеального газа при политропическом процессе.
- •40. Обратимые и необратимые процессы.
- •41. Круговые термодинамические процессы и циклы. Тепловые и холодильные машины. Работа при круговом процессе. Первое начало термодинамики в применении к круговому процессу.
- •42. Второе начало термодинамики в формулировках Кельвина и Клаузиуса, их эквивалентность. Недостаточность первое начала термодинамики для однозначного описания процессов, происходящих в природе.
- •43. Цикл Карно и его кпд.
- •44. Теоремы Карно. Кпд цикла Карно – верхний предел кпд тепловых машин.
- •45. Равенство Клаузиуса. Энтропия. Свойства энтропии. Математическое выражение второго начала термодинамики для обратимых процессов. Постоянство энтропии при обратимых процессах в замкнутой системе.
- •46. Основное уравнение термодинамики для обратимых процессов. Энтропия идеального газа.
- •48. Свободная энергия системы.
- •51. Уравнение Клапейрона-Клаузиуса (дифференциальное).
- •52. Уравнение Ван-дер-Ваальса – Уравнение состояния неидеальных газов. Опытное определение констант уравнения Ван-дер-Ваальса.
- •54. Внутренняя энергия газа Ван-дер-Ваальса. Адиабатическое расширения газа ВдВ в пустоту.
- •55. Эффект Джоуля-Томсона. Общая термодинамическая теория дифференциального эффекта Джоуля-Томсона.
- •56. Эффект Джоуля-Томсона в газе Ван-дер-Ваальса.
- •57. Сжижение газов. Получение низких и сверхнизких температур. Метод магнитного охлаждения.
- •58. Среднее число столкновений и средняя длина свободного пробега молекул. Эффективный диаметр газовых молекул. Понятие об эффективном сечении процесса столкновения частиц.
- •59. Общее уравнение явлений переноса. Явления переноса. Общее уравнение явлений переноса в газах.
- •60. Теплопроводность. Уравнение теплопроводности. Основной закон теплопроводности – закон Фурье. Вычисление и экспериментальное определение коэффициента теплопроводности.
- •61. Внутреннее трение (вязкость) газов. Основной закон вязкости – закон Ньютона. Вычисление (и экспериментальное определение) коэффициента вязкости.
- •62. Диффузия. Основной закон диффузии – закон Фика. Вычисление коэффициента самодиффузии газов.
- •63. Некоторые свойства разреженных газов. Физические явления в сильно разреженных газах. Определение вакуума. Течение и равновесие газов в условиях вакуума. Молекулярное течение. Тепловая эффузия.
- •64. Теплопроводность и вязкое трение в ультраразреженных газах.
- •65. Общие свойства жидкостей.
- •66. Молекулярное давление и поверхностное натяжение жидкостей.
- •67. Явления на границе жидкости и твердого тела.
- •68. Избыточное давление под искривленной поверхностью жидкости. Формула Лапласа.
- •69. Капиллярные явления.
- •70. Давление насыщенного пара над искривленной поверхностью жидкости.
- •72. Кипение. Перегрев жидкостей.
- •74. Кристаллические решетки. Решетки Браве. Элементы симметрии решетки. Классификация решеток Браве по кристаллографическим системам.
- •77. Плавление, кристаллизация и возгонка (сублимация) твердых тел.
- •78. Теплоемкость твердых тел. Классическая теория и ее недостатки.
- •79. Фазовая диаграмма кристалл-жидкость-газ. Тройная точка.
- •80. Фазовые переходы первого и второго рода. Фазовая диаграмма гелия.
54. Внутренняя энергия газа Ван-дер-Ваальса. Адиабатическое расширения газа ВдВ в пустоту.
Выражение для
внутренней энергии газа Ван-дер-Ваальса
найдем следующим образом. При расширении
газа его молекулы совершают работу
против сил молекулярного давления
 .
Эта работа равна
.
Эта работа равна
 , (3.7.1)
, (3.7.1)
где
 – объем одного моля газа.
– объем одного моля газа.
С другой стороны, эта работа идет на увеличение потенциальной энергии взаимодействия молекул:
 . (3.7.2)
. (3.7.2)
Из выражений (3.7.1–3.7.2) следует, что
 . (3.7.3)
. (3.7.3)
Интегрирование этого выражения дает
 . (3.7.4)
. (3.7.4)
Внутренняя энергия
 газа состоит из кинетической
газа состоит из кинетической
 и потенциальной
и потенциальной
 энергий, т. е.
энергий, т. е.
 . (3.7.5)
. (3.7.5)
Подставим выражение (3.7.4) в (3.7.5).
 . (3.7.6)
. (3.7.6)
При
 газ становится идеальным и его внутренняя
энергия равна кинетической энергии
движения молекул
газ становится идеальным и его внутренняя
энергия равна кинетической энергии
движения молекул
 и равна, как мы знаем,
и равна, как мы знаем,
 ,
т. е.
,
т. е.
 . (3.7.7)
. (3.7.7)
С другой стороны, при из (3.7.6)
 . (3.7.8)
. (3.7.8)
Из сравнения
выражений (3.7.7) и (3.7.8), заключаем, что
 .
Таким образом, из (3.7.6)
.
Таким образом, из (3.7.6)
 . (3.7.9)
. (3.7.9)
Внутренняя энергия
молей газа

 , (3.7.10)
, (3.7.10)
где V – объем, занимаемый молями газа.
Рассмотрим изотермическое расширение газа Ван-дер-Ваальса от объема до объема . Изменение внутренней энергии на основании (3.7.10)
 . (3.7.11)
. (3.7.11)
Поэтому, согласно первому закону термодинамики, работа, произведенная газом Ван-дер-Ваальса при изотермическом расширении,

т. е. меньше количества полученного тепла, тогда как для идеального газа эта работа в точности равнялась количеству приобретенного тепла. Это объясняется тем, что в реальном газе при его изотермическом расширении часть тепла идет на работу против сил притяжения между молекулами, т. е. на увеличение потенциальной энергии молекул.
Рассмотрим далее
адиабатное расширение газа Ван-дер-Ваальса
без совершения внешней работы (так
называемое расширение газа в вакуум).
В этом случае в первом законе термодинамики
необходимо положить
 и
и
 Тогда и
Тогда и
 т. е.
т. е.
 ,
,
и, учитывая выражение (3.7.10), последнее равенство можем переписать в виде:
 .
.
Откуда находим
 ,
,
так
как
 .
Таким образом, газ Ван-дер-Ваальса при
расширении в вакуум охлаждается.
Охлаждение происходит потому, что в
этом процессе часть кинетической энергии
газа тратится на работу против сил
притяжения между молекулами.
.
Таким образом, газ Ван-дер-Ваальса при
расширении в вакуум охлаждается.
Охлаждение происходит потому, что в
этом процессе часть кинетической энергии
газа тратится на работу против сил
притяжения между молекулами.
55. Эффект Джоуля-Томсона. Общая термодинамическая теория дифференциального эффекта Джоуля-Томсона.
Опыт показывает, если на пути потока газа или жидкости, текущего по некоторому каналу, встречается препятствие, сужение поперечного сечения потока, а затем сечение потока увеличивается, то давление протекающего газа (жидкости) за препятствием всегда оказывается меньшим, чем перед ним. Так, например, этот эффект наблюдается при движении воды через не полностью открытый водопроводный кран или при движении воздуха через не полностью открытую задвижку в дымоходах печей.
Эффект падения давления потока рабочего вещества в процессе протекания через препятствие (сужение) в канале называют дросселированием, а само препятствие – дросселем. Физически падение давления за местным сопротивлением обусловлено рассеянием энергии потока, расходуемой на преодоление этого местного сопротивления(трение).
Эффектом Джоуля – Томсона называется изменение температуры газа при его адиабатном протекании через дроссель.В опытах Джоуля – Томсона использовалась адиабатно изолированная цилиндрическая трубка с находящимся внутри нее дросселем, изготовленным из ваты или очесов шелка, плотно сбитых в пробку (рис. 54).
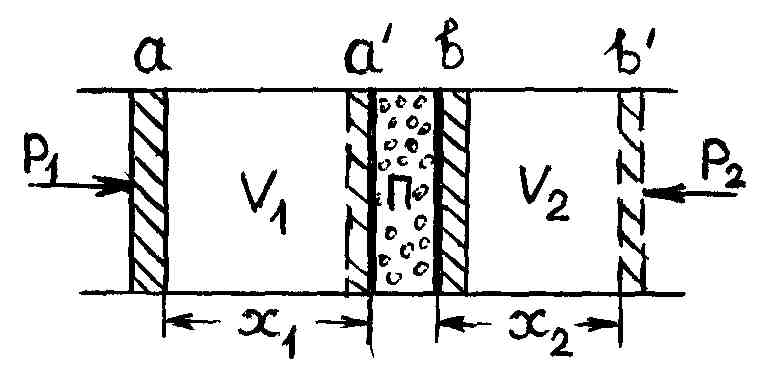
Р и с. 54
Вследствие трения, при медленном проталкивании газа через пробку, газ и пробка обмениваются между собой теплотой. Из-за наличия препятствия скорость потока до и после препятствия пренебрежимо мала, что позволяет пренебречь кинетической энергией потока.
В результате опытов Джоуль и Томсон установили, что все газы, за исключением водорода (и гелия, как выяснилось впоследствии), при дросселировании охлаждаются.
На современных
установках, использующих эффект Джоуля
– Томсона, это охлаждение достигает
весьма больших значений. Например, при
адиабатном дросселировании водяного
пара от давления 300 атм. и температуры
450 С
до давления 1 атм. температура пара
уменьшается до 180
С
(т. е. на 270
С!),
а воздух, испытывая дроссель-эффект от
комнатной температуры и давления 200
атм. до давления 1 атм., охлаждается
примерно на 40
С.
С
до давления 1 атм. температура пара
уменьшается до 180
С
(т. е. на 270
С!),
а воздух, испытывая дроссель-эффект от
комнатной температуры и давления 200
атм. до давления 1 атм., охлаждается
примерно на 40
С.
Рассмотрим термодинамическую теорию эффекта Джоуля – Томсона.
Пусть в исходном
состоянии газ занимает объем
между поршнем a
и дросселем
 ,
второй поршень
вплотную примыкает к дросселю (рис. 54).
Станем медленно вдвигать поршень a,
сохраняя давления
,
второй поршень
вплотную примыкает к дросселю (рис. 54).
Станем медленно вдвигать поршень a,
сохраняя давления
 и
и
 ,
действующие на поршни, постоянными.
(Технически постоянство давлений
обеспечивается компрессорами). Газ,
просачиваясь с малой скоростью через
дроссель, заполнит объем
и будет находиться под давлением
.
,
действующие на поршни, постоянными.
(Технически постоянство давлений
обеспечивается компрессорами). Газ,
просачиваясь с малой скоростью через
дроссель, заполнит объем
и будет находиться под давлением
.
Работа, совершаемая над газом слева от дросселя,
 . (3.8.1)
. (3.8.1)
Совершаемая же газом работа против внешнего давления равна
 . (3.8.2)
. (3.8.2)
Общая работа, произведенная в процессе Джоуля – Томсона,
 . (3.8.3)
. (3.8.3)
По первому закону термодинамики, работа, производимая в адиабатном процессе, равна убыли внутренней энергии, т. е.
 .
.
Откуда

или
 . (3.8.4)
. (3.8.4)
Таким образом, в результате адиабатного дросселирования значение энтальпии рабочего вещества до дросселя и после него одинаковы.
Для характеристики
степени охлаждения рабочего вещества
при адиабатном дросселировании вводится
так называемый коэффициент Джоуля –
Томсона


 . (3.8.5)
. (3.8.5)
Зная коэффициент , можно найти изменение температуры в дроссель-эффекте при конечном значении разности давлений:
 , (3.8.6)
, (3.8.6)
где и – температуры рабочего вещества перед дросселем и за ним соответственно.
Так как в
дроссель-эффекте всегда
 ,
то коэффициент Джоуля – Томсона
,
то коэффициент Джоуля – Томсона
 ,
если
,
если
 и газ, таким образом, охлаждается
(положительный эффект Джоуля – Томсона);
если же
и газ, таким образом, охлаждается
(положительный эффект Джоуля – Томсона);
если же
 (газ нагревается), то
(газ нагревается), то
 (отрицательный эффект Джоуля – Томсона).
(отрицательный эффект Джоуля – Томсона).
Применив первый
и второй законы термодинамики, найдем
общее выражение для коэффициента Джоуля
– Томсона. Так как в дроссель-эффекте
 ,
то
,
то
 . (3.8.7)
. (3.8.7)
Будем рассматривать энтальпию как функцию температуры и давления. Поэтому
 . (3.8.8)
. (3.8.8)
Из последнего равенства находим
 . (3.8.9)
. (3.8.9)
Используя соотношение (2.7.14), равенство (3.6.9) можем записать в виде (расчеты будем вести для одного моля вещества):
 . (3.8.10)
. (3.8.10)
Производную
 найдем через легко измеримые величины.
Для этого в основном уравнении
термодинамики (2.14.3) выразим внутреннюю
энергию через энтальпию:
найдем через легко измеримые величины.
Для этого в основном уравнении
термодинамики (2.14.3) выразим внутреннюю
энергию через энтальпию:
 . (3.8.11)
. (3.8.11)
Подставив выражение (3.8.8) в (3.8.11), будем иметь
 . (3.8.12)
. (3.8.12)
Рассматривая
энтропию как функцию температуры
и давления
 ,
можем записать:
,
можем записать:
 . (3.8.13)
. (3.8.13)
Сравнивая выражения (3.8.12) и (3.8.13), получаем
 ;
;
 .
.
Первое из этих
равенств продифференцируем по
при постоянном
,
а второе – по
при постоянном
и учитывая, что
 получим
получим

Откуда находим
 . (3.8.14)
. (3.8.14)
Подставим выражение (3.8.14) в (3.8.10). В результате получим общее термодинамическое соотношение для коэффициента Джоуля – Томсона:
 . (3.8.15)
. (3.8.15)
Если газ идеальный,
то

 и
и
 ,
т. е. в процессе адиабатного дросселирования
температура идеального газа не изменяется.
Это один из характерных признаков
идеального газа.
,
т. е. в процессе адиабатного дросселирования
температура идеального газа не изменяется.
Это один из характерных признаков
идеального газа.
