
- •2. Статистический и термодинамический методы изучения систем многих частиц.
- •3. Массы атомов и молекул. Количество вещества.
- •4. Молекулярные силы
- •5. Агрегатные состояния вещества. Характер теплового движения в этих состояниях. Особенности теплового движения в различных агрегатных состояниях вещества.
- •6. Понятие вероятности. (Частотное и априорное определения вероятности события.)
- •7. Некоторые теоремы теории вероятности. (Теоремы сложения и умножения вероятностей. Условие нормировки вероятностей.)
- •8. Интегральная функция распределения. Случайные величины. Интегральная функция распределения случайной величины и её свойства.
- •9. Плотность вероятности и её свойства.
- •10. Средние значения случайных величин. (математическое ожидание). Среднее по времени и среднее по ансамблю. Эргодическая гипотеза (без доказательства).
- •11. Дисперсия и её свойства.
- •15. Модель идеального газа.
- •16. Равновесные состояния и процессы. Термодинамическое равновесие. Равновесные процессы.
- •17. Распределения молекул газа по направлениям движения в состоянии равновесия.
- •18. Число ударов молекул о стенку сосуда (о единицу площади за единицу времени).
- •19. Основное уравнение молекулярно-кинетической теории газов для давления. (Давление иг с точки зрения мкт.)
- •20. Температура и ее измерение. Эмпирические (Опытные) температурные шкалы. Идеально-газовая шкала температур.
- •21. Температура – мера средней кинетической энергии поступательного движения молекул. Молекулярно-кинетический смысл температуры.
- •22. Уравнение Менделеева – Клапейрона (Уравнение состояния идеального газа). Законы идеального газа (следствия из этого уравнения).
- •25. Распределение Максвелла для относительных скоростей (формула).
- •26. Экспериментальная проверка распределения Максвелла (опыт Штерна, опыт Ламерта).
- •27. Распределение Больцмана. Идеальный газ во внешнем поле сил. Барометрическая формула.
- •28. Распределение Максвелла-Больцмана
- •29. Понятие об отрицательных абсолютных температурах.
- •30. Флуктуация. Зависимость относительной флуктуации от числа частиц в системе. Роль флуктуации в науке и технике.
- •31. Теорема о равномерном распределении энергии теплового движения по степеням свободы. Число степеней свободы молекул. Средняя энергия теплового движения молекул газа.
- •32. Броуновское движение. Проверка распределения Больцмана в опытах с броуновским движением. Формула Эйнштейна для описания броуновского движения.
- •33. Внутренняя энергия. Термодинамический метод. Выражение для внутренней энергии идеального газа.
- •34. Работа и количество тепла. Первый закон термодинамики. Работа при равновесном и неравновесном изменении объема системы.
- •35. Теплоемкость. Применение 1-го начала термодинамики для вычисления теплоемкости вещества.
- •36. Теплоемкость молекулярного водорода (экспериментальная). Классическая теория теплоемкостей идеального газа. Ограниченность теоремы о равномерном распределении энергии по степеням свободы.
- •38. Адиабатный процесс. Уравнение адиабаты идеального газа. Работа идеального газа при адиабатическом изменении его объема.
- •39. Политропные процессы. Уравнение политропы идеального газа. Работа идеального газа при политропическом процессе.
- •40. Обратимые и необратимые процессы.
- •41. Круговые термодинамические процессы и циклы. Тепловые и холодильные машины. Работа при круговом процессе. Первое начало термодинамики в применении к круговому процессу.
- •42. Второе начало термодинамики в формулировках Кельвина и Клаузиуса, их эквивалентность. Недостаточность первое начала термодинамики для однозначного описания процессов, происходящих в природе.
- •43. Цикл Карно и его кпд.
- •44. Теоремы Карно. Кпд цикла Карно – верхний предел кпд тепловых машин.
- •45. Равенство Клаузиуса. Энтропия. Свойства энтропии. Математическое выражение второго начала термодинамики для обратимых процессов. Постоянство энтропии при обратимых процессах в замкнутой системе.
- •46. Основное уравнение термодинамики для обратимых процессов. Энтропия идеального газа.
- •48. Свободная энергия системы.
- •51. Уравнение Клапейрона-Клаузиуса (дифференциальное).
- •52. Уравнение Ван-дер-Ваальса – Уравнение состояния неидеальных газов. Опытное определение констант уравнения Ван-дер-Ваальса.
- •54. Внутренняя энергия газа Ван-дер-Ваальса. Адиабатическое расширения газа ВдВ в пустоту.
- •55. Эффект Джоуля-Томсона. Общая термодинамическая теория дифференциального эффекта Джоуля-Томсона.
- •56. Эффект Джоуля-Томсона в газе Ван-дер-Ваальса.
- •57. Сжижение газов. Получение низких и сверхнизких температур. Метод магнитного охлаждения.
- •58. Среднее число столкновений и средняя длина свободного пробега молекул. Эффективный диаметр газовых молекул. Понятие об эффективном сечении процесса столкновения частиц.
- •59. Общее уравнение явлений переноса. Явления переноса. Общее уравнение явлений переноса в газах.
- •60. Теплопроводность. Уравнение теплопроводности. Основной закон теплопроводности – закон Фурье. Вычисление и экспериментальное определение коэффициента теплопроводности.
- •61. Внутреннее трение (вязкость) газов. Основной закон вязкости – закон Ньютона. Вычисление (и экспериментальное определение) коэффициента вязкости.
- •62. Диффузия. Основной закон диффузии – закон Фика. Вычисление коэффициента самодиффузии газов.
- •63. Некоторые свойства разреженных газов. Физические явления в сильно разреженных газах. Определение вакуума. Течение и равновесие газов в условиях вакуума. Молекулярное течение. Тепловая эффузия.
- •64. Теплопроводность и вязкое трение в ультраразреженных газах.
- •65. Общие свойства жидкостей.
- •66. Молекулярное давление и поверхностное натяжение жидкостей.
- •67. Явления на границе жидкости и твердого тела.
- •68. Избыточное давление под искривленной поверхностью жидкости. Формула Лапласа.
- •69. Капиллярные явления.
- •70. Давление насыщенного пара над искривленной поверхностью жидкости.
- •72. Кипение. Перегрев жидкостей.
- •74. Кристаллические решетки. Решетки Браве. Элементы симметрии решетки. Классификация решеток Браве по кристаллографическим системам.
- •77. Плавление, кристаллизация и возгонка (сублимация) твердых тел.
- •78. Теплоемкость твердых тел. Классическая теория и ее недостатки.
- •79. Фазовая диаграмма кристалл-жидкость-газ. Тройная точка.
- •80. Фазовые переходы первого и второго рода. Фазовая диаграмма гелия.
5. Агрегатные состояния вещества. Характер теплового движения в этих состояниях. Особенности теплового движения в различных агрегатных состояниях вещества.
Одним из важнейших
параметров, характеризующих молекулу,
является минимальная потенциальная
энергия взаимодействия
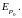 Силы притяжения, действующие между
молекулами стремятся сконденсировать
вещество, т. е. сблизить его молекулы до
расстояния r0,
когда их потенциальная энергия
взаимодействия минимальна и равна
Силы притяжения, действующие между
молекулами стремятся сконденсировать
вещество, т. е. сблизить его молекулы до
расстояния r0,
когда их потенциальная энергия
взаимодействия минимальна и равна
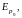 но
этому сближению препятствует хаотическое
тепловое движение молекул. Интенсивность
этого движения определяется средней
кинетической энергией молекулы,
которая имеет порядок kT,
где k
– постоянная Больцмана. Агрегатные
состояния вещества существенным образом
зависят от соотношения величин
но
этому сближению препятствует хаотическое
тепловое движение молекул. Интенсивность
этого движения определяется средней
кинетической энергией молекулы,
которая имеет порядок kT,
где k
– постоянная Больцмана. Агрегатные
состояния вещества существенным образом
зависят от соотношения величин
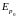 и
kT.
и
kT.
Предположим, что температура рассматриваемой системы молекул столь высока, что
kT >> В этом случае интенсивное хаотическое тепловое движение мешает силам притяжения соединить молекулы в агрегаты из нескольких частиц, сблизившихся до расстояния r0: при соударениях большая кинетическая энергия молекул будет легко разбивать эти агрегаты на составляющие молекулы и, таким образом, вероятность образования устойчивых агрегатов будет как угодно малой. В этих обстоятельствах рассматриваемые молекулы, очевидно, будут находиться в газообразном состоянии.
Если температура системы частиц очень низкая, т. е. kT << молекулам, действующими силами притяжения, тепловое движение не может помешать приблизиться друг к другу на расстояние близкое к r0 в определенном порядке. При этом система частиц будет находиться в твердом состоянии, а небольшая кинетическая энергия теплового движения вынудить молекулы совершать беспорядочные малые колебания около определенных положений равновесия (узлов кристаллической решетки).
Наконец, при температуре системы частиц, определяемой из приближенного равенства kT ≈ кинетическая энергия теплового движения молекул, величина которой примерно равна потенциальной энергии притяжения, не сможет переместить молекулу на расстояние, существенно превышающее r0. В этих условиях вещество будет находиться в жидком агрегатном состоянии.
Таким образом, вещество, в зависимости от своей температуры и величины присущей данному сорту составляющих его молекул, будет находиться в газообразном, твердом или жидком состоянии.
При нормальных условиях расстояние между молекулами в газе в десятки раз (см. пример 1.1) превышают их размеры; большую часть времени они движутся прямолинейно без взаимодействия и только значительно меньшую часть времени, когда находятся на близких расстояниях от других молекул, взаимодействуют с ними, меняя направление своего движения. Таким образом, в газообразном состоянии движение молекулы выглядит так, как схематично показано на рис.7, а.
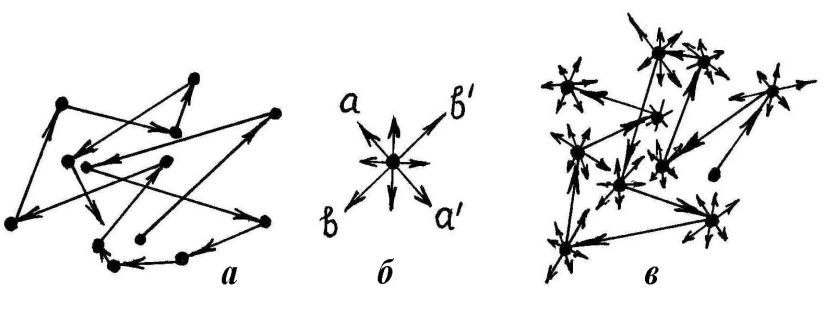
В твердом состоянии каждая молекула (атом) вещества находится в равновесном положении (узел кристаллической решетки), возле которого она совершает малые колебания, причем направление (к примеру, аа' на рис. 7, б) и амплитуда этих колебаний случайно изменяются (к примеру, на направление bb') через время, значительно большее периода этих колебаний; частоты колебаний молекул в общем случае неодинаковы. Колебания отдельной молекулы твердого тела в общих чертах представлена на рис. 7, б.
Молекулы твердого тела упакованы так плотно, что расстояние между ними примерно равно их диаметру, т.е. расстоянию r0 на рис. 3. Известно, что плотность жидкого состояния примерно на 10 % меньше плотности твердого, при прочих равных условиях. Поэтому расстояние между молекулами жидкого состояния несколько больше r0. Учитывая, что в жидком состоянии молекулы обладают еще и большей кинетической энергией теплового движения, следует ожидать, что, в отличие от твердого состояния, они могут, совершая колебательное движение, достаточно легко менять свое местоположение, перемещаясь на расстояние, существенно не превышающее диаметр молекулы. Траектория движения молекулы жидкости приблизительно выглядит так, как схематически показано на рис. 7, в. Таким образом, движение молекулы в жидкости сочетает в себе поступательное движение, как это имеет место в газе, с колебательным, что наблюдается в твердом теле.
Несмотря на неодинаковый характер движения молекул в различных агрегатных состояниях, общим является случайность, непредсказуемость этих движений. Средняя кинетическая энергия этих беспорядочных движений определяет тепловое состояние вещества, его температуру.
