
- •2. Статистический и термодинамический методы изучения систем многих частиц.
- •3. Массы атомов и молекул. Количество вещества.
- •4. Молекулярные силы
- •5. Агрегатные состояния вещества. Характер теплового движения в этих состояниях. Особенности теплового движения в различных агрегатных состояниях вещества.
- •6. Понятие вероятности. (Частотное и априорное определения вероятности события.)
- •7. Некоторые теоремы теории вероятности. (Теоремы сложения и умножения вероятностей. Условие нормировки вероятностей.)
- •8. Интегральная функция распределения. Случайные величины. Интегральная функция распределения случайной величины и её свойства.
- •9. Плотность вероятности и её свойства.
- •10. Средние значения случайных величин. (математическое ожидание). Среднее по времени и среднее по ансамблю. Эргодическая гипотеза (без доказательства).
- •11. Дисперсия и её свойства.
- •15. Модель идеального газа.
- •16. Равновесные состояния и процессы. Термодинамическое равновесие. Равновесные процессы.
- •17. Распределения молекул газа по направлениям движения в состоянии равновесия.
- •18. Число ударов молекул о стенку сосуда (о единицу площади за единицу времени).
- •19. Основное уравнение молекулярно-кинетической теории газов для давления. (Давление иг с точки зрения мкт.)
- •20. Температура и ее измерение. Эмпирические (Опытные) температурные шкалы. Идеально-газовая шкала температур.
- •21. Температура – мера средней кинетической энергии поступательного движения молекул. Молекулярно-кинетический смысл температуры.
- •22. Уравнение Менделеева – Клапейрона (Уравнение состояния идеального газа). Законы идеального газа (следствия из этого уравнения).
- •25. Распределение Максвелла для относительных скоростей (формула).
- •26. Экспериментальная проверка распределения Максвелла (опыт Штерна, опыт Ламерта).
- •27. Распределение Больцмана. Идеальный газ во внешнем поле сил. Барометрическая формула.
- •28. Распределение Максвелла-Больцмана
- •29. Понятие об отрицательных абсолютных температурах.
- •30. Флуктуация. Зависимость относительной флуктуации от числа частиц в системе. Роль флуктуации в науке и технике.
- •31. Теорема о равномерном распределении энергии теплового движения по степеням свободы. Число степеней свободы молекул. Средняя энергия теплового движения молекул газа.
- •32. Броуновское движение. Проверка распределения Больцмана в опытах с броуновским движением. Формула Эйнштейна для описания броуновского движения.
- •33. Внутренняя энергия. Термодинамический метод. Выражение для внутренней энергии идеального газа.
- •34. Работа и количество тепла. Первый закон термодинамики. Работа при равновесном и неравновесном изменении объема системы.
- •35. Теплоемкость. Применение 1-го начала термодинамики для вычисления теплоемкости вещества.
- •36. Теплоемкость молекулярного водорода (экспериментальная). Классическая теория теплоемкостей идеального газа. Ограниченность теоремы о равномерном распределении энергии по степеням свободы.
- •38. Адиабатный процесс. Уравнение адиабаты идеального газа. Работа идеального газа при адиабатическом изменении его объема.
- •39. Политропные процессы. Уравнение политропы идеального газа. Работа идеального газа при политропическом процессе.
- •40. Обратимые и необратимые процессы.
- •41. Круговые термодинамические процессы и циклы. Тепловые и холодильные машины. Работа при круговом процессе. Первое начало термодинамики в применении к круговому процессу.
- •42. Второе начало термодинамики в формулировках Кельвина и Клаузиуса, их эквивалентность. Недостаточность первое начала термодинамики для однозначного описания процессов, происходящих в природе.
- •43. Цикл Карно и его кпд.
- •44. Теоремы Карно. Кпд цикла Карно – верхний предел кпд тепловых машин.
- •45. Равенство Клаузиуса. Энтропия. Свойства энтропии. Математическое выражение второго начала термодинамики для обратимых процессов. Постоянство энтропии при обратимых процессах в замкнутой системе.
- •46. Основное уравнение термодинамики для обратимых процессов. Энтропия идеального газа.
- •48. Свободная энергия системы.
- •51. Уравнение Клапейрона-Клаузиуса (дифференциальное).
- •52. Уравнение Ван-дер-Ваальса – Уравнение состояния неидеальных газов. Опытное определение констант уравнения Ван-дер-Ваальса.
- •54. Внутренняя энергия газа Ван-дер-Ваальса. Адиабатическое расширения газа ВдВ в пустоту.
- •55. Эффект Джоуля-Томсона. Общая термодинамическая теория дифференциального эффекта Джоуля-Томсона.
- •56. Эффект Джоуля-Томсона в газе Ван-дер-Ваальса.
- •57. Сжижение газов. Получение низких и сверхнизких температур. Метод магнитного охлаждения.
- •58. Среднее число столкновений и средняя длина свободного пробега молекул. Эффективный диаметр газовых молекул. Понятие об эффективном сечении процесса столкновения частиц.
- •59. Общее уравнение явлений переноса. Явления переноса. Общее уравнение явлений переноса в газах.
- •60. Теплопроводность. Уравнение теплопроводности. Основной закон теплопроводности – закон Фурье. Вычисление и экспериментальное определение коэффициента теплопроводности.
- •61. Внутреннее трение (вязкость) газов. Основной закон вязкости – закон Ньютона. Вычисление (и экспериментальное определение) коэффициента вязкости.
- •62. Диффузия. Основной закон диффузии – закон Фика. Вычисление коэффициента самодиффузии газов.
- •63. Некоторые свойства разреженных газов. Физические явления в сильно разреженных газах. Определение вакуума. Течение и равновесие газов в условиях вакуума. Молекулярное течение. Тепловая эффузия.
- •64. Теплопроводность и вязкое трение в ультраразреженных газах.
- •65. Общие свойства жидкостей.
- •66. Молекулярное давление и поверхностное натяжение жидкостей.
- •67. Явления на границе жидкости и твердого тела.
- •68. Избыточное давление под искривленной поверхностью жидкости. Формула Лапласа.
- •69. Капиллярные явления.
- •70. Давление насыщенного пара над искривленной поверхностью жидкости.
- •72. Кипение. Перегрев жидкостей.
- •74. Кристаллические решетки. Решетки Браве. Элементы симметрии решетки. Классификация решеток Браве по кристаллографическим системам.
- •77. Плавление, кристаллизация и возгонка (сублимация) твердых тел.
- •78. Теплоемкость твердых тел. Классическая теория и ее недостатки.
- •79. Фазовая диаграмма кристалл-жидкость-газ. Тройная точка.
- •80. Фазовые переходы первого и второго рода. Фазовая диаграмма гелия.
52. Уравнение Ван-дер-Ваальса – Уравнение состояния неидеальных газов. Опытное определение констант уравнения Ван-дер-Ваальса.
Как отмечалось ранее, при низких температурах и высоких давлениях уравнение Менделеева – Клапейрона для одного моля вещества
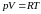 (3.4.1)
(3.4.1)
дает существенные отклонения от значений, измеряемых на опыте.
Были сделаны многочисленные попытки найти уравнение состояния для реального вещества, которое могло бы охватить, если не все состояния вещества, то хотя бы газообразное и жидкое. Из множества предложенных уравнений наибольшей известностью пользуется уравнение Ван-дер-Ваальса:
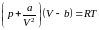 , (3.4.2)
, (3.4.2)
записанное для одного моля вещества. Для молей это уравнение имеет вид:
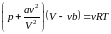 . (3.4.3)
. (3.4.3)
Постоянные
 и
и
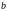 определяются экспериментально и имеют
различные значения для разного сорта
молекул. Уравнение (3.4.2) не выводится,
оно устанавливается введением в уже
известное уравнение Менделеева –
Клапейрона двух поправок. Чтобы обосновать
их введение заметим, что в уравнении
(3.4.2) объем
определяются экспериментально и имеют
различные значения для разного сорта
молекул. Уравнение (3.4.2) не выводится,
оно устанавливается введением в уже
известное уравнение Менделеева –
Клапейрона двух поправок. Чтобы обосновать
их введение заметим, что в уравнении
(3.4.2) объем
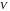 означает объем сосуда, в котором
содержится один моль газа. В случае
идеального газа, состоящего из материальных
точек, весь этот объем доступен
для движения
молекул. В реальном газе сами молекулы
занимают некоторую часть
объема сосуда, и эта часть недоступна
для всех других молекул. Эту часть объема
следует вычесть из объема
.
Тогда уравнение (3.4.2) приобретет вид
означает объем сосуда, в котором
содержится один моль газа. В случае
идеального газа, состоящего из материальных
точек, весь этот объем доступен
для движения
молекул. В реальном газе сами молекулы
занимают некоторую часть
объема сосуда, и эта часть недоступна
для всех других молекул. Эту часть объема
следует вычесть из объема
.
Тогда уравнение (3.4.2) приобретет вид
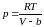 . (3.4.4)
. (3.4.4)
Из последнего выражения видно, что поправка равна тому объему, который занимал бы газ при бесконечно большом давлении, т. е. молекулы реального газа не могут сблизиться друг с другом до расстояния равного нулю, даже при бесконечно большом давлении. Поэтому введение поправки означает приблизительный учет сил отталкивания между молекулами.
Как
мы знаем, между молекулами действуют
не только силы отталкивания, но и силы
притяжения. Любая молекула, расположенная
вблизи стенки сосуда
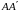 испытывает результирующую силу притяжения
испытывает результирующую силу притяжения
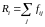 (3.4.5)
(3.4.5)
со
стороны молекул, расположенных в сфере
действия сил притяжения
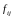 (рис. 51).
(рис. 51).
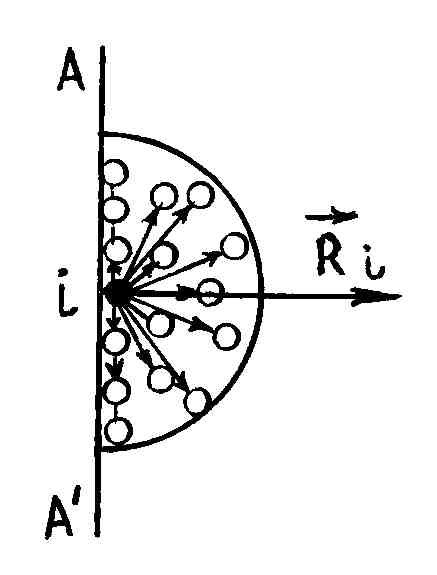
Р и с. 51
На поверхности стенки выберем площадку . Пусть на ней оказалось молекул. Тогда результирующая сила, действующая на молекулы этой площадки со стороны газа
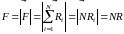 , (3.4.6)
, (3.4.6)
так
как из условий симметрии все силы
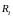 имеют одинаковую величину и направление.
Если силу
имеют одинаковую величину и направление.
Если силу
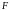 разделить на площадь
,
получим так называемое молекулярное
давление
разделить на площадь
,
получим так называемое молекулярное
давление
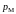 ,
с которым молекулы, находящиеся у стенки,
действуют на остальную массу газа:
,
с которым молекулы, находящиеся у стенки,
действуют на остальную массу газа:
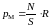 . (3.4.7)
. (3.4.7)
Каждый из сомножителей
в формуле (3.4.7), очевидно, пропорционален
плотности
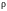 газа, которая, в свою очередь, обратно
пропорциональна объему газа, поэтому
можно записать:
газа, которая, в свою очередь, обратно
пропорциональна объему газа, поэтому
можно записать:
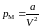 , (3.4.8)
, (3.4.8)
где a – положительный постоянный коэффициент.
Таким образом, в результате действия сил притяжения давление на стенку со стороны газа будет меньше, по сравнению с тем давлением (3.4.4), которое испытала бы стенка, если бы сил притяжения между молекулами не было, т. е.
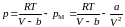 .
.
Откуда находим уравнение Ван-дер-Ваальса:
. (3.4.9)
Поясним появление
в формуле (3.4.9) добавочного давления.
Пусть газ находится в цилиндре под
невесомым поршнем. Внешнее давление
стремится сжать газ, т. е. сблизить его
молекулы. Если бы молекулы газа друг
друга не притягивали, газ испытывал бы
на себе одно только внешнее давление
.
Но взаимное притяжение молекул, как мы
выяснили, также стремится приблизить
молекулы друг к другу, т. е. действует в
том же направлении, как и внешнее давление
.
Поэтому результат притяжения молекул
сказывается в кажущемся увеличении
внешнего давления на газ, как будто бы
к величине давления на поршень
прибавилось некоторое добавочное
давление
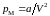 .
.
Опытное определение констант уравнения Ван-дер-Ваальса
Для опытного
определения постоянных a
и
исследуемый газ помещаем в закрытый
сосуд объема
со встроенным манометром и измеряют
давление этого газа при различных
температурах. Численным дифференцированием
полученной на опыте кривой
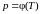 определяем частную производную
определяем частную производную
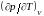 .
Из уравнения Ван-дер-Ваальса находим
эту производную
.
Из уравнения Ван-дер-Ваальса находим
эту производную
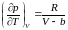 . (3.5.1)
. (3.5.1)
Отсюда получаем величину :
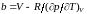 . (3.5.2)
. (3.5.2)
Подставляя выражение (3.5.2) в уравнение Ван-дер-Ваальса (3.4.9), вычисляем другую величину a:
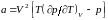 . (3.5.3)
. (3.5.3)
Опыт показал, что
величины a
и
не являются константами, а зависят от
температуры, хотя и слабо. В расчетах,
использующих уравнение Ван-дер-Ваальса,
в качестве констант a
и
берут средние значения функций
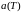 и
и
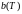 в интересующем интервале температур
в интересующем интервале температур
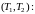
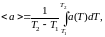
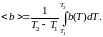
?53. Изотермы уравнения Ван-дер-Ваальса и их сравнение с экспериментальными изотермами. Определение критических параметров вещества из уравнения ВдВ. Метастабильные состояния вещества – пересыщенный пар и перегретая жидкость. Камера Вильсона и пузырьковая камера.
На рис. 52 представлены изотермы газа Ван-дер-Ваальса.
При очень высоких
температурах они имеют форму, близкую
к гиперболам
;
эти изотермы характеризуют газообразное
состояние вещества (почти идеальный
газ). По мере уменьшения температуры
форма изотермы изменяется и при некоторой
температуре
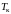 (критическая)
обнаруживает точку
перегиба кривой. При еще меньших
температурах (докритических) изотермы
вместо горизонтального участка,
соответствующего фазовому переходу
жидкость – пар, имеют волнообразный
участок
(критическая)
обнаруживает точку
перегиба кривой. При еще меньших
температурах (докритических) изотермы
вместо горизонтального участка,
соответствующего фазовому переходу
жидкость – пар, имеют волнообразный
участок
 (рис. 53).
(рис. 53).
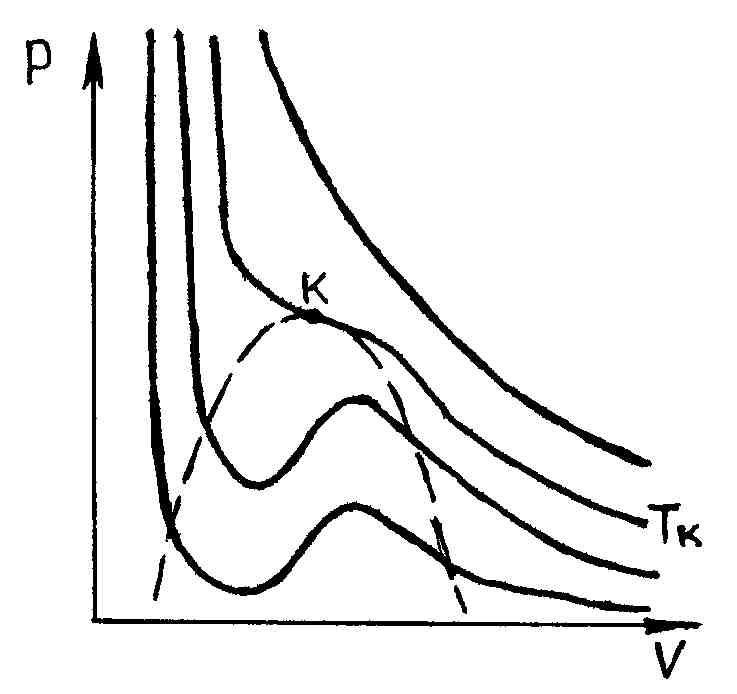

Р и с. 52 Р и с. 53
Измерения показывают,
что изотермы реального вещества
практически совпадают с изотермой
Ван-дер-Ваальса на участках
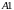 (газообразное состояние) и
(газообразное состояние) и
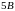 (жидкое состояние). Однако в средней
части вместо горизонтального участка
51, соответствующего фазовому переходу
жидкость – пар, изотерма Ван-дер-Ваальса
имеет волнообразный участок
.
Этот волнообразный участок характеризуется
следующим образом. Участок 12 соответствует
метастабильному состоянию пара
(пересыщенный пар), а участок 54 –
метастабильному состоянию жидкости
(перегретая жидкость). В точке 1 имеется
только насыщенный пар, а в точке 5 –
только кипящая жидкость. Что касается
участка 234 волнообразной кривой, то он
физически неосуществим, так как в природе
нет веществ, для которых при постоянной
температуре увеличение объема приводило
бы к росту давления. Последнее возможно
только в случае, если на этом участке
температура не является постоянной.
Пересыщенный пар (участок 12) – газообразное
состояние вещества, в котором давление
p
больше, чем
давление насыщенного пара при данной
температуре – можно на опыте получить,
сжимая чистый газ до давления, большего
давления насыщенных паров, и он не будет
конденсироваться. Состояние пересыщенного
пара, хотя и обладает определенной
устойчивостью, но оно менее устойчиво,
чем двухфазное состояние (изобара 135),
при котором, как мы знаем, часть вещества
находится в виде жидкости, а часть – в
виде насыщенного пара. Поэтому при
небольшом внешнем воздействии пересыщенный
пар частично переходит в жидкость, а
оставшийся пар становится насыщенным.
(жидкое состояние). Однако в средней
части вместо горизонтального участка
51, соответствующего фазовому переходу
жидкость – пар, изотерма Ван-дер-Ваальса
имеет волнообразный участок
.
Этот волнообразный участок характеризуется
следующим образом. Участок 12 соответствует
метастабильному состоянию пара
(пересыщенный пар), а участок 54 –
метастабильному состоянию жидкости
(перегретая жидкость). В точке 1 имеется
только насыщенный пар, а в точке 5 –
только кипящая жидкость. Что касается
участка 234 волнообразной кривой, то он
физически неосуществим, так как в природе
нет веществ, для которых при постоянной
температуре увеличение объема приводило
бы к росту давления. Последнее возможно
только в случае, если на этом участке
температура не является постоянной.
Пересыщенный пар (участок 12) – газообразное
состояние вещества, в котором давление
p
больше, чем
давление насыщенного пара при данной
температуре – можно на опыте получить,
сжимая чистый газ до давления, большего
давления насыщенных паров, и он не будет
конденсироваться. Состояние пересыщенного
пара, хотя и обладает определенной
устойчивостью, но оно менее устойчиво,
чем двухфазное состояние (изобара 135),
при котором, как мы знаем, часть вещества
находится в виде жидкости, а часть – в
виде насыщенного пара. Поэтому при
небольшом внешнем воздействии пересыщенный
пар частично переходит в жидкость, а
оставшийся пар становится насыщенным.
Перегретую жидкость (участок 45) – состояние, характеризующееся тем, что оно существует при давлении более низком, чем давление насыщенного пара при данной температуре – можно получить при длительном кипячении чистой жидкости, в результате чего из жидкости удаляются газовые пузырьки (центры парообразования), и жидкость нагревается до температуры выше температуры кипения при данном давлении. Состояние перегретой жидкости также оказывается менее устойчивым, чем состояние равновесия между жидкостью и насыщенным паром. Если в такую перегретую жидкость ввести частицы постороннего вещества, то совершается быстрый переход ее в двухфазное состояние.
Состояния пересыщенного пара и перегретой жидкости используются в приборах ядерной физики (камера Вильсона и пузырьковая камера) для регистрации и измерения параметров элементарных частиц.
Если на изотерме Ван-дер-Ваальса волнообразный участок заменить некоторой горизонтальной прямой 135, то полученная так изотерма будет качественно правильно описывать и двухфазное состояние вещества. Положение этой прямой может быть определено, если к замкнутому обратимому циклу 1234531 применить второе начало термодинамики в записи Клаузиуса (2.13.7):
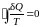 . (3.6.1)
. (3.6.1)
Поскольку вдоль всего пути 1234531 температура вещества остается неизменной (ибо этот путь составлен из участков двух возможных вариантов одной и той же изотермы), то последнее уравнение может быть записано в виде
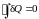 .
.
Подставляя в это соотношение значение из первого закона термодинамики и учитывая, что
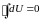 ,
,
получаем для рассматриваемого цикла:
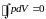 . (3.6.2)
. (3.6.2)
Проделаем с последним равенством очевидные преобразования
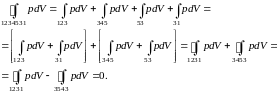 (3.6.3)
(3.6.3)
Откуда находим
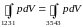 , (3.6.4)
, (3.6.4)
т. е. горизонтальную прямую 135 нужно провести так, чтобы заштрихованные на рис. 53 площади были равны.
Как было уже
отмечено, в критической точке изотерма
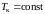 имеет касательную и перегиб, поэтому в
этой точке должны выполняться соотношения
имеет касательную и перегиб, поэтому в
этой точке должны выполняться соотношения
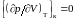 , (3.6.5)
, (3.6.5)
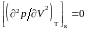 , (3.6.6)
, (3.6.6)
где
запись
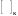 означает, что соответствующие производные
вычисляются при значениях параметров
вещества, равным критическим. Записав
уравнение Ван-дер-Ваальса в виде
означает, что соответствующие производные
вычисляются при значениях параметров
вещества, равным критическим. Записав
уравнение Ван-дер-Ваальса в виде
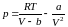 , (3.6.7)
, (3.6.7)
вычислив
затем производные
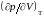 и
и
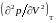 ,
приравняв
их к нулю, нетрудно получить
,
приравняв
их к нулю, нетрудно получить
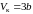 , (3.6.8)
, (3.6.8)
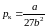 , (3.6.9)
, (3.6.9)
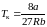 . (3.6.10)
. (3.6.10)
Из выражений (3.6.8–3.6.10) следует, что соотношение
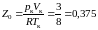 (3.6.11)
(3.6.11)
не
зависит от природы вещества. Опыт же
показывает, что величина
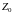 имеет разные значения для различных
газов: для водорода она равна 0,33, для
кислорода – 0,29, для углекислого газа –
0,22. Эти существенные расхождения величины
с экспериментальными данными
свидетельствуют, что уравнение
Ван-дер-Ваальса, из которого эта величина
получена, является приближенным, хотя
качественная картина изменения состояния
вещества передается уравнением достаточно
правильно. Известно большое число
попыток получения более точного уравнения
состояния вещества. Однако эти уравнения
содержат большое число поправочных
коэффициентов, физический смысл которых
неясен, как в уравнении Ван-дер-Ваальса.
имеет разные значения для различных
газов: для водорода она равна 0,33, для
кислорода – 0,29, для углекислого газа –
0,22. Эти существенные расхождения величины
с экспериментальными данными
свидетельствуют, что уравнение
Ван-дер-Ваальса, из которого эта величина
получена, является приближенным, хотя
качественная картина изменения состояния
вещества передается уравнением достаточно
правильно. Известно большое число
попыток получения более точного уравнения
состояния вещества. Однако эти уравнения
содержат большое число поправочных
коэффициентов, физический смысл которых
неясен, как в уравнении Ван-дер-Ваальса.
В наиболее общем виде методами статистической физики академиком Н. Н. Боголюбовым получено уравнение состояния
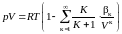 , (3.6.12)
, (3.6.12)
где
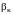 – так называемые вириальные коэффициенты,
которые являются функциями только
температуры. Из уравнения Боголюбова
следует, что чем большее значение
молярного объема
,
тем меньшее число членов ряда следует
учитывать для получения достаточно
точного результата. При
– так называемые вириальные коэффициенты,
которые являются функциями только
температуры. Из уравнения Боголюбова
следует, что чем большее значение
молярного объема
,
тем меньшее число членов ряда следует
учитывать для получения достаточно
точного результата. При
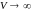 все члены степенного ряда обращаются
в нуль, и уравнение (3.6.12) приобретает
вид
,
т. е., как и следовало ожидать, уравнение
Боголюбова превращается в уравнение
Менделеева – Клапейрона. Вириальные
коэффициенты
не могут быть вычислены чисто теоретическими
методами и поэтому должны определяться
с помощью экспериментальных данных.
Однако эта задача оказывается настолько
сложной, что более целесообразным
является получение уравнения состояния
просто в виде интерполяционной формулы,
описывающей экспериментальные данные.
все члены степенного ряда обращаются
в нуль, и уравнение (3.6.12) приобретает
вид
,
т. е., как и следовало ожидать, уравнение
Боголюбова превращается в уравнение
Менделеева – Клапейрона. Вириальные
коэффициенты
не могут быть вычислены чисто теоретическими
методами и поэтому должны определяться
с помощью экспериментальных данных.
Однако эта задача оказывается настолько
сложной, что более целесообразным
является получение уравнения состояния
просто в виде интерполяционной формулы,
описывающей экспериментальные данные.
